納米羥基磷灰石/聚乙烯醇/海藻酸鈉復合水凝膠的結構與性質研究
王宏麗,陳風雷,李 智,辛 瑩
(成都醫學院藥學院,四川成都 610083)
0 引 言
關節軟骨的損傷和病變是骨科臨床常見疾病,由于關節軟骨組織自身修復能力極其有限,導致患者在軟骨損傷和缺失后往往不能自行修復,因而其修復和功能重建是臨床外科十分重要的研究課題之一[1].組織工程化軟骨,具有取材方便,無免疫排斥反應等優點,一直是關節軟骨缺損修復的研究熱點,其中材料的選擇是組織工程化軟骨研究的關鍵[2-3].目前,在組織工程化軟骨材料的選擇中,人們多選用與軟骨生物力學性能相近的高彈性材料,如硅橡膠、聚氨酯、聚乳酸等作為原料[4-5].其中,硅橡膠不僅易磨損,而且易吸收體液中的油性物質而短期老化失效;作為需長期使用的植入材料,聚氨酯的降解性能有待進一步改進,其固化劑二異氰酸酯的水解產物又是一種潛在的致癌物質.
近年來,利用聚乙烯醇(Polyvinyl alcohol,PVA)水凝膠作為人工軟骨植入材料引起了科研人員的重視[6].PVA水凝膠具有類似天然軟骨的多微孔組織,內含大量的水,是一種可滲透材料.在載荷作用下, PVA材料中擠出的液體被卷吸可作為潤滑劑,其高含水性和表面結構與天然軟骨組織非常相似[7].在透明質酸潤滑條件下,PVA水凝膠與人關節軟骨具有相似的摩擦學特性[8].與大多數合成材料一樣, PVA水凝膠雖然無毒,但缺乏生物活性,不能與骨組織形成生物性結合,無法實現與骨的長久固定.羥基磷灰石(nano-hydroxyapatite,n-HA)是自然骨中主要的無機礦物成分,具有良好的生物相容性與生物活性,能夠與骨組織形成生物鍵合而被廣泛用于人體硬組織修復中,但其脆性較大,常與聚合物復合以提高其韌性和機械加工性能[9].研究發現,海藻酸鈉(SA)溶液在鈣離子存在時可通過離子交聯反應形成交聯的海藻酸鈣聚合物,具有良好的親水性,營養物質易于滲透擴散,并且可在生物體內降解生成甘露糖醛酸和葡萄糖醛酸單體,在生物醫學領域有著廣泛的用途[10-11].據此,本研究綜合3種組分材料的優點,制備了一種n-HA/PVA/SA三元復合水凝膠材料,以期用于軟骨的修復和替換.
1 實 驗
1.1 材 料
實驗所用材料包括:海藻酸鈉(黏度=600 mPa. S,食用級),由青島晶巖生物制品公司提供;n-HA晶體漿液由本實驗室自制[12];PVA(分子量=125,999,分析純)和CaCl2(分析純)均由成都科龍化學試劑公司提供.
1.2 復合水凝膠制備
取適量PVA溶于90℃以上去離子水中配制成濃度為10 wt%的PVA水溶液.將溫度控制在50℃,按n-HA/PVA/SA不同比例稱取各組分,加入SA粉末,繼續攪拌2 h.然后將n-HA漿料加入到上述混合溶液中,70℃攪拌2 h后加入3 mL 3 wt%的CaCl2溶液,在800 rpm轉速下強烈攪拌20 min.脫泡后,將復合液倒入模具中,冷凍成型(溫度為-25℃,時間為6~12 h),然后將試樣于室溫下放置3 h解凍.上述冷凍、解凍過程反復進行5次得到復合水凝膠試樣.
1.3 樣品測試
1.3.1 含水率.
用濾紙吸去復合水凝膠試樣表面的水分后稱重,得復合水凝膠試樣的濕重W1,然后將該試樣真空干燥后再稱重,得復合水凝膠試樣的干重W2.復合水凝膠的含水率(Cw)計算式為,
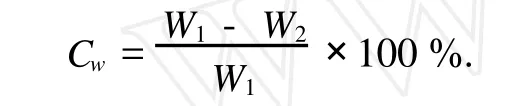
1.3.2 燃燒實驗.
將真空干燥后的復合水凝膠試樣取3個平行樣品置入馬弗爐中,于大氣環境下在800℃燒結4 h,完全燃燒其中的有機物,將殘留物(HA)稱重,記為W3,n-HA在復合水凝膠試樣中的百分含量(Wn-HA)用下式計算,
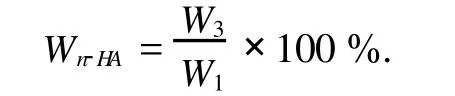
1.3.3 掃描電子顯微鏡(SEM)觀察.
設計意圖:讓學生知道酒精脫色的原理和掌握酒精脫色方法;不用明火水浴加熱酒精,消除可能因操作不當引發火災的安全隱患;恒溫在酒精沸點之下加熱,避免酒精因沸騰飛濺出來意外傷到學生;全班共用一套儀器集中脫色,可以節省儀器、簡化操作、便于課堂管理和安全監控。
試樣經冷凍干燥后,表面均勻噴涂厚度大約為10μm的金膜,用掃描電子顯微鏡(JSM-5900LV,日本)對樣品表面形貌和斷面的微觀形貌進行觀察.
1.3.4 傅里葉變換紅外光譜(IR)分析.
將制備的復合水凝膠試樣碾磨、真空干燥、過200目篩后,用紅外光譜儀(Nicolet-170SX FTIR,PE公司),在波長4 000 cm-1~400 cm-1范圍對試樣所含基團進行分析.
1.3.5 X射線衍射(XRD)分析.
將真空干燥后的復合水凝膠試樣粉末,用XRD射線衍射儀(Cu靶,石墨單色器)(DX-2500型,丹東)對樣品進行晶態分析,掃描管電流/管電壓為40 kV/ 25 mA.
1.3.6 干凝膠吸水率的測定.
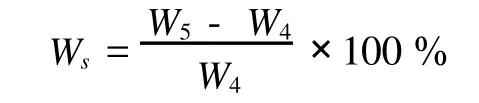
2 結果與討論
2.1 均一性分析
2.1.1 含水率(Cw).
從實驗所制備的復合水凝膠試樣中,隨機取3種,每種分為A、B、C 3份,分別測定其含水率,結果如表1所示.
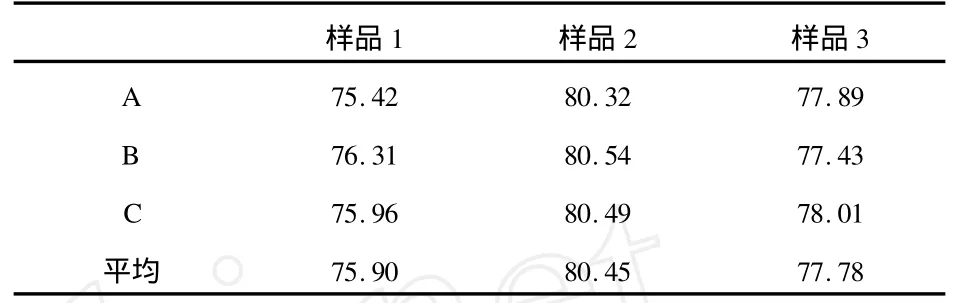
表1 復合水凝膠試樣的含水率(Cw)
從表1數據可看出,水份在復合水凝膠試樣中含量均一.
2.1.2 燃燒實驗.
從實驗所制備的復合水凝膠試樣中,隨機取3種,每種分為A、B、C 3份,按前述方法進行燃燒實驗,結果如表2所示.
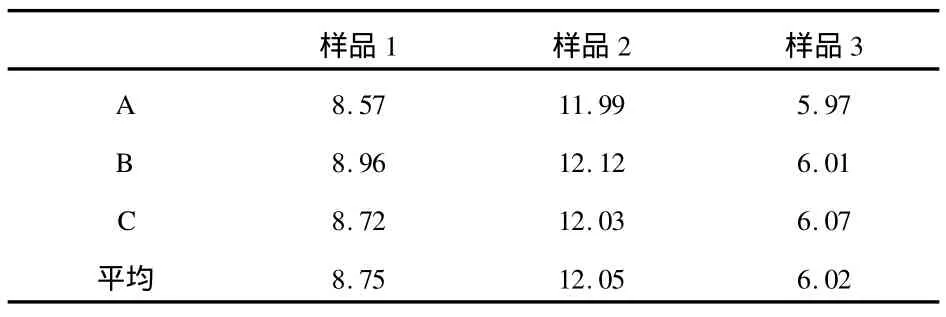
表2 復合水凝膠試樣燃燒實驗中n-HA的百分含量
從表2數據可看出,在復合水凝膠試樣中,n-HA在材料不同部位的含量基本恒定,表明n-HA在復合水凝膠中分布均一,沒有發生相分離.
2.2 SEM觀察
n-HA/PVA/SA復合水凝膠試樣的SEM掃描結果如圖1所示.

圖1 n-HA/PVA/SA復合材料的SEM掃描照片
圖1(a)是實驗所制備的比例為40/40/20的n-HA/PVA/SA復合水凝膠試樣冷凍干燥后的表面不同放大倍數的SEM照片,(b)是其縱切面的SEM照片.從圖1中可以看出,復合材料中無機相n-HA均勻地分散在SA和PVA形成的有機基質中,2種有機相相互交織在一起形成網狀結構,無明顯界面.圖1在微觀上顯示了3相間分散均勻,相容良好,試樣具有大量類似天然軟骨的孔隙結構,孔的貫通性良好.該結構不僅利于細胞的粘附與生長,而且可為細胞進行物質交換提供通道,使其具有較好的生物相容性.同時,實驗還發現,復合水凝膠試樣在載荷作用下,液體可以滲入和擠出,從材料中擠出的液體被卷吸作為潤滑劑.
2.3 IR分析
SA、PVA、n-HA及其復合材料試樣的紅外光譜如圖2所示.
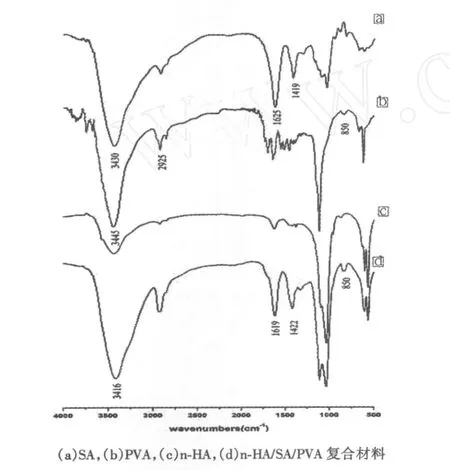
圖2 各組分及復合材料試樣的紅外光譜
圖2(a)是純SA的紅外光譜,在波長3 430 cm-1處附近的強峰是SA中-OH的伸縮振動峰.這個峰在復合材料(見圖2(d))中移動到波長3 416 cm-1處,說明復合材料中SA的羥基與PVA中的羥基之間可能形成了氫鍵.波長1 625 cm-1和1 419 cm-1處的峰分別為SA中-COO-的不對稱伸縮振動和對稱伸縮振動.在復合材料中,由于SA的G單元中的-COO-和Ca2+之間形成蛋殼結構,峰向高頻方向移動到波長1 619 cm-1和1 422 cm-1處.從圖2(b)中可以看出,PVA羥基的伸縮振動峰從波長3 445 cm-1移動到3 416 cm-1處,PVA在波長2 925 cm-1和850 cm-1附近的峰均沒有發生位移,說明復合材料中所含的PVA羥基之間發生了氫鍵鍵合,而其他基團均沒有發生變化.從圖2中還發現,SA和PVA中的-OH峰均發生了移動,顯示n-HA/PVA/SA復合材料中分子間和分子內可能有氫鍵的存在,氫鍵的存在很大程度上提高了材料的機械性能.
2.4 XRD分析
SA、n-HA、PVA及其復合材料試樣的XRD圖譜如圖3所示.
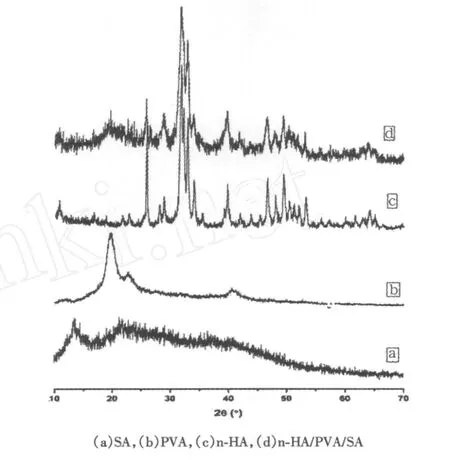
圖3 各組分及復合材料試樣的XRD圖譜
SA是一種非晶態的高聚物,在圖3(a)中,2θ= 13.5°和21.8°處是SA的2個彌散寬峰,但該峰在復合材料中出現得不明顯.在圖3(b)中,2θ=19.3°處出現了PVA的特征峰,但在復合材料中,這2種高分子的特征峰都大幅減弱,這可能是n-HA、SA和PVA分子間存在相互作用,在界面上形成了新的化學鍵合.此外,n-HA的空間位阻效應也可能破壞了SA和PVA分子鏈的排列方式,從而影響了高分子的結晶程度,2θ=25.9°,31.8°,32.2°,32.9°,34°和39.8°屬于HA的(002),(211),(112),(300),(202)和(310)晶相,在形成復合物后沒有發生明顯改變.
2.5 吸水率測定
圖4為含SA為20%,PVA和HA含量不同的5種干凝膠試樣的吸水率測定結果.
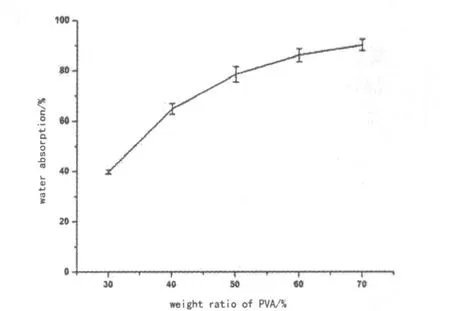
圖4 干凝膠試樣的吸水率
由圖4可看出,隨PVA含量增加,水凝膠復合材料的吸水率逐漸升高.這是因為PVA的增加使有機網絡空間變大,所能容納的水分子增多.一般而言,人體各個部位的軟骨含水率各不相同,但含水率大致在60%~90%之間[13],而本研究制備的復合水凝膠材料的含水率完全可以控制在這個范圍內.
3 結 論
本研究采用溶液共混法制備了n-HA/PVA/SA三元復合水凝膠材料.實驗表明:該復合材料各組分基團間存在相互作用,各組分相容性良好,具有較高的均一性;可通過調控各組分的比例來調節復合材料的吸水率;由于SA可作為活性分子和藥物的載體,且具有可降解性,將其復合入材料中,為制備既可暫時替代又可緩釋藥物并引導軟骨再生的生物材料提供了一種新的思路.
[1]Buckwalter J A.Articular Cartilage Injuries[J].Clinical Orthopaedics&Related Research,2002,402(1):21-37.
[2]LuLichun,Zhu Xun,Valenzuela R G,et al.Biodegradable Polymer Scaffolds Cartilage Tissue Engineering[J].Clinical Orthopaedics&Related Research,2001,391(1):251-270.
[3]Breinan HA,MNas T,HSYH P,et al.Effect of Cultured Autologous Chondrocytes on Repair of Chondral Defects in a Canine Model[J].Bone Joint Surgery,1997,79(A):1439-1451.
[4]Dodge G R,J imenez S A.Glucosamine Sulfate Modulates the Levels of Aggrecan and Matrix Metalloproteinase-3Synthesized by Cultured Human Osteoarthritis Articular Chondrocytes[J].Osteoarthritis Cartilage,2003,11(6):424-432.
[5]Hulmes D J,Marsden M E,Strachan R K,et al.Intra-articular Hyaluronate in Experimental Rabbit Osteoarthritis can Prevent Changes in Cartilage Proteoglycan Content[J].Osteoarthritis Cartilage,2004,12(3):232-238.
[6]K obayashi M,T oguchida J,Oka M.Development of an Artificial Meniscus Using Polyvinyl Alcohol-hydrogel for Early Return to, and Continuance of,Athletic Life in Sportspersons with Severe Meniscus Injury.I:Mechanical Evaluation[J].Knee,2003,10(1): 47-51.
[7]郭大剛,徐可為.聚乙烯醇在生物醫學工程中的應用研究進展[J].生物醫學工程學雜志,2005,22(3):602-605.
[8]Gu Z Q,Xiao J M,Zhang X H.The Development of Artificial Articular Cartilage-PVA Hydrogel[J].Biomed Mater Eng,1998,8 (2):75-81.
[9]李玉寶.納米生物醫藥材料[M].北京:化學工業出版社, 2004.
[10]Morgan S M,Al-Shamkhani A,Callant D,et al.Alginates as Drug Carriers:Covalent Attachment of Alginates to the Rapeutic Agents Containing Primary Amine Groups[J].International Journal of Pharmaceutics,1995,122(1-2):121-128.
[11]Chickering D E,JacobJ S,Desai TA,et al.Bioadhesive Microspheres:Ⅲ.An in Vivo Transit and Bioavailability Study of Drug-loaded Alginate and Poly(fumaric-co-sebacic anhydride) Microspheres[J].Journal of Controlled Release,1997,48(1): 35-46.
[12]Zhang Li,Li Yubao,Wang Xuejiang,et al.Comparision of Compositions and Structural Characterization of Synthetic Nanohydroxyapatite and Mineral Phase from Porcine Femoral Bone [J].High Technology Letters,2004,10(4):48-51.
[13]吳麗君,郭新明.關節軟骨傷病防治[M].北京:人民軍醫出版社,2003.

