不同沉箱結構形式防波堤對港內泊穩影響的試驗研究
鞏世杰,鄭寶友,白玉川,高 峰
(1.天津大學建筑工程學院,天津300072;2.交通運輸部天津水運工程科學研究所工程泥沙交通行業重點實驗室,天津300456)
韓國沿海某地區擬建一港口,該港區目前已建成東側防波堤、南側防波堤和北側防波堤,其中北側防波堤目前長度為1 200 m,其中一期550 m,二期650 m,即將建設1 000 m三期防波堤,工程竣工后,北堤的全長為2 200 m。現三期防波堤擬采用沉箱式防波堤結構,沉箱式防波堤的堤身整體性好,水上安裝工作量小,不需要大型起重設備,施工進度快,箱中填以砂礫可降低造價。在平面布置不變的情況下,現已設計兩種不同結構形式沉箱,即普通直立式沉箱和開孔式直立沉箱,其中,普通直立式沉箱迎浪面無任何特殊結構,為直立光面,由于其結構簡單,預制方便,造價較低,作為首要考慮的第一方案;開孔式直立沉箱采用較為復雜的新型結構,沉箱設有開孔消能消浪室并加高頂高程,以期獲得更好的消浪和擋浪效果,作為對比的第二方案。
試驗中以不同入射波向分別對兩種方案進行對比試驗,來研究采用不同沉箱結構方案時,堤前波高、越浪及堤后次生波影響、港內波高傳播分布規律及碼頭前泊位處的波高情況等,為最終設計方案的選用提供科學依據。
1 試驗依據資料
1.1 工程平面布置和結構
(1)港區平面布置。整個港區呈掩護式布局,現有南、東防波堤和北防波堤1期550 m和2期650 m,油碼頭為規劃方案,擬建的北堤三期旨在加強對該規劃碼頭及周邊港區的掩護,位置如圖1所示,三期堤長1 000 m,走向近似呈NE—SW。波浪從SSE、SE向傳播過來,通過北堤與東堤、南堤之間的口門衍射進入港區。兩方案在平面布置上沒有區別,僅結構形式不同,其中方案一采用直立式沉箱結構,方案二采用開孔式直立沉箱,迎浪、背浪面均設開孔層、并作凹凸型迎浪面處理。
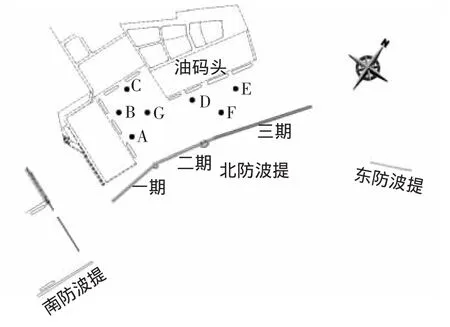
圖1 平面布置圖Fig.1 Location of the project
(2)沉箱斷面結構。北防波堤三期的建設有兩種方案[2],其中:方案一:普通直立式沉箱。普通直立式沉箱斷面詳見圖2-a,堤頂高程+9.00 m,堤身寬度19.50 m,胸墻高5 m,采用明基床,基床外側用護底塊石包圍,增加基床的穩定性,沉箱內部填放10~100 kg塊石增加沉箱重量,提高穩定性。
方案二:開孔式沉箱。開孔式直立沉箱斷面詳見圖2-b,堤頂高程+10.00 m,堤身寬度47.11 m,其中堤身前部19.817 m和后部8.17 m是開孔部分,海水與結構物的作用力分散開來,減小波高,起到消能的作用,同樣沉箱內部填放10~100 kg塊石增加沉箱重量,采取明基床的形式,保持沉箱穩定。該沉箱結構較為復雜,迎浪面設有兩層開孔消能消浪室,其中第一層采用間隔布置呈梯形凸出的消能室,附著于相鄰的第二層開孔消能室。同時,在沉箱背側面也設有一層開孔消能室。

圖2 北防波堤沉箱斷面結構圖Fig.2 Structural drawing of north breakwater
1.2 水文資料
(1)水位:設計高水位:+0.66 m。
(2)外海波要素:波向為SE、SSE向;波高為SE向Hs=10.44 m、SSE向Hs=10.76 m;周期為SE向Ts=12.91 s、SSE向Ts=13.30 s;重現期50 a一遇。
1.3 規范規程
(1)交通部《海港水文規范》(JTJ213-98);(2)交通部《波浪模型試驗規程》(JTJ/T234-2001);(3)交通運輸部《海岸與河口潮流泥沙模擬技術規程》(JTJ/T233-2010)。
2 主要試驗內容
(1)采集使用兩種防波堤方案港內各采集點的波高值,主要是觀測防波堤越浪情況和監測港內波高分布,考察各泊位處的泊穩條件等;
(2)試驗的波浪為不規則波,波譜為Bretschnejder—光易譜[3](B-M譜)。
3 試驗設備與方法
3.1 試驗設備
試驗水池長40.0 m、寬35.0 m。造波機為不規則搖板式造波機,造波機位置距離防波堤30.0 m(大于6~7倍波長),波浪傳播方向的兩側邊界在不影響模型布置的前提下設直立吸收式導波設施,防止波能橫向擴散,而波浪傳播末端和造波機北面的開邊界水域均設吸收消波裝置,以消除二次反射影響。
試驗造波機由造波板、伺服驅動器、伺服電機、編碼器、服務器、計算機及其外設組成,為可移動式,便于轉換波向。按所需波浪對應一定參數,由計算機完成造波控制信號的計算,經接口電路將造波控制信號傳輸到伺服驅動器中,由伺服驅動器控制伺服電機的轉動,電動缸將伺服電機輸出軸的轉動轉換為電動缸推桿的直線運動,并經過杠桿機構將運動傳遞到推波板,帶動推波板產生期望的水波。同時,配套SG2008型波浪試驗采集系統和相機、攝像機等。
3.2 模型設計與試驗方法
(1)相似準則。模型根據重力相似準則設計,模型的幾何比尺為λ=120,重力比尺為λF=λ3,時間比尺λt=λ0.5。
(2)模型制作。工程區域海底地形相對平緩,根據實測地形數據,采用樁點法(網格間距1.5 m)制作海床,各高程點精度控制在±2 mm以內[4]。碼頭和各段防波堤的外形尺寸和高程按設計圖紙模擬。在保證波浪傳播相似的前提下,對各相關建筑物的結構進行合理的概化,其中碼頭區采用混凝土和木板(主要模擬開孔)模擬,而各段防波堤均為PVC材料加工,其中開孔為三維雕刻機加工,以保證孔距和尺寸的精確,同時按照質量和規格模擬TTP等相關堤身護面塊體。
(3)試驗步驟。在完成地形之后,安裝造波機,使波浪入射方向與實際相同。為保證模擬波浪的波要素經過比尺轉換滿足水文資料要求,需進行率波。利用傳感器采集波浪,通過分析系統得到統計數據,如若與水文資料不符,則改變造波機輸入參數Hs和Ts,直至得到滿足試驗的數據為止,此次試驗的率波傳感器擺放在擬建北防波堤三期的位置,自南向北共11個,率波點的波高數據是外海波要素經過數模推算的計算值,由于折射和沿程衰減,其波高值略小于深水波要素。率波完成后,將方案模型按照平面圖放置港池中進行方案試驗,傳感器布置在港內及防波堤周圍,采集港內及防波堤周圍波高的信息。
4 試驗結果與分析
4.1 SSE向入射波
(1)方案一:普通直立式沉箱。波浪傳到北防波堤的時候發生反射,反射波與入射波相疊加,致使北防波堤沿線波高急劇增加,有越浪產生,隨著波浪的傳播,波峰線不斷越過北堤,在港內形成次生波,一期、二期、三期都有越浪,其中二期、三期區段越浪十分明顯。與此同時,波浪傳播到南堤和東堤入口,發生衍射后,繼續傳播到港區。進入港區的波浪,都是經過折射和衍射的,波高比港區外部的波高小,有利于保證港內水面的平穩。從圖3-a可知,北堤海側的有效波高基本為10.0~11.0 m,在三期與二期的連接處有效波高達到最高11.0 m[5],此處的越浪最大,港內的有效波高為1.6~2.5 m,所以北堤的掩護作用十分明顯。靠近油碼頭處和油碼頭南側夾角區域的港前水深為2.0 m,北防波堤堤后有效波高為2.0~2.5 m,造成港內波高仍然較大的原因主要有以下幾點:首先入射波波周期較長,均在10 s以上,從而波長較大,因此易于傳入港內,且有2個口門允許波浪傳入;其次波高較大,在堤前發生較劇烈的越浪,堤后次生波仍然較大,從而影響港內波高分布;最后,港內各泊位以及堤身后側均為直立結構,因此港內各反射波、繞射波的疊加,造成港池各種波能的諧振,進而加劇局部碼頭前沿的波高增大,特別是夾角區域波高。所以在靠近建筑物處波高高于港池內其他地方。
(2)方案二:開孔式直立沉箱。波浪傳到防波堤后進入消能室,明顯的改善了堤前的波高,且由于堤頂高程的增加,越浪產生的數量和高度都有所減少。開孔沉箱最大的優勢表現在對越浪的改善,雖然受入射波較大的影響,越浪和次生波未能完全消除,但一定程度上還是削弱了堤前波高,這主要是歸功于兩方面:其一就是開孔處理上,降低了反射系數,減少越浪量[6];其二就是凹凸結構,特別是斜向入射波,沿堤傳播的能量一定程度上得到消散;其三堤頂高程的增加。從圖3-b所示,三期堤前波高比上一方案有所減小,只有部分區域有效波高達到10.0 m,三期與二期的連接處有效波高由11.0 m降為10.0 m,堤后有效波高由2.0 m降為1.8 m。由于越浪的減少,其后產生的次生波影響也減弱,三期堤后有效波高基本小于方案一。與方案一相比,北防波堤三期所掩護的油碼頭處有效波高由2.1~2.3 m降為2.0~2.1 m,其他位置波高基本不變,泊位處波高略有改善。
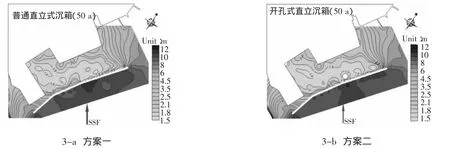
圖3 SSE向有效波高分布圖Fig.3 Significant wave height distribution of SSE
4.2 SE向入射波
(1)方案一:普通直立式沉箱。SE向入射波是垂直北防波堤入射,入射波與防波堤相互作用十分明顯,波浪遇防波堤反射,堤前波高急劇增加,有效波高為10.0~11.0 m,如圖4-a所示。由于本實驗采用不規則波,波高大于10.0 m的波浪整體可以越過防波堤直接傳播到港區內部,產生次生波,三期的北側堤后有效波高達到3.0 m,是由東堤衍射入港內的波浪和大量越浪相疊加形成的。三期與二期相連接處堤前有效波高為11.0 m,堤后有效波高接近3 m,是因為波浪整體越過北堤的影響。這個波向與SSE向相比,Hs、Ts相近,港區內部波高分布有所不同,入射波為SE向時港內北側的有效波高要大于入射波為SSE向的時候,而港區南側的有效波高則相反,原因是SSE向入射波垂直入射,東堤口門較寬,便于入射波進入港區,而南堤口門較小,入射波不易進入港區,加上越浪在港內生成次生波的影響,導致港區北側有效波高大于SSE入射波時;當入射波為SSE時,入射波與北防波堤一期的夾角小于90°,容易在南堤口門入射,入射波進入港區后繼續往港區南側夾角區域傳播,加上碼頭前沿都是直立式結構,波浪反射相互疊加,致使港區南側的有效波高大于入射波SE時。
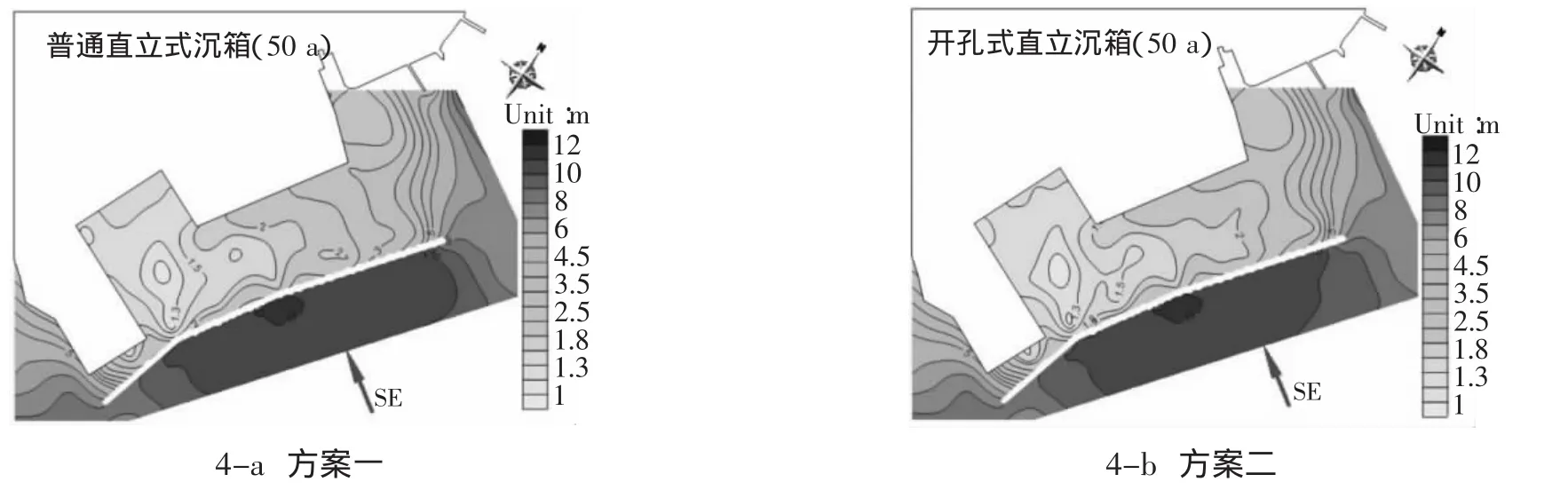
圖4 SE向有效波高等高線Fig.4 Significant wave height distribution of SE
(2)方案二:開孔式直立沉箱。由于入射波垂直北堤入射,開孔結構的功能主要體現在減小反射系數,在一定程度上削弱了堤前波高,但由于試驗波高大、周期長,越浪和次生波未能完全消除,但還是一定程度有所緩解。不規則波中的大波不斷越過堤身進入港區,由于頂高程變高和消浪的影響,越浪量比方案一有所減少,越浪在堤后形成次生波,繼續往港內傳播,與東堤和南堤衍射入港內的波浪疊加,共同影響港內的有效波高。從圖4-b中可知,堤后的有效波高小于方案一,一是由于越浪量有所減少;二是由于堤后有開孔設計,對堤后次生波和衍射入波有消能作用。在三期與二期的連接處,堤前有效波高仍然是11.0 m,與方案一相比,改善不是很明顯。三期堤后南側港區的有效波高由方案一中的2.0~2.3降為1.8~2.0,原因是三期堤后開孔,減小了波的反射系數。從圖4中可知,兩個方案做對比,除口門位置處受入射波影響較大,變化不是很明顯,但開孔式直立沉箱對港內的掩護情況略好于直立式沉箱。
4.3 方案對比
由圖1所示,其中在港內標出A、B、C、D、E、F、G共7個測點,其測得的有效波高見表1,從表1中可知,方案二測得的結果整體上略好于方案一的結果。由平面布置圖可知,北防波堤三期主要掩護后面的油碼頭,測點位置為D、E、F3個測點,這3個點所采集的數據,方案二均不大于方案一。
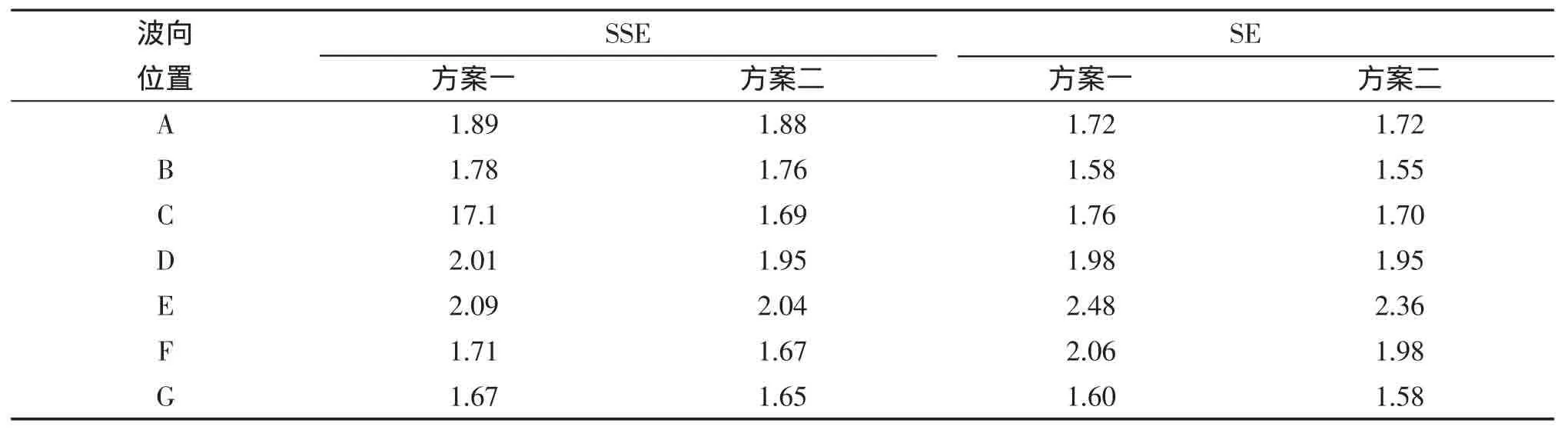
表1 兩方案港內不同水域波高對比Tab.1 Difference of two projects′A~G H13%
5 結語
入射波遇到防波堤的阻礙,通過衍射進入港區,使港內波能重分布,因此防波堤事實上起到了一定的掩護作用,但各碼頭泊位前的波高還會受到不同程度的越浪后次生波和港池諧振的影響,這取決于不同結構防波堤的消浪效果。由試驗可知,三期防波堤有效增強了對港池的掩護、降低了港內波高,采用開孔式直立堤對港內的整體泊穩情況略好于普通直立堤。若從經濟及工程量等方面來講普通直立堤可滿足此次工程要求,從對港內泊穩條件的影響,再考慮開孔式直立堤兼顧親水以及韓國十分重視堤身的景觀價值,推薦方案二。
[1]習和忠.開孔沉箱防波堤消浪作用的理論研究及應用[J].港口工程,1994(4):11-16.XI H Z.Theoretical Research and Application of Perforatred Caisson Breakwater′s Decrease Wave Faction[J].Port Engineering,1994(4):11-16.
[2]鄭子龍,戈龍仔.蔚山港物理模型報告[R].天津:交通運輸部天津水運工程科學研究院,2011.
[3]邱大洪.工程水文學[M].北京:人民出版社,1999.
[4]JTJ/T234-2001,波浪模型試驗規程[S].
[5]JTJ213-98,海港水文規范[S].
[6]陳雪峰,李玉成,孫大鵬,等.波浪與開孔沉箱作用的實驗研究[J].中國海洋平臺,2001(16):5-6.CHEN X F,LI Y C,SUN D P,et al.An Experimental Study of Wave Acting on Perforated Caisson[J].China Offshore Platform,2001(16):5-6.

