殼聚糖紡絲原液性能及其成纖性能的研究*
顏曉菜 何 勇 黃 勝 梁列峰
(1.西南大學紡織服裝學院,重慶,400715;2.重慶市纖維檢驗局,重慶,401121)
甲殼素主要來源于蝦、蟹、昆蟲等甲殼類動物,年自然產量僅次于產量居首的纖維素,是自然界中唯一存在的堿性多糖[1]。殼聚糖是甲殼素經濃堿高溫處理后,脫N-乙酰后的產物,化學結構與纖維素相似。殼聚糖無毒,可被生物降解,具有顯著抑制真菌繁殖等作用,廣泛應用于醫藥、農業、輕紡、功能材料等方面[2-6]。殼聚糖纖維可用于醫用吸收性手術縫合線、醫用棉、醫用敷料和高級服裝材料等。殼聚糖分子的本體立構規整性和較強的分子間氫鍵,在多數有機溶劑、水、堿中難以溶解。目前對殼聚糖纖維的開發多采用共混紡絲法,純殼聚糖纖維的報道相對較少[7-11]。殼聚糖在稀酸溶液中是陽離子聚電解質,其溶液性質同普通高分子溶液有較大差異,并會影響纖維的性能,所以有必要研究殼聚糖紡絲原液的性能。本試驗希望通過研究殼聚糖紡絲原液性能及后期成纖工藝的改進,如紡絲原液濃度、紡絲溫度、凝固浴濃度等因素,制備較理想的純殼聚糖纖維。
1 試驗部分
1.1 儀器和材料
JA-2003A型電子天平(0.000 1 g);HDI-3型恒溫磁力攪拌器(上海梅穎浦儀器儀表制造有限公司);醫用注射器;NDJ-8S型數字顯示黏度計(上海精密科學儀器有限公司);Y802N型八籃恒溫烘箱(南通宏大試驗儀器有限公司);HH-4型數顯恒溫水浴鍋(常州澳華儀器有限公司)。
殼聚糖(浙江澳興生物技術有限公司);冰乙酸(重慶北碚化學試劑廠);無水乙醇[慶川東化工(集團)有限公司]。
1.2 試驗方法
①分別配制不同質量濃度的殼聚糖紡絲原液,常溫下靜置脫泡,觀測其黏度隨時間的變化,研究其穩定性;②觀測不同質量濃度殼聚糖紡絲原液黏度隨溫度的變化規律,以確定紡絲溫度;③通過殼聚糖質量濃度、凝固浴中的氫氧化鈉質量濃度、紡絲溫度、凝固溫度四個因素的正交試驗,觀測各個初生纖維表面形貌,從而確定紡絲工藝路線。
2 結果分析
2.1 不同質量濃度殼聚糖紡絲液的穩定性
圖1為三種不同質量濃度的殼聚糖紡絲原液(用體積分數3%乙酸水溶液配制)在常溫(20℃)下放置的黏度變化情況。在20℃,三種質量濃度的殼聚糖紡絲原液都比較穩定,黏度曲線基本上平穩,且隨著殼聚糖質量濃度的提高,其黏度有較大升高,尤其當質量濃度上升到0.05 g/mL時,黏度增加更大。這是因為殼聚糖在酸溶液中會有一定程度溶脹,質量濃度大時,甚至會形成凍膠。所以在殼聚糖紡絲過程中,對于中等黏度的殼聚糖也只能配制成質量濃度小于0.05 g/mL的溶液。
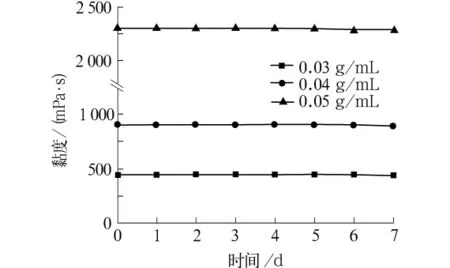
圖1 放置時間對殼聚糖紡絲原液黏度的影響
2.2 不同溫度條件下殼聚糖紡絲原液的黏度變化
圖2為兩種不同質量濃度的殼聚糖原液,在不同的溫度條件下,其黏度變化情況。由圖2可知,兩種質量濃度的殼聚糖原液隨著溫度的升高,其黏度都有較大的變化,總體呈下降趨勢,符合一般高聚物黏度隨溫度的變化規律。且圖2中反映出在20~30℃條件下,黏度變化較小,說明在該溫度區間內,殼聚糖紡絲液的穩定性較好,所以紡絲溫度應選擇20~30℃為宜。
2.3 正交試驗分析
本試驗選擇對殼聚糖成纖性影響較大的四個因素:殼聚糖質量濃度(A),凝固浴中NaOH質量濃度(B),紡絲溫度(C),凝固浴溫度(D)。參照正交試驗表,設計了一組L9(34)試驗,以10%~90%來表征初生纖維的成纖效果,如表1所示。
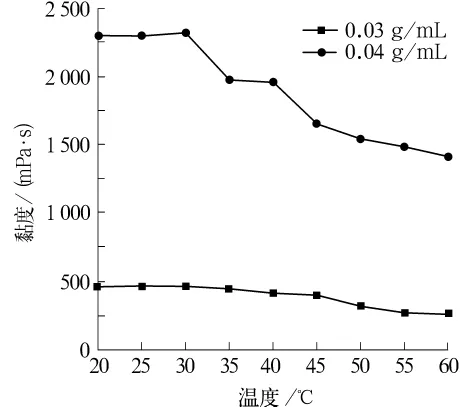
圖2 不同質量濃度的殼聚糖紡絲原液黏度隨溫度的變化

表1 殼聚糖纖維正交試驗表
利用“正交試驗設計助手”對試驗結果進行分析,得到各因素對試驗指標的影響程度。取均值最大時,可得到殼聚糖紡絲成型的最佳工藝組合為:A3B1C1D2。同時根據極差分析可知,影響殼聚糖濕法紡絲成型的因素排序為:A>B>C=D。
圖3和圖4分別為正交試驗中5號和7號樣品實物。圖中可明顯看出,7號試驗所制得的初生纖維表面較為平滑,纖維連續性好,條干均勻,而5號試驗所制得的初生纖維則有較多斷絲,纖維連續性較差,纖維粗細不一。
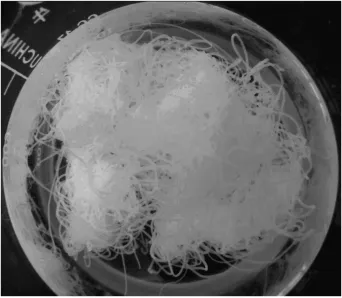
圖3 7號試驗樣品
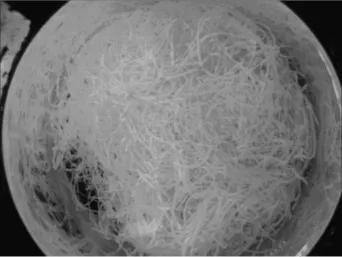
圖4 5號試驗樣品
3 結語
殼聚糖紡絲纖維的結構穩定性受工藝的影響,主要是紡絲原液質量濃度、凝固浴NaOH質量濃度、紡絲原液溫度及凝固浴溫度等。通過對這幾個因素的正交試驗,得到殼聚糖成纖的最佳工藝組合為:殼聚糖質量濃度0.05 g/mL,凝固浴中NaOH質量濃度0.15 g/mL,紡絲原液溫度20~25℃,凝固浴溫度25℃。
[1]蔣挺大.殼聚糖[M].北京:化學工業出版社,2001:1-5.
[2]沈新元.生物醫學纖維及其應用[M].北京:中國紡織出版社,2009.
[3]NEVES S C,TEIXEIRA L S M,MORON L,et al.Chitosan/poly(epsilon-caprolactone)blend scaffolds for cartilage repair[J].Biomaterials,2011,32(4):1068-1079.
[4]KOEV S T,DYKSTRA P H,LUO X,et al.Chitosan:An integrative biomaterial for lab-on-a-chip devices[J].Lab on a Chip,2010,10(22):3026-3042.
[5]KRISHNAPRIYA K P,KANDASWAMY M.A new chitosan biopolymer derivatives as metalcomplexing agent:Synthesis characterization and metal(ll)ion adsorption studies[J].Carbohydrate Research,2010,345(14):2013-2022.
[6]FAN L H,YU L,XU Y M,et al.The novel alginate/N-succinyl-chitosan antibacterial blend fibers[J].Journal of Applied Polymer Science,2010,116(4):2151-2156.
[7]陳雄,廖青,趙國樑.殼聚糖紡纖研究進展[J].天津化工,2009,23(2):8-10.
[8]KHALED E T,SAMUEL M H.Chitosan:Aspects of fiber spinnability[J].Journal of Applied Polymer Science,2006,100:1162-1168.
[9]GHOLIPOUR A,BAHRAMI S H,NOURI M.Optimization of chitosan-polyvinylalcohol electrospinning process by response surface methodology(RSM)[M].E-Polymers,2010.
[10]夏鑫,魏取福,李靜.高分子量殼聚糖/聚氧乙烯復合納米纖維的制備[J].紡織學報,2010,31(3):11-14.
[11]CHEN J H,LOO L S,WANG K A.Enhanced mechanical properities of novel chitosan nanocomposite fibers[J].Carbohydrate Polymers,2011,86(3):1151-1156.

