實驗性自身免疫性腦脊髓炎小鼠中樞神經組織中CD4mRNA的變化及益腎達絡飲對其的影響*
吳彥青 高 穎 朱陵群 婁麗霞 張東梅
(1.天津中醫藥大學,天津 300193;2.北京中醫藥大學東直門醫院,北京 100700)
目前研究認為炎性細胞向CNS的遷移和浸潤是人類多發性硬化(MS)發病的主要因素[1-2]。MS特征性病理改變為中樞神經系統內散在而多發的腦白質或脊髓中的脫髓鞘病灶血管周圍T細胞、B細胞及單核/巨噬細胞浸潤[3-4]。在MS的研究中發現髓鞘抗原特異性CD4+及CD8+T細胞對其臨床和病理改變具重要作用[5]。為進一步明確實驗性自身免疫性腦脊髓炎(EAE)發病過程中樞神經系統炎癥程度的動態變化及中藥益腎達絡飲的作用機制,本部分研究運用實時熒光定量PCR,以β-actin作為對照,檢測不同時間點CD4mRNA在EAE小鼠腦和脊髓中的表達變化,為MS在發病過程中發病程度與中樞神經系統炎性聚集提供依據和下一步可能干預的途徑。
1 材料與方法
1.1 動物 C57BL/6小鼠購自中國醫學科學院實驗動物研究所,實驗動物許可證號:SCXK(京):2005-0013。 選用 8~10 周齡雌性C57BL/6小鼠108只,體質量(18.4±0.8)g。實驗小鼠飼養在中國中醫科學院基礎研究所二級動物中心飼養室。
1.2 試劑 MOG35-55多肽(MEVGWYRSPFSRVVHLYNGK)由北京賽百盛生物工程公司合成,純度(HPLC)98.3%;完全弗氏佐劑(CFA)購自美國 sigma 公司,批號:049K8700;百日咳毒素(PTX)購自美國sigma公司,批號:P7208;結核分枝桿菌(H37RA)購自美國DIFCO公司,批號:0172191;POWERSYBRGREENPCRMASTER試劑購于美國ABI公司,批號:4367659。
1.3 藥物 益腎達絡飲(由熟地黃、石菖蒲、梔子、豨薟草等藥物組成)飲片購自北京中醫藥大學東直門醫院,常規方法煎煮,收集濾液并文火煎煮濃縮制成2 g生藥/mL的水提物。醋酸潑尼松,天津力生制藥股份有限公司,批號:081206,用去離子水配制成0.39 mg/mL溶液。
1.4 模型制備 采用MOG35-55抗原免疫C57BL/6小鼠:將等體積的 MOG35-55 水溶液 (每 100 μL 含 MOG35-55200 μg)與完全弗氏免疫佐劑(每100 μL含結核桿菌H37RA500 μg)混合乳化制成油包水的抗原乳劑。于免疫動物當日記為第0日,模型組、激素組、中藥組每只小鼠背側脊柱中線兩側分4點皮下注射共計0.2 mL MOG35-55抗原配劑,佐劑組每只小鼠背側脊柱中線兩側分4點皮下注射共計0.2 mL不含MOG35-55的油包水乳劑。注射完配劑30 min后,佐劑組、模型組、激素組、中藥組每只小鼠均腹腔內注射0.1 mL(含400 ng PTX)百日咳毒素溶液,48 h后再次腹腔內注射0.1 mL PTX溶液1次;正常組小鼠不給予任何藥物干預。
1.5 分組與給藥 實驗分4個取材時點,即造模后7 d(發病前期)、14 d(發病初期)、24 d(發病急性期)和 40 d(慢性期)。 實驗前將所有C57BL/6小鼠隨機分配至5個組:正常組、佐劑組、模型組、激素治療組、中藥治療組,正常組24只,佐劑組24只,模型組24只,激素組18只,中藥組18只。免疫后第7日起,每日給予各組小鼠灌服相應的藥物。
1.6 神經功能評分 小鼠免疫后,采用盲法由兩名觀察者進行神經功能評分,觀察時間為第0日到第40日(共41 d),評分標準根據Kono等[6]的5級評分法:0分為小鼠不發病;1分為小鼠出現尾部張力降低或輕度步態笨拙;2分為小鼠尾部完全無張力,和(或)中度步態異常,和(或)姿態維持缺乏;3分為小鼠肢體明顯力弱;4分為小鼠肢體麻痹或癱瘓;5分為小鼠處于瀕死狀態。測評分≥1分為發病動物。評價EAE發病嚴重程度的指標包括:每日平均臨床評分、平均起病天數、疾病指數及平均最高評分[7]。
1.7 實時熒光定量PCR檢測CD4mRNA的表達 CD4及βactin引物由北京奧科鼎盛生物科技有限公司合成,引物序列見表1。

表1 引物序列
小鼠在相應時間點處死后,超凈工作臺上快速取大腦和脊髓組織,每組6只,液氮冷凍。取腦或脊髓組織約100 mg,采用異硫氰酸胍一步法抽提組織總RNA。所提總RNA經1%瓊脂糖凝膠電泳確定其完整性,并經紫外分光光度計檢測所提RNA含量和純度。取2.0 μg總RNA進行逆轉錄反應,采用SYBR Green熒光染料技術進行實時熒光定量PCR擴增。記錄其循環閾值(Ct),每個樣品中靶基因的相對mRNA表達采用相對定量公式2-△△Ct計算,其中△Ct值=靶基因 Ct值-β-actin Ct值。
1.8 統計學處理 應用SPSS13.0統計軟件。組間比較采用單因素方差分析,以(±s)表示。P<0.05為差異有統計學意義。
表2 各組EAE小鼠神經功能評分比較(±s)
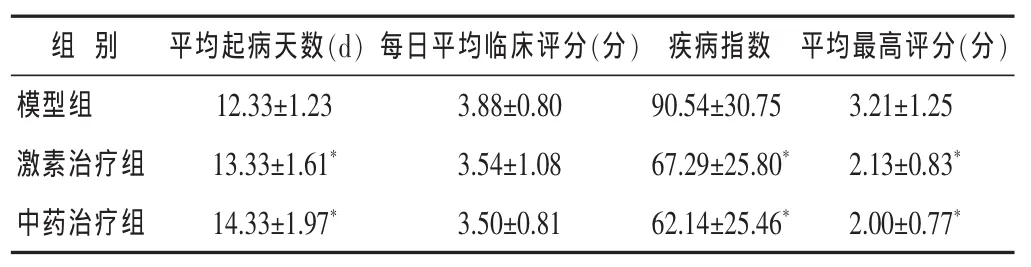
表2 各組EAE小鼠神經功能評分比較(±s)
與模型組比較,*P<0.05。
組 別 平均起病天數(d) 平均最高評分(分)每日平均臨床評分(分) 疾病指數模型組3.21±1.25激素治療組 2.13±0.83*14.33±1.97*12.33±1.23 13.33±1.61*3.88±0.80 90.54±30.75 3.54±1.08 67.29±25.80*中藥治療組2.00±0.77*3.50±0.81 62.14±25.46*
2 結 果
2.1 造模后EAE小鼠行為學觀察結果 見表2。表2示各治療組與模型組相比,各治療組的平均起病天數明顯延遲(P<0.05),平均最高評分明顯降低(P<0.05),疾病指數顯著降低(P<0.05)。
2.2 造模后EAE小鼠腦和脊髓內CD4mRNA的表達 見表3~表4。與正常組比較,免疫后7 d,EAE小鼠腦內CD4mRNA的表達顯著上升(P<0.05),而脊髓內表達未見顯著升高(P>0.05);至免疫后14 d,EAE小鼠腦和脊髓內CD4mRNA的表達繼續顯著上升(P<0.01);免疫后24 d,EAE小鼠腦和脊髓內CD4mRNA的表達繼續顯著上升(P<0.01);免疫后40d,EAE小鼠腦內CD4mRNA的表達仍顯著升高(P<0.01),而脊髓CD4mRNA內表達未見顯著升高(P>0.05)。
表 3 各組大腦組織中CD4mRNA表達比較(CD4/β-actin,±s)
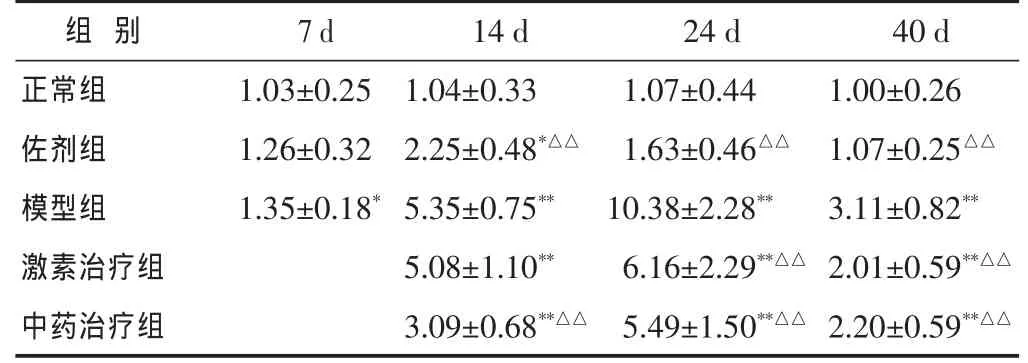
表 3 各組大腦組織中CD4mRNA表達比較(CD4/β-actin,±s)
與正常組比較,*P<0.05,**P<0.01;與模型組比較,△P<0.05,△△P<0.01。下同。
1.35±0.18*5.35±0.75** 10.38±2.28**激素治療組 5.08±1.10** 6.16±2.29**△△ 2.01±0.59**△△中藥治療組 3.09±0.68**△△ 5.49±1.50**△△ 2.20±0.59**△△14 d 24 d 1.04±0.33 1.07±0.44 2.25±0.48*△△ 1.63±0.46△△模型組40 d正常組 1.00±0.26佐劑組 1.07±0.25△△組 別7 d 1.03±0.25 1.26±0.32 3.11±0.82**
表 4 各組脊髓組織中CD4mRNA表達比較(CD4/β-actin,±s)
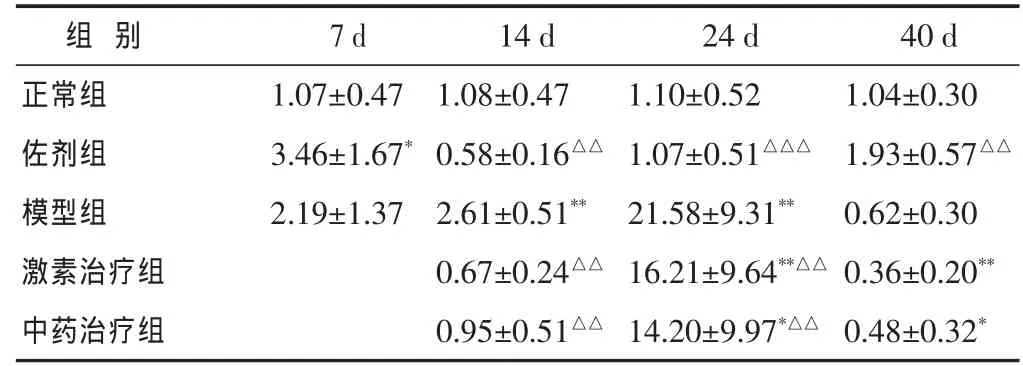
表 4 各組脊髓組織中CD4mRNA表達比較(CD4/β-actin,±s)
14 d 24 d 1.08±0.47 1.10±0.52 0.58±0.16△△ 1.07±0.51△△△模型組40 d正常組 1.04±0.30佐劑組 1.93±0.57△△組 別7 d 1.07±0.47 3.46±1.67*2.19±1.37 2.61±0.51** 21.58±9.31**激素治療組 0.67±0.24△△ 16.21±9.64**△△ 0.36±0.20**中藥治療組 0.95±0.51△△ 14.20±9.97*△△ 0.48±0.32*0.62±0.30
經過益腎達絡飲治療后在14、24、40 d EAE小鼠腦組織CD4mRNA的表達同樣出現顯著上升(P<0.01),但是與模型組表達比較均出現了顯著下降(P<0.01)。經過益腎達絡飲治療后EAE小鼠脊髓組織CD4mRNA的表達在14 d時尚未出現明顯升高,而在24 d CD4mRNA的表達明顯升高(P<0.05);在40 d時CD4mRNA的表達顯著降低(P<0.05)。
經過激素治療后在 14、24、40 d EAE小鼠腦組織 CD4mRNA的表達同樣出現顯著上升(P<0.01),但是在24、40 d時與模型組小鼠比較均出現了顯著下降(P<0.01)。經過激素治療后EAE小鼠脊髓組織CD4mRNA的表達在14 d時尚未出現明顯升高,而在24 d CD4mRNA的表達明顯升高 (P<0.05),在40 d時脊髓中CD4mRNA的表達出現顯著降低(P<0.01)。
佐劑組在免疫后7 d,與正常組比較,小鼠腦內CD4mRNA的表達未見明顯改變,而脊髓內CD4mRNA的表達顯著上升(P<0.05)。免疫后14 d,佐劑組小鼠腦內CD4mRNA的表達顯著上升(P<0.05),但是與模型組相比,表達顯著降低(P< 0.05)。免疫后24、40 d,與正常組比較,佐劑組小鼠腦和脊髓內CD4mRNA的表達均未見顯著改變;與模型組相比,腦和激素內CD4mRNA的表達均顯著降低(P<0.01)。
3 討 論
實驗性自身免疫性腦脊髓炎模型是自身免疫性疾病的一個重要的動物模型,其免疫學特征、病理改變和臨床表現與多發性硬化非常相似,被認為是研究MS發病機制和尋求新的治療方法的理想的動物模型[8-11]。 研究表明[12-13],人 MS 及其動物模型EAE是一類主要由T細胞介導的自身免疫性疾病,T細胞針對髓鞘成分的反應在MS的發病過程中起到了關鍵的作用。其主要發病機制是某種誘因作用下激活的T細胞透過血腦屏障(BBB)進入到腦實質結合中樞的抗原遞呈細胞(APC)抗原,通過再刺激分泌出大量的趨化因子和細胞因子,進一步促使B細胞和巨噬細胞的活化,募集外周血T細胞、單核細胞以及B細胞等進入到炎癥部位,從而導致中樞神經軸索的損害以及神經組織的炎癥脫髓鞘反應。
有實驗研究結果表明[14],自身反應性CD4+Th細胞是啟動EAE病理過程的主要效應性T淋巴細胞。盡管CD4+Th細胞的活化對EAE的啟動、誘導非常重要,但目前普遍認為EAE病程中的效應細胞(即巨噬細胞譜系)包括CNS本身的小膠質細胞以及從血液浸潤的單核細胞,是造成組織破壞和髓鞘脫失的主要原因。因此,淋巴細胞和單核/巨噬細胞浸潤是MS的根本原因。
本實驗觀察了免疫后7、14、24、40 d EAE小鼠腦和脊髓內CD4mRNA的表達,表達量均顯著高于正常值,其中尤以免疫后24 d表達量最高,這一結果與疾病的臨床神經功能損傷程度基本一致。脊髓組織在發病前期即免疫后7 d雖有升高,但不具有顯著性差異,考慮原因可能是脊髓中BBB的破壞比腦中在時間上有所延遲;而且在40 d脊髓組織中CD4mRNA的表達沒有升高,反而出現了輕度下降,考慮原因可能是機體對炎性改變的自我反應所致。中藥治療組在免疫后14、24、40 d腦內CD4mRNA的表達均出現了顯著下降,在14 d降低CD4mRNA在腦內的表達為中藥組延遲疾病發生提供了證據,而在免疫后24、40 d降低CD4mRNA在腦內的表達為益腎達絡飲能夠降低臨床神經功能評分提供了依據。同時,這一研究也支持了CD4+在腦內的表達與EAE的發病有著密切聯系[15]。
[1]Lu JQ,Fan Y,Mitha AP,et al.Association of alpha-synuclein immunoreactivity with inflammatory activity in multiple sclerosis lesions[J].J Neuropathol Exp Neurol,2009,68(2):179-189.
[2]Sloane E,Ledeboer A,Seibert W,et al.Anti-inflammatory cytokine gene therapy decrea sessensory and motor dysfunction in experimental Multiple Sclerosis:MOG-EAE behavioral and anatomical symptom treatment with cytokine gene therapy[J].Brain Behav Immun,2009,23(1):92-100.
[3]徐全剛,王曉輝,田書娟.趨化因子MCP-l、MIP-1α在EAE小鼠脊髓中的表達[J].腦與神經疾病雜志,2007,15(3):2l6-2l9.
[4]Bennett J,Basivireddy J,Kollar A,et al.Blood-brain barrier disruption and enhanced vascular permeability in the multiple sclerosis model EAE[J].J Neuroimmunol,2010,229(1-2):180-191.
[5]梅云華,徐凌云.CD8+T細胞在多發性硬化中的致病性作用[J].生命科學,2006,18(3):244-246.
[6]Kono DH,Urban JL,Horvath SJ,et al.Two minor determinants of myelin basic protein induce experimental allergic encephalomyelitis in SJL/J mice[J].J Exp Med,1988,168(1):213-27.
[7]Stosic-Grujicic S,Savic-Radojevic A,Maksimovic-Ivanic D,et al.Down-regulation of experimental allergic encephalomyelitis in DA rats by tiazofurin[J].J Neuroimmunol,2002,130(1-2):66-77.
[8]Mix E,Meyer-Rienecker H,Zettl UK.Animal modes of multiple sclerosis for the development and validation of novel therapies-potential and limitations[J].J Neurol,2008,255(Supp16):7-14.
[9]Uboldi C,Doring A,Alt C,et al.L-Selectin-deficient SJL and C57BL/6 mice are not resistant to experimental autoimmune encephalomyelitis[J].Eur J Immunol,2008,38(8):2156-2167.
[10]Schmitt C,Strazielle N,Ghersi-Egea JF.Brain leukocyte infiltration initiated by peripheral inflammation or experimental autoimmune encephalomyelitis occurs through pathways connected to the CSF-filled compartments of the forebrain and midbrain[J].J Neuroinflammation,2012,9(1):187.
[11]Rao P,Segal BM.Experimental autoimmune encephalomyelitis[J].Methods MolBiol,2012,900:363-380.
[12]Bitsch A,Schuchardt J,Bunkowski S,et al.Acute axonal injury in multiple sclerosis.Correlation with demyelination and inflammation[J].Brain,2000,123(Pt6):1174-1183.
[13]Noseworthy JH,Lucchinetti C,Rodriguez M,et al.Multiple sclerosis[J].N Engl J Med,2000,343(13):938-952.
[14]張旭,李佳.實驗性自身免疫性腦脊髓炎的歷史和現狀[J].中國神經免疫學和神經病學雜志,2010,17(1):4-6.
[15]Fabis MJ,Phares TW,Kean RB,et al.Blood-brain barrier changes and cell invasion differ between therapeutic immune clearance of neurotrophic virus and CNS autoimmunity[J].Proc Natl Acad Sci USA,2008,105(40):15511-15516.

