超順磁氧化鐵納米粒子特性研究
趙戎蓉,魯芳
基于特殊的物理和化學性質,納米材料目前已成為表面工程學研究的理想材料。納米粒子作為腫瘤治療中的靶向給藥載體可以提高藥物的靶向作用。因此,對納米粒子的修飾,將促進其在生物醫學中的應用。以超順磁性粒子(superparamagnetic iron oxide nanoparticles,SPION)為載體的微粒靶向遞送系統已成為比較熱門的研究方向[1]。
SPION 由于其磁性核心的特性,可以通過外部磁鐵有針對性地到達特定位置。20 世紀 70 年代末期,外部磁場控制磁性載體的觀點被認同,隨后以各種磁性納米和磁性微粒子作為載體,用于藥物在體內的靶向投遞的研究相繼見諸報道[2]。SPION 由兩部分組成:磁性核心(通常是 Fe3O4、Fe2O3和 γ-Fe2O3)和具有生物相容性的聚合物或多孔生物相容聚合物涂層。該涂層可以被功能化羧基、生物素、抗生物素蛋白、碳二亞胺和其他分子修飾[3],從而起到抗原-抗體偶聯以及靶向作用。此外,聚合物涂層還可以通過共價結合,吸附或包埋藥物實現藥物的投遞[4]。到目前為止,載體優化的目標是:①減少藥物的細胞毒性,從而降低藥物副作用;②減少用量,達到靶向給藥目的。
1 SPION 的穩定性及表面修飾
由于診斷和治療的需要,SPION 已在生物學和醫學領域被廣泛應用。SPION 具有膠體特性,穩定性取決于粒子的大小及粒子與界面的空間位阻和庫侖排斥作用。SPION顆粒足夠小能夠抵消引力造成的沉降,在中性 pH 環境和生理鹽水中也很穩定。另一方面,在制備和合成后期進行生物相容性聚合物涂層,既能避免生物降解,也起到防止粒子聚集,提高其穩定性的目的。
SPION 穩定性主要由 3 個因素控制:疏水/親水性、磁性和范德華力。由于納米粒子的疏水作用,SPION 往往聚集成微米簇,加之磁偶極相互作用,微米簇將進一步聚集。在外部磁場下,這些微米簇可能會出現進一步的磁化從而增加聚集[5]。SPION 的穩定性關系到藥物的釋放效果,磁性和范德華力是 SPION 固有的性質,較難改變。因此,通過表面修飾調節其疏水/親水性就顯得至關重要。明膠、右旋糖酐、聚氨基酸、淀粉、白蛋白、脂質體、殼聚糖、乙基纖維素等天然分散劑已被廣泛用于水介質中對 SPION 的分散。表面修飾分子應該具有生物相容性和生物降解性。表面活性劑分為疏水性、親水性和雙親性 3 類,其中油酸、月桂酸、烷烴磺酸和烷烴膦酸等表面活性分子具有雙親性,可提高 SPION 在溶液中的穩定性,常用作 SPION 的表面修飾[6]。十六烷、甲苯、正己烷等疏水基表面活性劑分子修飾SPION 后易溶于有機溶劑,但無法實現其在生物體中的應用。所以,用親水表層包埋疏水表層,從而獲得雙親聚合物外殼,則可改變 SPION 的生物相容性[7]。Wang 等[8]將疏水表面涂層的 SPION 插入 α-環糊精中,則 SPION 就能從有機相擴散至水相。各種聚合物,如乙烯聯合醋酸乙烯酯(poly ethylene-co-vinyl acetate)、聚乙烯吡咯烷酮(PVP)、聚乳酸、乙醇酸、聚乙二醇(PEG)和聚乙烯醇(PVA)可作為水相中納米粒子的涂層材料。Euliss 等[9]采用聚乙二醇反向乳液方法并以 Disperbyk 120 和四甲基氫氧化銨進行表面修飾,從而合成了親水性磁性納米顆粒。此外,Park等[10]報道在超臨界水中用石墨碳包裹 Fe2O3和 γ-Fe2O3,從而實現其在水介質中的穩定性。
氧化鐵被公認為是無毒的,但部分涂層材料具有毒副作用,故涂層材料的選擇十分重要。表 1 介紹了幾種涂層材料,以下著重介紹二氧化硅在表面修飾中的作用。由于二氧化硅的親水性,經硅涂層后的納米粒子能夠均勻分散在水溶液中,且其具有生物相容性。Philipse 等[11]首先報道了用溶膠凝膠法制備非晶硅涂層磁性納米。在高于二氧化硅等電點(pH 2)時,硅涂層帶負電荷,且二氧化硅羥基(硅羥基組:Si-OH)可與有機物共價鍵連接,通過靜電作用分離生物分子。Bruce 和 Sen[12]報道了大規模合成無定形硅用于磁性納米顆粒修飾。在 pH 13 條件下,將硅酸緩慢加入磁鐵礦溶液中,用稀鹽酸調 pH 值至 10。核-殼磁鐵納米顆粒包被一層薄的硅殼,通過控制硅酸與磁鐵礦溶液的比例,確定DNA 的結合和洗脫。Sen 等[13]用表面加熱法制備球形和管狀多孔的二氧化硅磁性顆粒用于細胞、核酸的提取。近日,Deng 等[14]用加熱法制備微孔 SPION 用于胰蛋白酶的固定。
2 形狀、大小、粒度分布及表面電荷
SPION 形狀、大小和粒度分布是其生物應用的重要參數。Mahmoudi 等[15]采用多場有限元模型研究外加磁場下血管內不同大小和形態的 SPION 的運動情況。仿真結果表明,磁場強度和 SPION 物理性質均能影響其在血管運動中的波動和幅度,進而推測,具有較小波動和較寬幅度的速度場更有利于藥物投遞。
Varanda 等[16]報道,SPION 磁化強度、表面曲率與顆粒大小呈線性。小于 100 nm 的磁性顆粒具有較高的有效表面積(更容易吸附)、較低的沉積速率,有利于向組織擴散,并且能逃離網狀內皮系統(RES)的吞噬,從而延長其在循環系統中的保留時間,又能達到避免毛細血管栓塞的效果。其中直徑大于 10 nm 的顆粒在正常生理條件下無法穿透血管內皮細胞,但在病理條件下,能穿透如炎癥或腫瘤等病理部位。
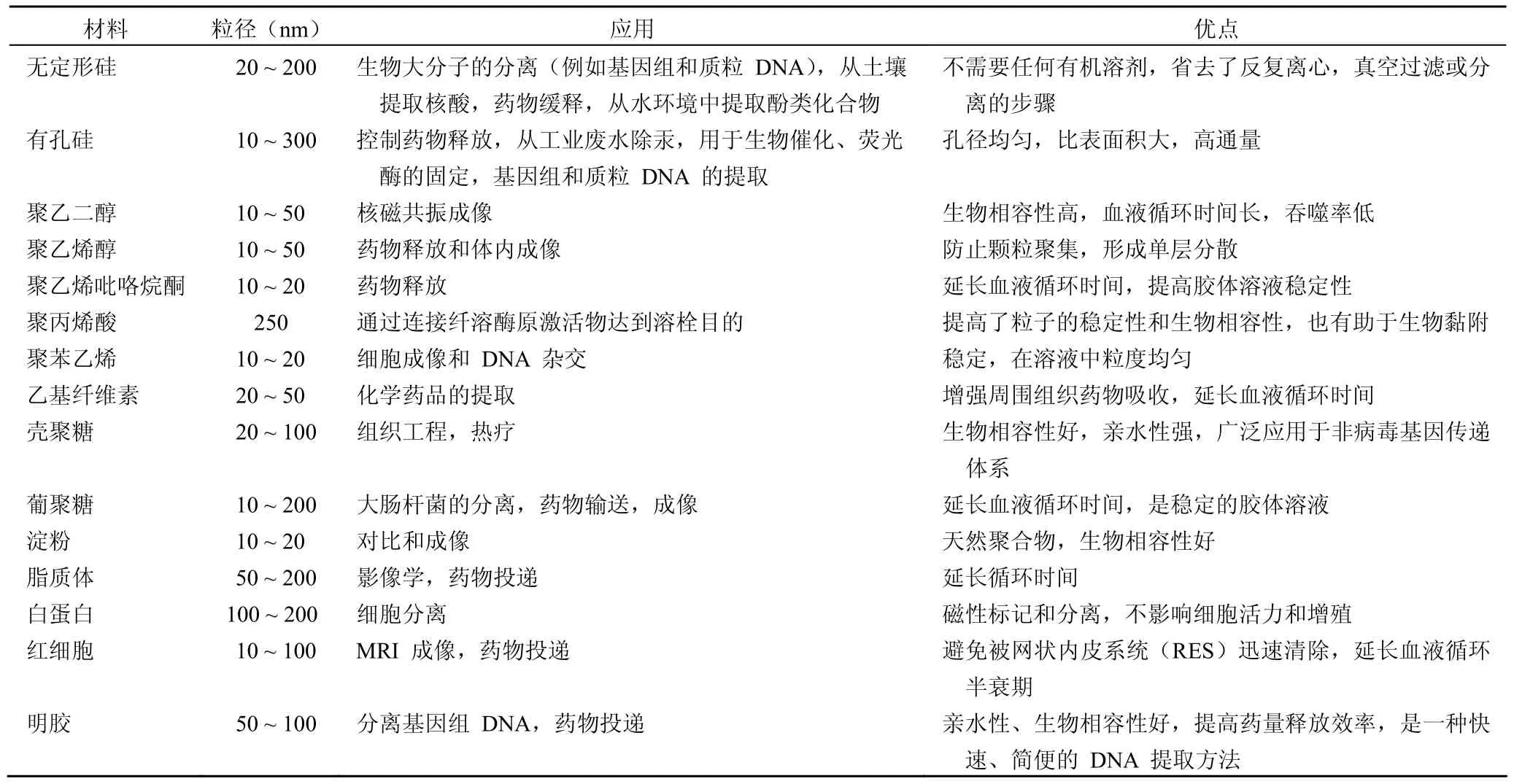
表 1 用于 SPION 的修飾材料
當載藥納米粒子進入血液循環,血漿蛋白對其的吸附作用與粒子的大小、形態和表面電荷相關。表面以聚乙二醇和葉酸修飾的載藥粒子已被證實能有效地抑制體內蛋白質的吸附。由于組織巨噬細胞對入侵微生物和顆粒的高度敏感,大于 200 nm 的顆粒容易被內皮吞噬系統吞噬,因此不適合作為載體[17]。大小介于 10 ~ 100 nm 的 SPION 是最有效的藥物輸送載體[18]。也有研究報道,顆粒較小且具有較高親水性的納米顆粒,能延長在生物體內存留時間[19]。Lee 等[20]報道了聚[3-(三甲硅基丙基)甲基丙烯酸-r-聚乙二醇甲基丙烯酸]涂層的 SPION 可作為穩定的抗蛋白質的磁共振成像探針。結果同時表明,經聚合物涂層的 SPION 循環周期延長。
最近,Osaka 等[21]報道了在不同細胞系中 SPION 表面電荷與細胞吸收效率的關系。針對人乳腺癌細胞,帶有正電荷 SPION 相比帶負電荷的 SPION 更容易被細胞吞噬;對于臍靜脈內皮炎細胞,正負電荷的 SPION 被吞噬差異不大。因此,SPION 被攝取的原因不僅取決于其表面特性,還取決于攝取作用細胞的類型。
3 SPION 的毒性
Mahmoudi 等[22]對 PVA 修飾的 SPION 細胞毒性進行研究,選擇的細胞株為小鼠成纖維細胞和人白血病細胞。結果表明,SPION 無毒性或毒性很小。另外,Karlsson等[23]研究了濃度為 20 和 40 mg/ml 的 SPION 在人肺癌細胞中的毒性,結果顯示,SPION 既沒有對 DNA 造成損傷,也沒有在細胞內產生活性氧化物,但是檢測出少量氧化DNA。另一項研究證實,SPION 對細胞周期的影響僅在G0/G1間隔期[24]。最近,Mahmoudi 等[25]觀察到當 SPION作用細胞后胞內有氣泡產生且細胞粒度增加。有人提出,自溶可能是導致細胞毒性的原因。在體外細胞毒性研究中,由于 SPION 對蛋白質的吸附,蛋白質有可能引起細胞毒性,進而導致判斷錯誤。
由于 SPION 與蛋白質相互作用,使蛋白質結構發生變化,從而導致生物損傷,如纖維性顫動、產生新抗原位點、蛋白質功能缺失等。具體而言,SPION 作用的蛋白質變性可能會暴露新的抗原位點,導致一個新的免疫反應發生[26]。Cedervall 等[27]采用體積排阻色譜(SEC)、表面等離子體共振(SPR)和等溫滴定量熱法研究血漿蛋白與不同磁性粒子的結合/分解率和親和力。Lynch 等[28]也試圖確定和量化不同大小納米系統與蛋白質連接的問題。上述方法對 SPION的體內實驗有指導意義,有助于分析到底是 SPION 還是蛋白質引起的細胞毒性。
4 展望
磁性納米材料具有無創或微創、靶向性強、生物相容性好、治療效果好等優點,可用于疾病診斷和治療中的多個環節,對癌癥的早期診斷與治療有著重要的意義。多功能磁性納米生物材料的研究及其應用已逐漸成為國內外關注的熱點,這些應用涉及到生物化學、電子學、磁學、生物學等學科,是多學科的交叉,目前在醫藥應用技術中,磁性技術已經成為其他技術的有力補充。
[1] Mahmoudi M, Simchi A, Imani M, et al. Templated growth of superparamagnetic iron oxide nanoparticles by temperature programming in the presence of poly (vinyl alcohol). Thin Solid Films,2010, 518(15):4281-4289.
[2] Alexiou C, Arnold W, Klein RJ, et al. Locoregional cancer treatment with magnetic drug targeting. Cancer Research, 2000, 60(23):6641-6648.
[3] Koneracká M, Kop?ansky P, Timko M, et al. Direct binding procedure of proteins and enzymes to fine magnetic particles. J Mol Catalysis B Enzymatic, 2002, 18(1-3):13-18.
[4] Arbab AS, Janic B, Haller J, et al. In vivo cellular imaging for translational medical research. Curr Med Imaging Rev, 2009, 5(1):19-38.
[5] Hamley IW. Nanotechnology with soft materials. Angew Chem Int Ed Engl, 2003, 42(15):1692-1712.
[6] Gaihre B, Khil MS, Lee DR, et al. Gelatin-coated magnetic iron oxide nanoparticles as carrier system: drug loading and in vitro drug release study. Int J Pharm, 2009, 365(1-2):180-189.
[7] Pellegrino T, Manna L, Kudera S, et al. Hydrophobic nanocrystals coated with an amphiphilic polymer shell: a general route to water soluble nanocrystals. Nano Lett, 2004, 4(4):703-707.
[8] Wang Y, Wong JD, Teng X, et al. “Pulling” nanoparticles into water:phase transfer of oleic acid stabilized monodisperse nanoparticles into aqueous solutions of alpha-cyclodextrin. Nano Lett, 2003, 3(11):1555-1559.
[9] Euliss LE, Grancharov SG, SO'Brien S, et al. Cooperative assembly of magnetic nanoparticles and block copolypeptides in aqueous media.Nano Lett, 2003, 3(11):1489-1493.
[10] Park KC, Wang F, Morimoto S, et al. One-pot synthesis of iron oxide–carbon core–shell particles in supercritical water. Mater Res Bull, 2009, 44(7):1443-1450.
[11] Philipse AP, van Bruggen MP, Pathmamanoharan C. Magnetic silica dispersions preparation and stability of surface-modified silica particles with a magnetic core. Langmuir, 1994, 10(1):92-99.
[12] Bruce IJ, Sen T. Surface modification of magnetic nanoparticles with alkoxysilanes and their application in magnetic bioseparations.Langmuir, 2005, 21(15):7029-7035.
[13] Sen T, Sebastianelli A, Bruce IJ. Mesoporous silica-magnetite nanocomposite: fabrication and applications in magnetic bioseparations.J Am Chem Soc, 2006, 128(22):7130-7131.
[14] Deng Y, Deng C, Qi D, et al. Synthesis of core/shell colloidal magnetic zeolite microspheres for the immobilization of trypsin.Advanced Materials, 2009, 21(13):1377-1382.
[15] Mahmoudi M, Shokrgozar MA, Simchi A, et al. Multiphysics flow modeling and in vitro toxicity of iron oxide nanoparticles coated with poly (vinyl alcohol). J Physical Chem C, 2009, 113(6):2322-2331.
[16] Varanda LC, Jafelicci M, Tartaj P, et al. Structural and magnetic transformation of monodispersed iron oxide particles in a reducing atmosphere. J Appl Phys, 2002, 92(4):2079-2085.
[17] Moghimi SM, Hunter AC, Murray JC. Long-circulating and target-specific nanoparticles: theory to practice. Pharmacological Reviews, 2001, 53(2):283-318.
[18] Gupta AK, Gupta M. Synthesis and surface engineering of iron oxide nanoparticles for biomedical applications. Biomaterials, 2005, 26(18):3995-4021.
[19] Moghimi SM, Hunter AC, Murray JC. Long-circulating and target-specific nanoparticles: theory to practice. Pharmacol Rev, 2001,53(2):283-318.
[20] Lee H, Lee E, Kim do K, et al. Antibiofouling polymercoated superparamagnetic iron oxide nanoparticles as potential magnetic resonance contrast agents for in vivo cancer imaging. J Am Chem Soc,2006, 128(22):7383-7389.
[21] Osaka T, Nakanishi T, Shanmugam S, et al. Effect of surface charge of magnetite nanoparticles on their internalization into breast cancer and umbilical vein endothelial cells. Colloids Surf B Biointerfaces, 2009,71(2):325-330.
[22] Mahmoudi M, Simchi A, Milani AS, et al. Cell toxicity of superparamagnetic iron oxide nanoparticles. J Colloidd Interface Sci,2009, 336(2):510-518.
[23] Karlsson HL, Cronholm P, Gustafsson J, et al. Copper oxide nanoparticles are highly toxic: a comparison between metal oxide nanoparticles and carbon nanotubes. Chem Res Toxicol, 2008, 21(9):1726-1732.
[24] Mahmoudi M, Simchi A, Imani M. Cytotoxicity of uncoated and polyvinyl alcohol coated superparamagnetic iron oxide nanoparticles.J Phys Chem C, 2009, 113(22):9573-9580.
[25] Mahmoudi M, Simchi A, Imani M, et al. A new approach for the in vitro identification of the cytotoxicity of superparamagnetic iron oxide nanoparticles. Colloids Surf B Biointerfaces, 2010, 75(1):300-309.
[26] Nel AE, M?dler L, Velegol D, et al. Understanding biophysicochemical interactions at the nano-bio interface. Nat Mater,2009, 8(7):543-557.
[27] Cedervall T, Lynch I, Lindman S, et al. Understanding the nanoparticle protein corona using methods to quantify exchange rates and affinities of proteins for nanoparticles. Proc Natl Acad Sci U S A,2007, 104(7):2050-2055.
[28] Lynch I, Cedervall T, Lundqvist M, et al. The nanoparticle-protein complex as a biological entity; a complex fluids and surface science challenge for the 21st century. Adv Colloid Interface Scie, 2007,134-135:167-174.

