2株乙型腦炎病毒的E基因的克隆與序列分析*
黃小波,袁 磊,王偉杰,賈 靜,文心田,3,曹三杰
流行性乙型腦炎是由黃病毒科乙型腦炎病毒(Japanese encephalitis viruses.JEV)引起的蚊媒性人獸共患病,能夠引起人類嚴重的中樞神經系統病變[1]。乙型腦炎主要流行于亞洲及太平洋地區,有明顯季節性,一般蚊蟲孳生的7-9月是其發病高峰期。目前已有24個國家和地區有乙腦流行的報道,我國除新疆和青海省外,其他各省均有局部暴發或流行的報道[2]。四川省為全國乙腦高發地區,近年來發病率在2/10萬-10/10萬之間,疫情在全國排名靠前。四川省乙腦高發區主要分布在成都平原及川東地區,如巴中、達州、廣安、南充、遂寧以及內江等地[3]。1957年四川首次分離出基因Ⅲ型乙腦病毒(CH-13株),2002年湯德元等在四川內江地區分離得到1株基因Ⅲ型乙腦病毒[4],隨后在2004年,王環宇等從四川巴中地區采集的蚊蟲標本中首次分離得到6株基因Ⅰ型乙腦病毒[5]。
“5.12”地震后,降雨量的增多,導使蚊蟲的大量滋生,增加了乙腦傳染的幾率,再加上環境的劇烈變化可能會導致病毒的變異,因此做好乙腦的防控工作顯得尤為重要。本次研究對2009年分離自四川地區的2株JEV的E基因核酸序列、E基因推導氨基酸序列、E蛋白結構域突變情況與基因型進行分析研究,了解分離株的部分分子生物學特征,為四川地區流行性乙型腦炎病毒的分子生物學研究與DNA疫苗的研制提供重要依據。
1 材料與方法
1.1 病毒株 JEV-CZ1株與JEV-NJ1株分別為本實驗室從采集自四川崇州地區豬場庫蚊樣品與四川內江地區豬流產死胎腦組織中分離獲得,由本實驗室鑒定并保存。
1.2 菌種及主要試劑 大腸桿菌DH5α由本實驗室保存;PrimeScript RT reagent Kit反轉錄試劑盒、pMD19-T Simple Vector載體購自大連寶生物工程有限公司;TRNzol總RNA提取試劑盒、質粒小提試劑盒;Taq DNA聚合酶;DNA MarkerⅢ購自北京天根生化科技有限公司;瓊脂糖凝膠DNA回收試劑盒購自Bio Basic公司。
1.3 標本來源與病毒分離 2009年7月28日在四川省崇州市的3個豬場采集的蚊蟲標本,按體態特征分類為庫蚊、按蚊和伊蚊,每類蚊蟲按100只/管分裝于凍存管,浸入液氮中保存。同年8月5日在四川內江市的1個豬場采集的流產死胎腦脊液與腦組織,裝袋后用錫箔紙包裹,浸入液氮中保存。將采集的樣品研磨稀釋過濾后接種于金黃色地鼠腎細胞(BHK-21細胞)進行傳代培養,獲得2株乙型腦炎病毒,分別命名為JEV-CZ1株與JEV-NJ1株。
1.4 病毒E基因的RT-PCR擴增
1.4.1 引物的設計與合成 參考GenBank收錄的SA14-14-2、SA14、SC04-12等10株乙型腦炎病毒的E基因序列,利用DNAMAN軟件對這10株毒株的E基因進行相似性分析,以SA14-14-2為參照確定其基因組252-2509區段為擴增靶序列。利用Primer 5軟件合成了一對引物,下劃線為酶切位點:上 游:5’-CCGCTCGAGTTCTTCAAGTTTACAGCATTAGC-3’; 下 游: 5’-CCGGAATTCTTTCTTGTGATGTCAATGGCA-3’。引物由上海英駿生物技術有限公司合成,預計擴增片段為2258bp。
1.4.2 病毒RNA的提取 采用TRNzol總RNA提取試劑盒,按照試劑盒說明書操作提取分離株病毒液的總RNA,于-70℃保存。
1.4.3 病毒cDNA的合成 用PrimeScript RT reagent Kit反轉錄試劑盒,按照試劑盒說明書操作,采用10μL體系,將病毒液總RNA反轉錄成cDNA。
1.4.4 E基因的擴增 以上述cDNA為模板,采用25μL PCR反應體系:ddH2O 13μL,10×PCR Buffer 2.5μL,MgCl2(25mmol/L)2μL,dNTPs(2.5mmol/L)3μL,上游與下游引物(10pmol/L)各1μL,cDNA 模板2μL,Taq DNA 聚合酶(2.5 U/μL)0.5μL。反應條件:94 ℃預變性5min;94℃30s,55℃30s,72℃2min(30個循環);72℃補充延伸10min。取5μL PCR產物進行1%瓊脂糖凝膠電泳檢測,電泳條件:80V,20min。
1.5 病毒E基因的克隆及測序 電泳檢測出現預計條帶后,用瓊脂糖凝膠DNA回收試劑盒回收E基因,將回收產物與pMD19-T Simple Vector載體連接,再將連接產物傳化入感受態大腸桿菌細胞DH5α。利用PMD19-T載體的氨芐青霉素抗性篩選出陽性菌落,擴大培養后作菌液PCR鑒定,小提質粒,用XhoⅠ與EcoRⅠ進行雙酶切鑒定后送上海英駿生物技術有限公司測序。
1.6 病毒E基因的序列分析
1.6.1 E基因核苷酸序列同源性分析 運用DNAMAN軟件將JEV-CZ1株與JEV-NJ1株的E基因核酸序列與GenBank收錄的JEV參考毒株的相應序列進行同源性比對。
1.6.2 E基因推導氨基酸序列分析 運用DNAMAN軟件推導出分離株E基因編碼的氨基酸序列并與GenBank收錄的JEV參考毒株的相應序列進行同源性分析。并對分離株E蛋白活性區(E1-E411位)3個結構域的氨基酸差異情況進行了統計分析。
1.6.3 系統發育進化樹的構建 采用乙腦病毒E基因分型方法,選擇乙腦病毒E基因(基因組977-2476區段),從GenBank中選取各個國家和地區包括各個基因型的34株參考毒株,另選1株墨累谷腦炎病毒(MVE)作為外群,用ClustalX軟件進行堿基配對,種系分析運用MEGA4.1軟件的Neighbor(鄰系接合法)構建系統發育進化樹,以確定分離株的基因型別。
2 結 果
2.1 RT-PCR擴增結果 利用RT-PCR方法擴增出病毒E基因,經瓊脂糖凝膠電泳后,與DNA MarkerⅢ比較,大小在2 000bp和3 000bp之間,與預期片段大小相符。
2.2 E基因的克隆與鑒定結果 將分離株E基因重組質粒用XhoⅠ和EcoRⅠ進行雙酶切,分別得到大小約為2 200bp與2 700bp 2條片段,與目的基因和載體片段大小相符,證明對分離株E基因的克隆成功。
2.3 E基因的同源性分析結果 將JEV-CZ1株與JEV-NJ1株的E基因核酸序列同GenBank上發表的JEV參考毒株的相應序列進行同源性比對,結果表明:JEV-CZ1株核酸序列與SA14-14-2(減毒活疫苗株)、SA-14(中國山西)、SC04-12(中國四川)、SC04-16(中國四川)、HN04-11(中國河南)、HN04-40(中國河南)、VN22(越南)株相應序列的同源性分別為87.6%,87.7%,98.5%,98.9%,98.4%,97.9%,98.9%,JEV-NJ1株核酸序列與上述7株病毒相應序列的同源性分別為99.6%,99.7%,91.1%,91.2%,91.0%,90.8%,91.1%(表1)。
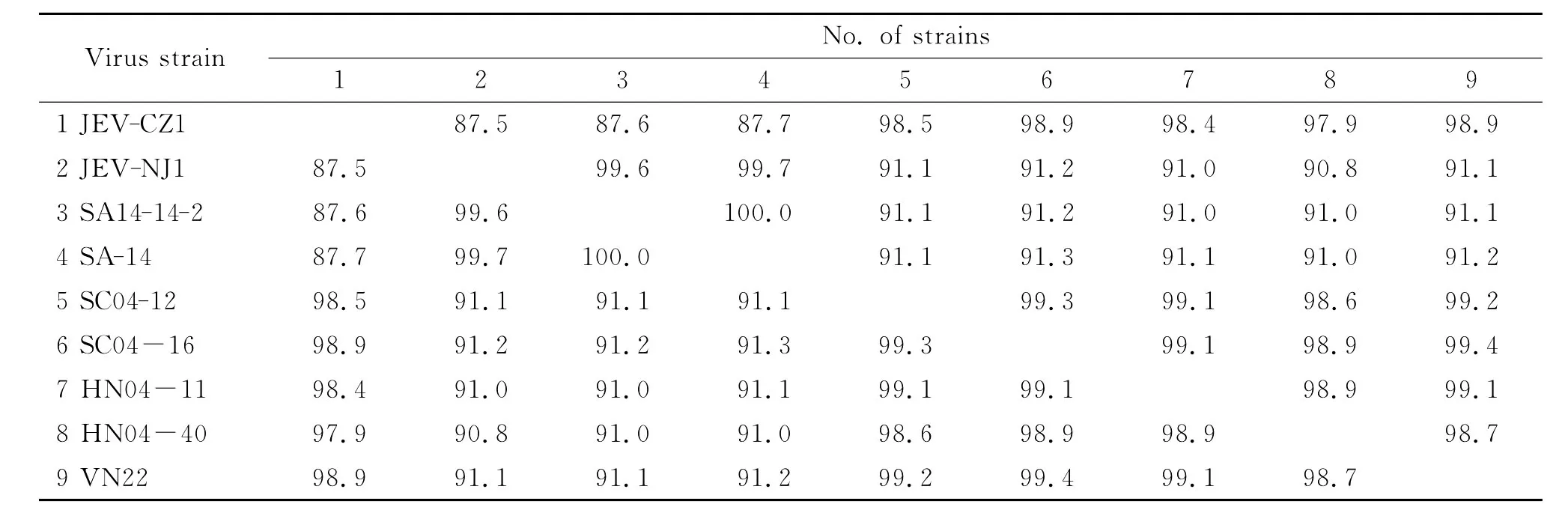
表1 不同毒株E基因核酸同源性比對結果Tab.1 Homology comparison of E gene nucleotide sequences among different strains
2.4 E基因推導氨基酸序列分析結果
2.4.1 氨基酸序列同源性分析結果 JEV-CZ1株E基 因 推 導 的 氨 基 酸 序 列 與 SA14-14-2、SA-14、SC04-12、SC04-16、HN04-11、HN04-40、VN22株相應序列的同源性分別為97.2%,97.3%,99.2%,99.2%,99.1%,98.1%,99.2%。JEV-NJ1株 E基因推導的氨基酸序列與上述7株病毒相應序列的同源 性 分 別 為 99.2%,99.4%,97.5%,97.5%,97.3%,96.4%,97.5%(表2)。
2.4.2 E蛋白活性區氨基酸差異分析 JEV-CZ1株與疫苗株SA14-14-2株在E蛋白3個結構域中(DomainⅠ、Ⅱ、Ⅲ)有15個氨基酸的差異;JEVNJ1株有3處差異(表3)。
2.5 系統發育進化樹構建結果 乙型腦炎病毒E基因分型結果顯示,所有乙腦病毒分布于5個拓撲結構群,本次研究的JEV-CZ1株屬于基因Ⅰ型,并與2004年分離自四川的毒株與越南分離的毒株遺傳關系較近,JEV-NJ1屬于基因Ⅲ型,與疫苗株SA14-14-2株以及以往四川與上海分離的毒株遺傳關系較近(圖1)。
3 討 論
E蛋白是病毒的包膜蛋白,為主要蛋白,有病毒的抗原決定簇。其分子量為53kD,由500個氨基酸殘基組成。由E蛋白形成的表面抗原決定簇具有血凝活性和中和活性,能和血凝抑制抗體結合,刺激機體產生中和抗體,保護機體免受病毒攻擊,與誘導宿主機體的免疫應答密切相關[6]。JEV-CZ1株與疫苗株SA14-14-2的E基因核酸序列同源性為87.6%,氨基酸序列同源性為97.2%,核酸同源性較低,但該區段的核酸差異一般發生于氨基酸密碼子的第3位,即突變的位點多以沉默突變的形式存在;而JEV-NJ1株與疫苗株核酸與氨基酸同源性為均在99%以上。SA14-14-2株與JEV-CZ1株屬于不同基因型,因此關于SA14-14-2株減毒疫苗對Ⅰ型乙腦病毒的保護力如何應進一步研究。
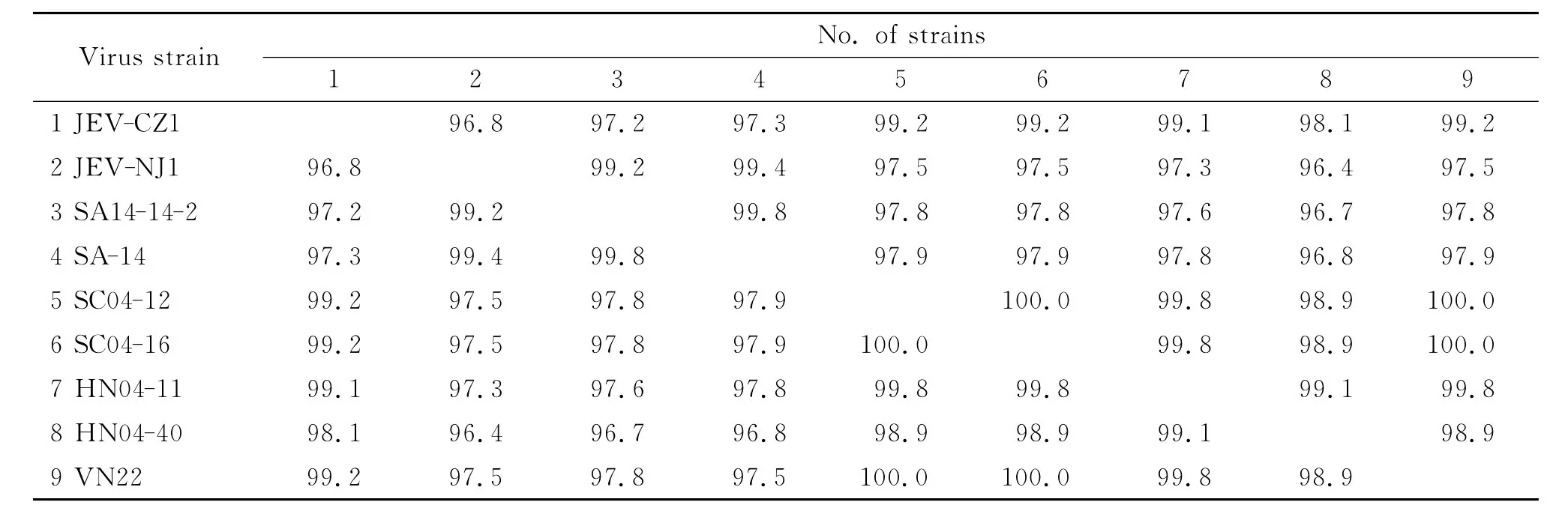
表2 不同毒株E基因推導氨基酸序列同源性比對結果Tab.2 Homology comparison of E protein amino acid sequences among different strains
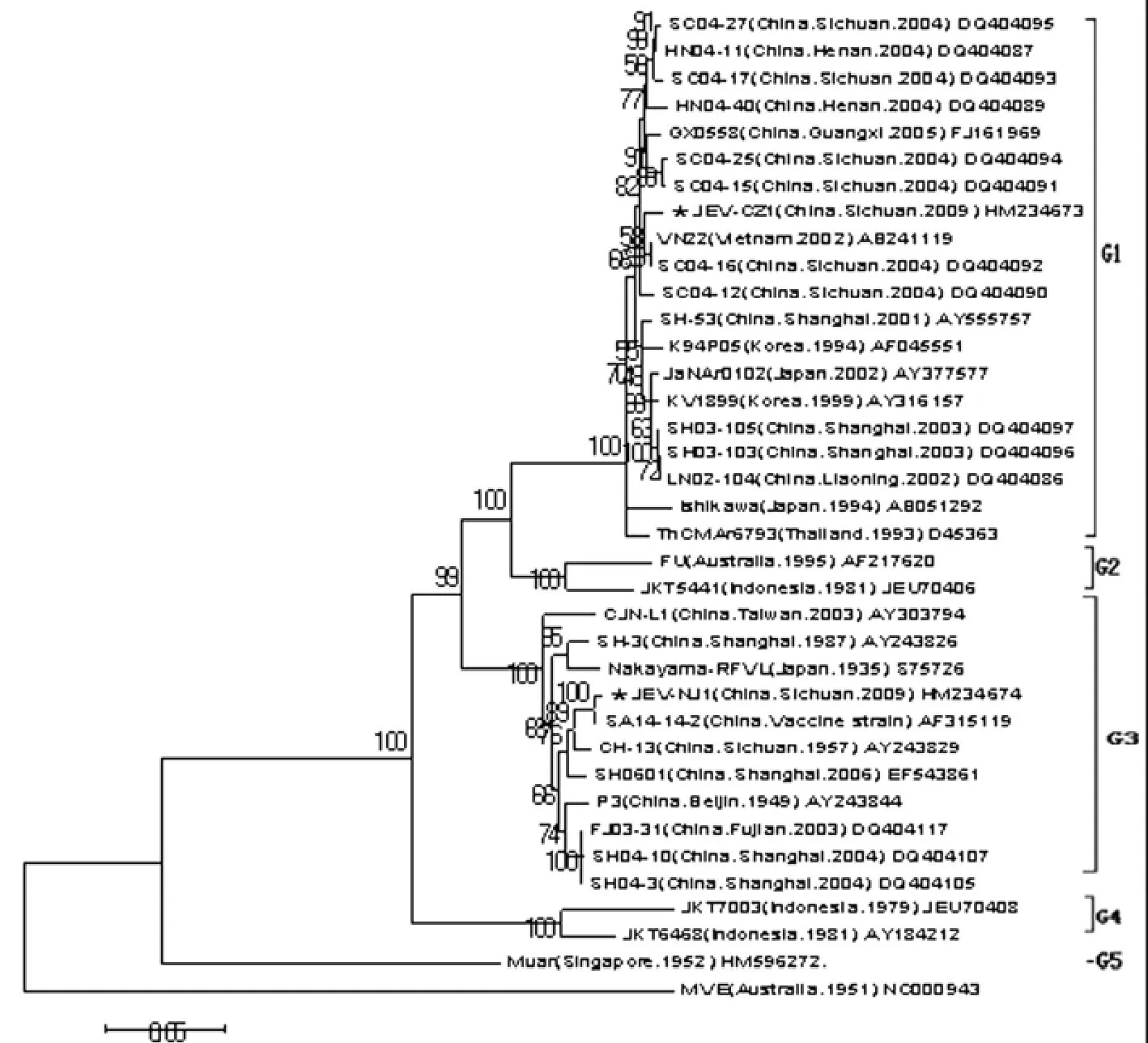
圖1 E基因序列系統發育進化樹Fig.1 Phylogenetic tree analysis on E gene nucleotide sequence
通過對E蛋白結構域的分析,發現JEV-CZ1株與疫苗株SA14-14-2在3個結構域中有15個氨基酸差異;而JEV-NJ1株只有3處差異;有學者的研究表明E304和E335兩個Cys所形成的二硫鍵是抗原抗體結合的必要結構[7],該兩分離株在這兩個位點的Cys都沒有發生變異。研究表明E60~E68的氨基酸序列 Cys-Tyr-His-Ala-Ser-Val-Thr-Asp-Thr對病毒引起細胞免疫至關重要[8],JEV-CZ1株在E67位的Asp被替換成Glu,而JEV-NJ1株在這一區段非常保守。有學者在對乙腦減毒機理進行研究時認為E138位的Glu替換為Lys后毒力會有較明顯降低[9]。本次研究發現JEV-NJ1株與疫苗株SA14-14-2的E138位氨基酸均為Lys,而JEV-CZ1株則為Glu。有學者研究證明針對結構域Ⅲ的抗體在對JEV中和反應中起著重要作用,尤其是在E337-345、E377-382、E397-403 3個區域內發生變異會導致抗原性的改變,甚至影響抗原與中和抗體的結合反應[10],本次研究通過序列分析,發現新分離的兩株JEV與疫苗株在這3個區域上完全一致。

表3 E蛋白活性區不同結構域的氨基酸差異Tab.3 Amino acid substitutions in different domains of E protein
1992年 WR Chen等[11]首先依據乙腦病毒PrM/C基因區段(456~695)的核酸序列將乙腦病毒劃分為4個基因型。英國Solomon等研究認為乙腦病毒可能起源于印尼-馬來群島,該地區包括乙腦病毒所有基因型[12],乙腦病毒在向其他地區傳播過程中受多因素協同作用,有較強的地域性。我國自1949年在北京首次分離到乙腦病毒,此后在其它中國地區也相繼分離到毒株,累計已有60余年歷史,Wang[13]等對中國自1949-2005年以來分離的乙腦毒株的研究顯示中國分離的乙腦病毒以基因Ⅲ型為主,偶有基因Ⅰ型。2001年在上海我國首次分離得到基因Ⅰ型乙腦病毒,隨后在遼寧、廣西、甘肅、河南和四川等省份也分離得到了基因Ⅰ型乙腦病毒[14-15]。本次研究為了避免用較短的核苷酸序列進行分析可能導致的結果不準確,而采用E基因(1 500bp)進行分型,結果顯示2009年從四川崇州市與內江市的豬場蚊子與流產死胎腦組織中分離到的JEV-CZ1株和JEV-NJ1株分別屬于基因Ⅰ型和基因Ⅲ型。研究還發現JEV-CZ1株與2004年分離自 四 川 的 毒 株 SC04-16、SC04-12 和 越 南 分 離 株VN22遺傳關系較近,JEV-NJ1株與疫苗株SA14-14-2以及以往四川與上海分離的毒株遺傳關系較近,基本符合乙腦病毒具有較強地域性的特征。本次研究結果對深入研究四川乙腦病毒的分子生物學特征、DNA疫苗的研制以及建立乙型腦炎基因數據庫具有重要意義。
[1]殷震,劉景華.動物病毒學[M].北京:科學出版社,1997:1226.
[2]Solomon T.Recent advances in Japanese encephalitis[J].Journal of Neurovirology,2003,9(2):274-283.
[3]張佳珂,林世華,陳丹林,等.2006-2007年四川省流行性乙型腦炎臨床病例血清學分析[J].預防醫學情報雜志,2008,24(12):978-980.
[4]湯德元,郭萬柱,徐志文,等.乙型腦炎病毒的分離與鑒定[J].四川農業大學學報.2004,22(1):70-74.
[5]王環宇,張佳珂,付士紅,等.四川省分離的基因1型乙型腦炎病毒分子特征分析[J].中華微生物學和免疫學雜志,2009,29(9):816-821.
[6]王祥,陳煥春.JEV分子生物學與新型疫苗研究進展[J].動物醫學進展雜志,2008,22(3):5-9.
[7]Mason PW,Dalrymple JM,Gentry MK,et al.Molecular characterization of a neutralizing domain of the Japanese encephalitis virus structural glycoprotein[J].J Gen Virol,1989,70(8):2037-2049.
[8]Takada K,Masaki H,Konishi E,et al.Definition of an epitope on Japanese encephalitis virus(JEV)envelope protein recognized by JEV-specific murine CD+8cytotoxic T lymphocytes[J].Arch Virol,2000,145(3):523-534.
[9]Ni H,Chang GJ,Xie H,et al.Molecular basis of attenuation of neurovirulence of wild-type Japanese encephalitis virus strain SA14[J].J Gen Virol,1995,76(2):409-413.
[10]Wu SC,Lin CW.Neutralizing peptide ligands selected from phage-displayed libraries mimic the conformational epitope on domain III of the Japanese encephalitis virus envelope protein[J].Virus Res,2001,76(1):59-69.
[11]Chen WR,Rico-Hesse R,Tesh RB.A new genotype of Japanese encephalitis virus from Indonesia[J].Am J Trop Med Hyg,1992,47(1):61-69.
[12]Solomon TH,Beasley DC,Ekkelenkamp M.Origin and evolution of Japanese encephalitis virus in Southeast Asia[J].J Virol,2003,77(5):3091-3098.
[13]Wang HY,Takasaki T,Fu SH,et al.Molecular epidemiological analysis of Japanese encephalitis virus in China[J].J Gen Virol,2007,88(3):885-894.
[14]王環宇,付士紅,李曉宇,等.中國首次分離到基因Ⅰ型乙型腦炎病毒[J].中華微生物學和免疫學雜志,2004,24(11):843-849.
[15]王俊文,付士紅,王環宇,等.遼寧省乙腦病毒的分離與鑒定[J].中華實驗和臨床病毒學雜志,2006,20(1):61-65.

