環(huán)氧化酶2在鋁負(fù)荷致大鼠海馬神經(jīng)元損傷中的作用*
吳 柯, 萬立華, 謝靈瑤, 楊俊卿△
(1重慶醫(yī)科大學(xué)藥學(xué)院,重慶市生物化學(xué)與分子藥理學(xué)重點(diǎn)實(shí)驗室,2重慶醫(yī)科大學(xué)基礎(chǔ)醫(yī)學(xué)院法醫(yī)學(xué)教研室,重慶400016)
有研究證明鋁鹽負(fù)荷是成熟的神經(jīng)元損傷模型之一[1-2],另一方面,環(huán)氧化酶 2(cyclooxygenase 2,COX -2)的表達(dá)增加與包括外傷性腦損傷[3]、腦缺血[4]、阿爾茨海默病(Alzheimer disease)[5]等神經(jīng)病理密切相關(guān)。正如大家所熟知,神經(jīng)元的損傷和慢性炎癥會導(dǎo)致神經(jīng)回路甚至中樞神經(jīng)系統(tǒng)的功能失調(diào),那么在炎癥或損傷過程中扮演著關(guān)鍵角色的COX-2在海馬、皮層神經(jīng)元呈現(xiàn)的高表達(dá)[6]對于神經(jīng)元有明顯的致?lián)p傷何作用,具體機(jī)制仍待探討。本實(shí)驗以RNA干擾為手段,以鋁負(fù)荷致大鼠海馬神經(jīng)元損傷為模型,初步探討了COX-2表達(dá)與神經(jīng)元損傷的關(guān)系。
材料和方法
1 動物、細(xì)胞株和主要試劑
新生24 h內(nèi)SD大鼠,重慶醫(yī)科大學(xué)實(shí)驗動物中心提供,動物許可證號為SCXK(渝)2007001;293細(xì)胞株和COX-2特異性干擾重組腺病毒由重慶醫(yī)科大學(xué)檢驗系提供;六水三氯化鋁購于國藥化工試劑有限公司;B27購于Gibco;左旋多聚賴氨酸和MTT購于Sigma;乳酸脫氫酶(lactate dehydrogenase,LDH)試劑盒、超氧化物歧化酶(superoxide dismutase,SOD)試劑盒和丙二醛(malondialdehyde,MDA)試劑盒購于南京建成生物工程研究所;ECL化學(xué)發(fā)光試劑盒購于Pierce;COX-2Ⅰ抗購于Santa Cruz。
2 方法
2.1 大鼠海馬神經(jīng)元原代培養(yǎng) 參照Choi等[7]方法,出生24 h內(nèi)SD乳鼠,用75%乙醇消毒后,斷頭。超凈臺分離海馬,盡量剔除結(jié)締組織和血管,并將組織盡量剪碎,加組織體積5倍的0.125%胰酶消化。250目尼龍網(wǎng)過濾,得到的細(xì)胞懸液,800 r/min離心8 min。2次離心后,臺盼藍(lán)法對細(xì)胞懸液進(jìn)行活細(xì)胞記數(shù)。計算細(xì)胞存活率(>95%)并將細(xì)胞密度調(diào)整為1×106cells/L的細(xì)胞懸液,種植于賴氨酸處理的24孔板或96孔板中,37℃、5%CO2培養(yǎng)箱中培養(yǎng)。觀測24 h神經(jīng)元貼壁后,換B27無血清維持培養(yǎng)液進(jìn)行培養(yǎng),每2 d半量換液1次。
2.2 293細(xì)胞培養(yǎng),腺病毒的擴(kuò)增及滴度的測定 于100 mL培養(yǎng)瓶中種植狀態(tài)良好的293細(xì)胞,生長至80%融合即用于擴(kuò)增腺病毒。將1.5 mL腺病毒原液加入到4 mL 10%DEME完全培養(yǎng)液中充分混勻,再加入到PBS洗過的80%融合的293細(xì)胞中,37℃、5%CO2培養(yǎng)箱繼續(xù)培養(yǎng)。熒光觀察病毒感染率及倒置顯微鏡觀察細(xì)胞病變效應(yīng)(cytopathic effect,CPE)到明顯熒光且細(xì)胞出現(xiàn)明顯的CPE時即到達(dá)收病毒時間。3 000 r/min離心,0.5 mL培養(yǎng)液吹散細(xì)胞沉淀,37℃至-80℃反復(fù)凍融4次,8 000 r/min低溫離心15 min,收集上清液即為擴(kuò)增好的腺病毒。參照江千里等[8]的方法,進(jìn)行病毒滴度的測定。病毒滴度(U/L)=103U×計數(shù)孔相對于第1孔的稀釋倍數(shù)/第1孔加入病毒的體積,即1×10(n+4)U/L,n=計數(shù)孔。
2.3 實(shí)驗分組 正常大鼠神經(jīng)元培養(yǎng)至第7 d,分成空載腺病毒組、COX-2特異性干擾腺病毒組、鋁+空載腺病毒組、鋁+COX-2特異性干擾腺病毒組。空載組加入感染復(fù)數(shù)(multiplicity of infection,MOI)為100的空載病毒量,COX-2特異性干擾腺病毒組加入MOI為100的COX-2特異性干擾病毒量;鋁+空載腺病毒組全量換液成200 μmol·L-1AlCl3培養(yǎng)液,同時加入MOI為100的空載病毒量,鋁+COX-2特異性干擾腺病毒組全量換液成200 μmol·L-1AlCl3培養(yǎng)液,同時加入MOI為100的COX-2特異性干擾病毒量。作用24 h后進(jìn)行MTT、生化檢測、熒光細(xì)胞觀察和蛋白提取。
2.4 Western blotting檢測海馬神經(jīng)元COX-2蛋白表達(dá)收集經(jīng)干預(yù)處理24 h后的細(xì)胞,裂解20 min。用Bradford法測定裂解液中總蛋白含量。取細(xì)胞裂解液上樣于SDSPAGE聚丙烯酰胺凝膠,每孔50 μg蛋白電泳。電轉(zhuǎn)移將蛋白轉(zhuǎn)至硝酸纖維素膜上。加入封閉液過夜,抗靶蛋白抗體溶液與濾膜一同室溫孵育2~3 h,洗膜,加入Ⅱ抗工作液室溫孵育1 h,洗膜,檢測靶蛋白的表達(dá)。
2.5 SOD活性和MDA含量測定 大鼠海馬神經(jīng)元在24孔板中培養(yǎng)至7 d,胰酶消化后,低溫超聲破碎細(xì)胞,收集上清液0.2 mL,按照SOD和MDA試劑盒說明書,分別在550 nm和532 nm處測各管吸光度(absorbance,A)。蛋白定量采用考馬斯亮藍(lán)法。
SOD活性[103U·(g protein)-1]=(對照管A值-測定管A值)/對照管A值/50% ×反應(yīng)液總體積/取樣量(mL)/蛋白含量(g·L-1)。MDA[μmol·(g protein)-1]=(測定管A值-測定空白管A值)/(標(biāo)準(zhǔn)管A值-標(biāo)準(zhǔn)空白管A值)×10 μmol·L-1÷蛋白濃度(g·L-1)。
2.6 LDH測定 收集各組培養(yǎng)液上清0.06 mL(設(shè)為A溶液)。胰酶消化各組細(xì)胞,超聲波破碎細(xì)胞,低溫離心收集上清液0.06 mL(設(shè)為B溶液)。參照LDH測定試劑盒說明書,于440 nm處測各管A值。蛋白定量采用考馬斯亮藍(lán)法。
LDH活性[U·(g protein)-1]=測定管A值-測定空白管A值/標(biāo)準(zhǔn)管A值-標(biāo)準(zhǔn)空白管A值×2 mmol·L-1÷蛋白濃度(g·L-1),LDH漏出率=A/(A+B)×100%。
2.7 MTT測定 大鼠海馬神經(jīng)元接種于96孔板,分組及干預(yù)同“2.3”方法,24 h后,每孔加入 5 g·L-1MTT溶液 20 μL。繼續(xù)培養(yǎng)4 h,除上清,加150 μL DMSO(二甲基亞砜)振蕩以溶解結(jié)晶。于570 nm波長處讀取A值。
2.8 神經(jīng)元病理形態(tài)學(xué)熒光觀察 腺病毒轉(zhuǎn)染原代神經(jīng)元24 h后,熒光倒置顯微鏡觀察細(xì)胞形態(tài)。
3 統(tǒng)計學(xué)處理
結(jié) 果
1 腺病毒滴度
測得COX-2特異性干擾腺病毒滴度=1012U/L,RFP空載腺病毒滴度=1012U/L,然后根據(jù)下列公式計算轉(zhuǎn)染神經(jīng)元需要加入的病毒量:
MOI=病毒滴度×V(需加入的病毒液體積)/神經(jīng)元細(xì)胞數(shù),即當(dāng) MOI=100 時,V=100 μL。
2 COX-2特異性干擾對海馬神經(jīng)元COX-2蛋白表達(dá)的影響
Western blotting結(jié)果顯示,單純RNAi組的COX-2蛋白水平明顯低于空載組。鋁+空載腺病毒組COX-2蛋白水平明顯增加,而RNAi+鋁鹽組COX-2蛋白水平明顯下降,見圖1。
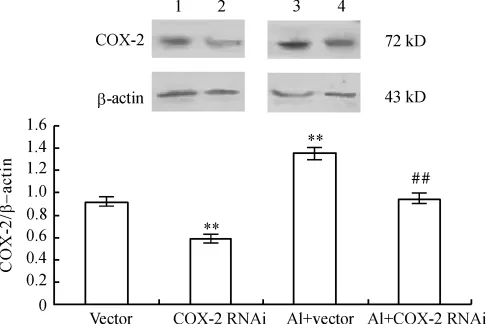
Figure 1.Changes of COX-2 protein expression in primary cultured rat hippocampal neurons.1:vector - treated group;2:COX-2 RNAi-treated group;3:vector and aluminum-treated(Al+vector)group;4:COX-2 RNAi and aluminum-treated(Al+COX-2 RNAi)group.±s.n=3.**P<0.01 vs vector group;##P <0.01 vs Al+vector group.圖1 COX-2 RNA干擾對海馬神經(jīng)元COX-2蛋白表達(dá)的影響
3 COX-2干擾對海馬神經(jīng)元SOD活性、MDA含量、LDH漏出率及神經(jīng)元活性的影響
與空載組相比,單純RNAi組SOD活性無顯著改變,而鋁+空載腺病毒組SOD活性顯著降低,COX-2 RNAi+鋁鹽組的SOD活性顯著升高,見表1。
與空載組相比,單純RNAi組MDA含量無顯著改變,而鋁+空載腺病毒組MDA含量顯著增加,COX-2 RNAi+鋁鹽組的MDA含量明顯下降,見表1。
與空載組相比,單純RNAi組LDH漏出率無顯著差異,而鋁+空載腺病毒組LDH漏出率明顯增加;與鋁+空載腺病毒組相比,RNAi組LDH漏出率明顯降低,見表1。
正常神經(jīng)元RNAi組與空載組相比,MTT測定的吸光度值無顯著差異;鋁+空載腺病毒組MTT值明顯降低,COX-2 RNAi+鋁鹽組MTT值明顯上升,見表1。
4 COX-2干擾對海馬神經(jīng)元病理形態(tài)學(xué)的影響
轉(zhuǎn)染空載腺病毒的海馬神經(jīng)元結(jié)構(gòu)清楚完整,胞體飽滿且胞核清晰,突觸較長,并且相互連結(jié)形成網(wǎng)狀結(jié)構(gòu),細(xì)胞數(shù)目較多。轉(zhuǎn)染COX-2 RNA干擾片段進(jìn)入正常的海馬神經(jīng)元中,細(xì)胞結(jié)構(gòu)依舊完整,細(xì)胞數(shù)量多,提示單純 COX-2 RNA干擾對神經(jīng)元無明顯損傷作用。
表1COX-2干擾對海馬神經(jīng)元SOD活性、MDA含量、LDH漏出率和MTT的影響Table 1.Changes of SOD,MDA,LDH and MTT in primary cultured rat hippocampal neuron(±s.n=6)

表1COX-2干擾對海馬神經(jīng)元SOD活性、MDA含量、LDH漏出率和MTT的影響Table 1.Changes of SOD,MDA,LDH and MTT in primary cultured rat hippocampal neuron(±s.n=6)
*P <0.05,**P <0.01 vs vector-treated group;#P <0.05,##P <0.01 vs vector and aluminium -treated group.
value Vector- treated 83.83 ±6.00 2.20 ±0.45 18.03 ±Group SOD[103U·(g protein)-1]MDA[μmol·(g proein)-1]LDH(%) A 3.81 0.779 ±0.080 COX -2 RNAi 84.08 ±4.50 2.85 ±0.34 20.20 ±2.43 0.768 ±0.100 Vector and aluminium -treated 46.38 ±4.04** 4.20 ±0.590** 39.68 ±4.82 ** 0.508 ±0.060*COX -2 RNAi and aluminium - treated 70.50 ±2.65## 3.27 ±0.27# 23.38 ±3.50## 0.600 ±0.060#
鋁+空載腺病毒組海馬神經(jīng)元數(shù)量減少,且突起萎縮明顯,并伴有部分死細(xì)胞。而轉(zhuǎn)染了COX-2RNA干擾片段后,神經(jīng)元突起較為明顯,且能相互連接成網(wǎng),細(xì)胞結(jié)構(gòu)也較為清楚,死細(xì)胞較少,見圖2。

Figure 2.Effects of COX -2 RNAi on pathomorphology in primary cultured rat hippocampal neurons(×200).A:vector group;B:COX-2 RNAi group;C:Al+vector group;D:Al+COX-2 RNAi group.圖2 COX-2 RNA干擾對海馬神經(jīng)元病理形態(tài)學(xué)的影響
討 論
目前,鋁元素公認(rèn)可在大腦誘導(dǎo)氧化應(yīng)激,產(chǎn)生大量自由基,從而誘發(fā)神經(jīng)退行性疾病的發(fā)生和發(fā)展。許多學(xué)者采用鋁鹽進(jìn)行造模,病理學(xué)檢查發(fā)現(xiàn)鋁鹽會導(dǎo)致神經(jīng)元損傷和退變,并發(fā)現(xiàn)動物出現(xiàn)了學(xué)習(xí)記憶功能障礙,神經(jīng)元細(xì)胞凋亡,DNA損傷等表現(xiàn)[9-12]。大量研究成果也表明COX-2的表達(dá)與腦損傷、神經(jīng)元退變密切相關(guān)。AD患者腦內(nèi)Aβ淀粉樣物質(zhì)水平與COX-2表達(dá)的增加具有一致性,臨床上發(fā)現(xiàn)AD患者神經(jīng)纖維纏結(jié)的神經(jīng)元亦是COX-2表達(dá)增加的部位,提示COX-2的過表達(dá)可能是造成神經(jīng)元死亡的原因之一[13-14]。進(jìn)一步研究還提示 COX-2高表達(dá)是誘導(dǎo)Aβ淀粉樣物質(zhì)增加的因素之一[15],在經(jīng)典的鋁鹽過負(fù)荷導(dǎo)致神經(jīng)元損傷、退變的模型下,探究COX-2起著怎樣的作用及其之間可能的內(nèi)在聯(lián)系必然會為治療神經(jīng)損傷和退行性變疾病開拓新的思路,并為開發(fā)新的藥物提供可能的理論依據(jù)。
本研究發(fā)現(xiàn),與空載腺病毒組相比,單純COX-2 RNAi腺病毒轉(zhuǎn)染神經(jīng)元其各項生化酶學(xué)指標(biāo)無明顯的變化,神經(jīng)元數(shù)目正常,細(xì)胞形成網(wǎng)狀結(jié)構(gòu),且胞體飽滿,胞核清晰。而Western blotting檢測結(jié)果顯示,其COX-2蛋白表達(dá)明顯下降(P<0.01),一方面提示COX-2 RNAi腺病毒的轉(zhuǎn)染神經(jīng)元是成功的;另一方面,提示RNAi使海馬神經(jīng)元COX-2的表達(dá)適度沉默,并不明顯影響海馬神經(jīng)元形態(tài)和生理功能。我們還發(fā)現(xiàn),COX-2 RNAi能明顯提高鋁鹽負(fù)荷海馬神經(jīng)元細(xì)胞存活力和 SOD活性(P<0.05或 P<0.01),降低細(xì)胞LDH漏出率和MDA含量(P<0.05或P<0.01),從而減輕了細(xì)胞損傷,并一定程度改善鋁負(fù)荷神經(jīng)元病理形態(tài)學(xué)改變。結(jié)果表明,COX-2在神經(jīng)組織中過表達(dá)可能損傷神經(jīng)元,COX-2 RNA干擾對神經(jīng)元損傷有明顯的保護(hù)作用。
[1]Meglio L,Oteiza PI.Aluminum enhances melanin - induced lipid peroxidation[J].Neurochem Res,1999,24(8):1001-1008.
[2]Matyja E.Aluminum enhances glutamate-mediated neurotoxicity in organotypic cultures of rat hippocampus[J].Folia Neuropathol,2000,38(2):47 -53.
[3]Dash PK,Mach SA,Moore AN.Regional expression and role of cyclooxygenase-2 following experimental traumatic brain injury[J].J Neurotrauma,2000,17(1):69 -81.
[4]Mancuso A,Derugin N,Hara K,et al.Cyclooxygenase-2 mRNA expression is associated with c-fos mRNA expression and transient water ADC reduction detected with diffusion MRI during acute focal ischemia in rats[J].Brain Res,2003 ,961(1):121 -130.
[5]Pasinetti GM,Aisen PS.Cyclooxygenase-2 expression is increased in frontal cortex of Alzheimer's disease brain[J].Neuroscience,1998,87(2):319 -324.
[6]Wu T,Wu H,Wang J,et al.Expression and cellular localization of cyclooxygenases and prostaglandin E synthases in the hemorrhagic brain [J].J Neuroinflammation,2011,8(3):22 -30.
[7]Kolh JY,Choi DW.Quantitive determination of glutame mediated cortical neuronal injury in cell culture by lactate dehydrogenase efflux assay [J].J Neurosci Methods,1987,20(1):83-90.
[8]江千里,王健民,溫麗敏,等.批量快速測定法測定標(biāo)志基因為GFP的重組病毒滴度[J].第二軍醫(yī)大學(xué)學(xué)報,2002,23(9):4301-5301.
[9]Mohamd EM,Ahmed HH,Estefan SF,et al.Windows into estradiol effects in Alzheimer's disease therapy [J].Eur Rev Med Pharmacol Sci,2011,15(10):1131 -1140.
[10]ǒguz EO,Enli Y,?ahin B,et al.Aluminium sulphate exposure increases oxidative stress and suppresses brain development in Ross broiler chicks[J].Med Sci Monit,2012,18(3):BR103 - BR108.
[11]傅洪軍,董勝璋,林忠寧,等.JNK阻斷劑CEP211004對鋁誘導(dǎo)的大鼠皮層神經(jīng)元凋亡的保護(hù)作用[J].中國藥理學(xué)與毒理學(xué)雜志,2003,17(2):106–110.
[12]Cuello AC,F(xiàn)erretti MT,Leon WC,et al.Early - stage inflammation and experimental therapy in transgenic models of the Alzheimer- like amyloid pathology[J].Neurodegener Dis,2010,7(1 -3):96 -98.
[13]Huong NQ,Nakamura Y,Kuramoto N,et al.Indomethacin ameliorates trimethyltin-induced neuronal damage in vivo by attenuating oxidative stress in the dentate gyrus of mice[J].Biol Pharm Bull,2011,34(12):1856 -1863.
[14]Li SY,Yang D,F(xiàn)u ZJ,et al.Lutein enhances survival and reduces neuronal damage in a mouse model of ischemic stroke[J].Neurobiol Dis,2012,45(1):624 -632.
[15]Ofengeim D,Shi P,Miao B,et al.Identification of small molecule inhibitors of neurite loss induced by Aβ peptide using high content screening[J].J Biol Chem,2012,287(12):8714-8723.
- 中國病理生理雜志的其它文章
- 鈣敏感受體通過PI3K 信號通路介導(dǎo)缺氧誘導(dǎo)的大鼠肺動脈平滑肌細(xì)胞增殖*
- 靶向沉默ADAM10 基因?qū)π募〖?xì)胞N-cadherin 加工的影響*
- MicroRNA-450a-3p 通過抑制Bub1 基因的表達(dá)調(diào)控小鼠細(xì)胞增殖和胚胎發(fā)育*
- 鎂對哮喘患者外周血CD4 + CD25 + 調(diào)節(jié)性T 細(xì)胞凋亡及Foxp3 表達(dá)的影響*
- 左歸丸含藥血清通過ERK/TGF-β/Smads信號級聯(lián)調(diào)控MC3T3-E1細(xì)胞增殖與分化*
- QF-PCR技術(shù)在快速產(chǎn)前診斷常見非整倍體染色體異常中的應(yīng)用*

