MicroRNA-450a-3p 通過抑制Bub1 基因的表達調控小鼠細胞增殖和胚胎發育*
劉 晨, 楊丹丹, 蔣鳳兵, 白慧麗, 李寶林, 羅 敏, 湛曉琴, 施 瓊
(重慶醫科大學檢驗醫學院臨床檢驗診斷學教育部重點實驗室,重慶400016)
自然流產的發生率約占臨床妊娠的10% ~20%,其中因染色體數目異常引起的自然流產為總數的50%左右[1],而染色體數目異常胚胎細胞的發生機制至今尚不清楚。胚胎細胞的正常分裂是胚胎發育過程中的關鍵環節。為了確保分裂的正確性,真核生物細胞內形成一套監護網絡即紡錘體組裝檢查點(spindle assembly checkpoint,SAC)。染色體著絲粒行使檢查點功能時,關卡蛋白(checkpoint,CP)起著重要作用[2],其中Bub1 是最主要的組件蛋白之一,且Bub1 基因表達下調可導致細胞分裂染色體異常,進而影響細胞增殖和胚胎發育。最近發現,microRNA(miRNA)在胚胎干細胞的發育和分化過程中發揮重要作用,Perera 等[3]認為miRNA 可能通過調控Bub1 的mRNA 和/或蛋白水平影響胚胎發育。經過生物信息學方法預測,miR-450a-3p 可以調控靶基因Bub1 的表達。本文旨在以小鼠胚胎成纖維細胞(mouse embryonic fibroblasts,MEFs)為研究對象,通過應用miR -450a -3p 模擬體(mimic)確定miR-450a -3p 能特異性結合Bub1 的3’- 非翻譯區(untranslated region,UTR),利用Western blotting、實時定量PCR (quantitative real - time PCR,qRT -PCR)等方法探究miR -450a -3p 對Bub1 表達的調控機制,以及miR-450a-3p 對MEFs 增殖、凋亡、細胞周期和染色體數目的影響,為臨床治療自然流產、防治胚胎發育異常提供理論依據。
材 料 和 方 法
1 材料
1.1 細胞、質粒和腺病毒 HEK -293 細胞由重慶醫科大學檢驗醫學院分子醫學研究室提供;表達Bub1 3’-UTR 熒光報告基因載體pMIR -3’、用于轉染效率校正的表達半乳糖苷酶的熒光報告基因載體pMIR-REPORT β-gal 對照質粒、包含有與miR-450a-3p mimic 高度互補的MRE(miRNA response element)熒光報告基因載體MRE -450a -3p(5’-ATGAATGCAAAGCATCCCCAAT - 3’)和分別包含Bub1 3’-UTR 兩種突變的螢光素酶報告基因載體Bub1 3’- UTR mut1(5’- ATGCTTAATGGACCTTCTCCAAAA-3’)、Bub1 3’-UTR mut2(5’-AATGAATATGGACCTTCTGGTTAA -3’)由本實驗室前期利用Promega 雙報告螢光素酶檢測試劑盒構建;過表達Bub1 的重組腺病毒Ad-Bub1 由本實驗室前期構建。
1.2 主要試劑和儀器 miR -450a -3p mimic 及陰性對照mimic 購自廣州銳博生物科技有限公司,miR-450a -3p mimic 序列為5’- AUUGGGGAUGCUUUGCAUUCAU-3’,陰性對照mimic 序列為5’-UUCUCCGAACGUGUCACGUTT-3’;DMEM 培養基、胎牛血清、青霉素/鏈霉素購自HyClone,脂質體Li-
pofectamine 2000、Trizol 購自Invitrogen,逆轉錄PCR試劑盒、qRT - PCR 試劑盒購自TaKaRa,MTT、DMSO、ECL 試劑盒和秋水仙素購自Sigma,氯化鉀、甲醇、冰醋酸購自重慶川東試劑公司,Hoechst 染色試劑盒購自北京晶美公司,Giemsa 染色試劑盒購自南京建成生物公司。Bub1 抗體和β - actin 抗體均購自Santa Cruz,HRP 標記的鼠抗羊IgG(用于Bub1 蛋白檢測)和羊抗鼠IgG(用于β -actin 檢測)均購自北京中杉金橋生物技術公司。qRT - PCR 儀購自Corbett,垂直電泳槽購自北京君意東方電泳設備有限公司,Western blotting 顯影儀購自Bio -Rad,濃度測定儀購自Thermo,MTT 檢測用酶標儀購自Sunrise,熒光素酶報告分析儀購自Promega。細胞培養皿、細胞培養板均購自Corning。
2 方法
2.1 MEFs 的制備、培養和分組 無菌條件下取14.5 胚齡(days postcoitum,dpc)的小鼠胚胎,移去胚胎的四肢和內臟,并棄之。留下頭的下部,移去腦部或含有腦的頭上部。剪碎后經胰酶消化后在37 ℃、5%CO2細胞培養箱中培養,培養基為DMEM 高糖培養基(加入10%胎牛血清、1 ×105U/L 青霉素、100 mg/L 鏈霉素)。取5 代以內對數生長期、生長狀態良好的Mefs 細胞,隨機分為3 組:(1)空白對照組:未做任何處理;(2)陰性對照組:轉染control mimic組;(3)實驗組:轉染miR -450a -3p mimic 組。相同條件重復3 次。
2.2 qRT-PCR 檢測miR -450a -3p mimic 轉染前后miR-450a -3p 水平 Trizol 法分別提取3 組細胞總RNA,低溫送至廣州銳博生物科技有限公司進行qRT-PCR 檢測成熟miR -450a -3p 的表達,每組實驗重復3 次。
2.3 螢光素酶報告基因檢測實驗 將MEFs 以30%密度接種于6 孔板,按LipofectamineTM2000 說明轉染實驗干預因素,實驗分組同前,同時共轉染pMIR-3’,設3 個復孔。轉染36 h 后棄去培養基,PBS 洗3 次,收獲細胞,每孔加入200 μL 細胞裂解液,室溫輕微振蕩15 min。在熒光素酶報告分析儀專用檢測板每孔加入30 μL 熒光素酶催化底物,再加入20 μL 細胞裂解產物后混勻,測定熒光素酶活性,每組實驗重復3 次。所有數據都經過Promega 雙報告系統pMIR -REPORT β -gal 對照質粒為內參校正后進行統計學分析。
2.4 Western blotting 檢測miR-450a-3p mimic 轉染前后Bub1 蛋白水平 接種MEFs 以60%密度接種于直徑為10 cm 的細胞培養皿中,待細胞達到對數生長期,按LipofectamineTM2000 的說明轉染實驗干預因素,實驗分組同前。繼續常規培養,48 h 后收集細胞,提取細胞總蛋白,采用BCA 法進行蛋白定量。各取200 μL 樣品上樣進行SDS -PAGE,Ⅰ抗分別為Bub1抗體(1∶500)和β -actin 抗體(1∶1 000),Ⅱ抗分別為鼠抗羊IgG(1∶5 000)和羊抗鼠IgG(1∶5 000),最后按ECL 試劑盒說明進行電化學發光檢測,并用Bio -Rad顯影儀采集圖像。
2.5 qRT-PCR 檢測miR -450a -3p mimic 轉染前后Bub1 mRNA 水平 Trizol 法分別提取3 組細胞總RNA,濃度儀測定樣品純度和含量,按逆轉錄試劑盒說明書提供的方法逆轉錄,逆轉后的cDNA 作為PCR 的模板進行PCR 擴增。Bub1 上游引物5’-TGGTTGAACAAGTCCACAGC - 3’,下游引物5’-CTGACCCAGGTCAATCAATG - 3’。內參照選用小鼠的GAPDH,上游引物5’-GGCTGCCCAGAACATCAT-3’,下游引物5’-CGGACACATTGGGGGTAG-3’。反應體系為:cDNA 2 μL,SyberGreen Mix 10 μL,上、下游引物各0.5 μL,ddH2O 12 μL。反應條件為:95 ℃變性60 s;95 ℃30 s,59 ℃20 s,72 ℃20 s,共35 個循環。以Bub1 mRNA 拷貝數與內參照GAPDH mRNA 拷貝數的比值為Bub1 的相對表達量。
2.6 MTT 檢測miR -450a -3p 對MEFs 增殖的影響 用0.25%胰蛋白酶消化細胞,以每孔500 個接種于96 孔板中,加入200 μL DMEM 完全培養基,常規培養待細胞貼壁后加入實驗干預因素,另設一組同時經miR-450a-3p mimic 和Ad -Bub1 處理,共4 組。每組設置10 個復孔。于0 h、12 h、24 h、36 h、48 h 和60 h 分別加入20 μL MTT,37 ℃繼續培養4 h,小心棄上清。再加入150 μL DMSO,振蕩搖勻,酶標儀測定各孔490 nm A 值,重復3 次。
2.7 Hoechst 染色檢測miR -450a -3p 對MEFs 凋亡的影響 用0. 25% 胰蛋白酶消化細胞,以每孔500 個接種于96 孔板中,加入200 μL DMEM 完全培養基,常規培養待細胞貼壁后加入實驗干預因素,另設一組同時經miR -450a -3p mimic 和Ad - Bub1處理,共4 組。每組設置3 個復孔。48 h 后,每孔依次加入細胞染色緩沖液100 μL,Hoechst 染色液0.5 μL,冰浴30 min,PBS 洗滌1 次,熒光顯微鏡下計數300 個細胞。凋亡率(%)=凋亡細胞數/細胞總數×100%。
2.8 流式細胞術檢測miR-450a-3p 對MEFs 細胞周期的影響 用0.25%、不含EDTA 的胰蛋白酶消化收集加入實驗干預因素0 h、12 h、24 h、36 h、48 h和60 h 的3 組細胞,PBS 洗滌2 次后,重懸于預冷的70%乙醇。4 ℃保存,上流式細胞儀分析各組細胞的細胞周期(由重慶醫科大學兒童醫院兒研所完成檢測)。每組設3 個平行樣本,實驗重復3 次。
2.9 染色體核型分析檢測miR -450a -3p 對Mefs細胞染色體數目的影響 細胞傳代24 h 后,經觀察有較多分裂期細胞,加入終濃度為0.3 mg/L 的秋水仙素處理3 h,使分裂的細胞停止于有絲分裂中期。隨后胰酶消化收集細胞,再經0.075 mol/L KCl 低滲膨脹細胞,減少染色體間的相互纏繞和重疊,最后用甲醇和冰醋酸將細胞固定于載玻片上,經Giemsa 染色后在顯微鏡下計數300 個細胞,觀察染色體的結構和數量。
3 統計學處理
結 果
1 miR-450a-3p mimic 能夠上調MEFs 中miR-450a-3p 的表達
經qRT-PCR 檢測結果顯示,加入外源性miR-450a-3p mimic,與陰性對照組相比,miR-450a -3p的表達明顯增加4.4 倍(P <0.01),見圖1。

Figure 1. The expression of miR-450a-3p in MEFs quantified by qRT - PCR. MEFs were transfected with miR -450a-3p mimic for 48 h. ±s.n =3. **P <0.01 vs control mimic group.圖1 qRT-PCR 檢測miR-450a-3p mimic 轉染前后miR-450a-3p 水平
2 miR-450a-3p 通過靶作用于Bub1 3’-UTR調控Bub1 表達
螢光素酶報告基因檢測結果顯示,經pMIR -3’和miR-450a -3p mimic 共轉染的MEFs 的螢光素酶活性比陰性對照組下降57% (P <0. 01),見圖2A。經序列分析,我們發現Bub1 基因轉錄產物的3’-UTR 在終止密碼子后與miR -450a -3p 有14個堿基互補,見圖2C。
為了驗證以上結果,將pMIR-3’與MRE-450a-3p 進行共轉染,與陰性對照組相比,MEFs 的螢光素酶活性被抑制了90%左右(P <0.01),見圖2B。同時,把Bub1 3’-UTR 與miR-450a-3p 結合的位點做了突變,見圖2C,并進行轉染,可以看到突變mut1 和mut2 均能夠使螢光素酶活性明顯升高,也就是抑制了miR-450a-3p 與Bub1 3’-UTR 的結合,見圖2B。
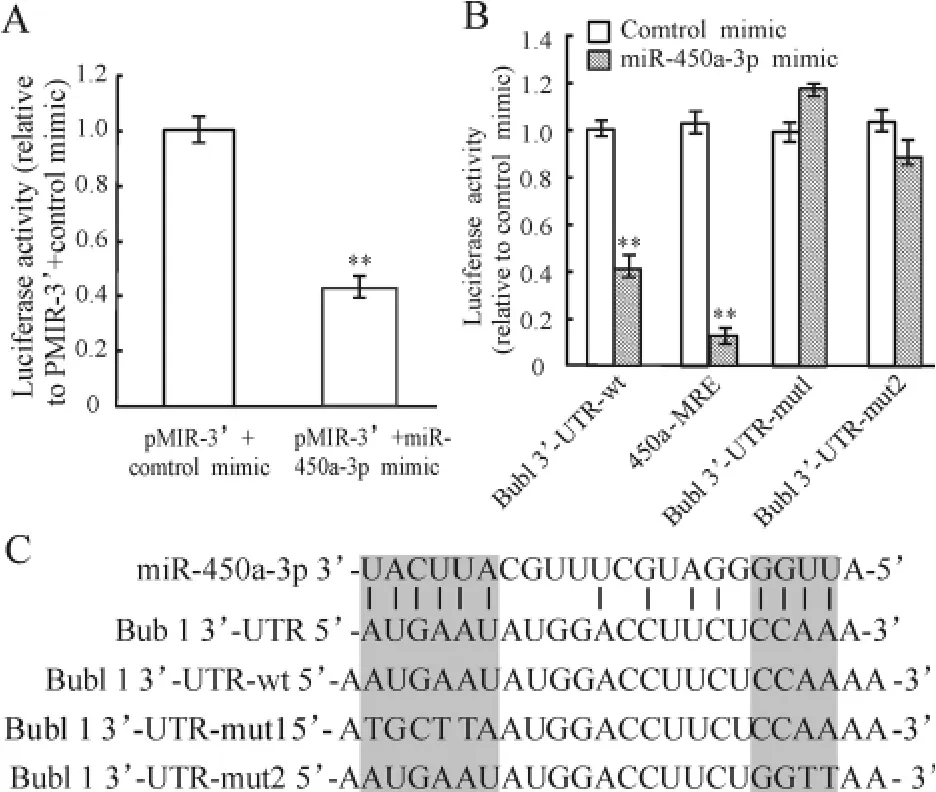
Figure 2. miR-450a-3p binds to the 3'-UTR of mouse Bub1 mRNA. A:luciferase activity of MEFs after cotransfected with pMIR - 3' vector and miR - 450a - 3p mimic. ±s.n=3. **P <0.01 vs pMIR -3'+control mimic group. B:luciferase activity of MEFs after transfected with Bub1 3' - UTR - wt,450a - MRE,Bub1 3'-UTR-mut1 or Bub1 3'-UTR-mut2 in the presence of miR-450a -3p mimic. ±s. n =3. **P<0.01 vs control mimic group. C:sequences of the miR-450a-3p binding sites within mouse Bub1 mRNA (Bub1 3'-UTR),wild -type 3'-UTR of Bub1(Bub1 3'-UTR -wt)and mutant 3'-UTR nucleotides of the miR-450a-3p binding sites (Bub1 3'-UTR-mut1 and Bub1 3'-UTR-mut2).圖2 螢光素酶報告基因實驗檢測miR-450a-3p 與Bub1 3’-UTR 的結合
3 miR-450a-3p 干擾MEFs 中Bub1 蛋白水平的表達
Western blotting 檢測MEFs 中Bub1 蛋白表達水平,結果顯示,與空白對照相比,實驗組細胞Bub1 蛋白明顯減少(P <0.01),而陰性對照組與空白對照組之間差別不大,表明MEFs 轉染miR-450a-3p 會使Bub1 蛋白水平明顯減少,見圖3。
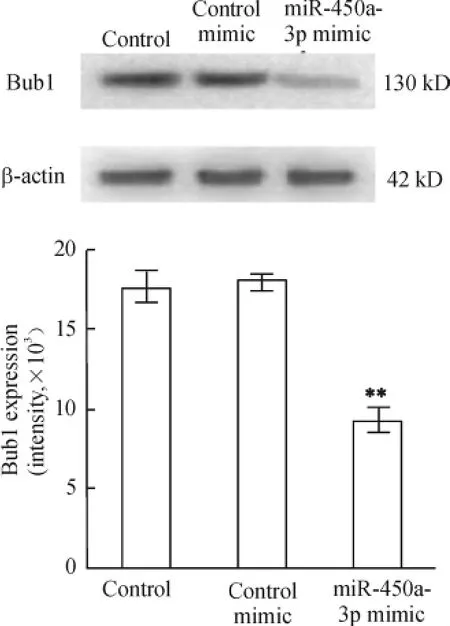
Figure 3. Bub1 protein expression in MEFs 48 h after transfected with miR-450a -3p mimic was detected by Western blotting. ± s. n = 3. **P <0. 01 vs control mimic group.圖3 Western blotting 檢測miR-450a-3p mimic 轉染前后Bub1 蛋白的表達
4 miR-450a-3p 干擾MEFs 中Bub1 mRNA 水平的表達
qRT - PCR 檢測MEFs 中Bub1 mRNA 表達水平,結果顯示,與空白對照相比,實驗組細胞和陰性對照組細胞Bub1 mRNA 表達水平的變化均不明顯,無顯著差異,表明MEFs 轉染miR-450a-3p 并不會使Bub1 轉錄水平改變,見圖4。
5 miR-450a-3p 對MEFs 增殖和凋亡的影響
MTT 法檢測細胞增殖,結果顯示,經mimic 處理后36 h 內,3 組細胞增殖率間沒有明顯差異,而60 h時與空白對照組相比,實驗組細胞增殖率明顯減低(P <0.01),而陰性對照組與空白對照組之間無顯著差異。但在加入miR - 450a - 3p 的同時過表達Bub1,細胞增殖率相比較對照組不會出現明顯的下降。這表明miR-450a-3p 可以抑制MEFs 的增殖,且加入外源性的Bub1 能干擾這種抑制,見圖5A。
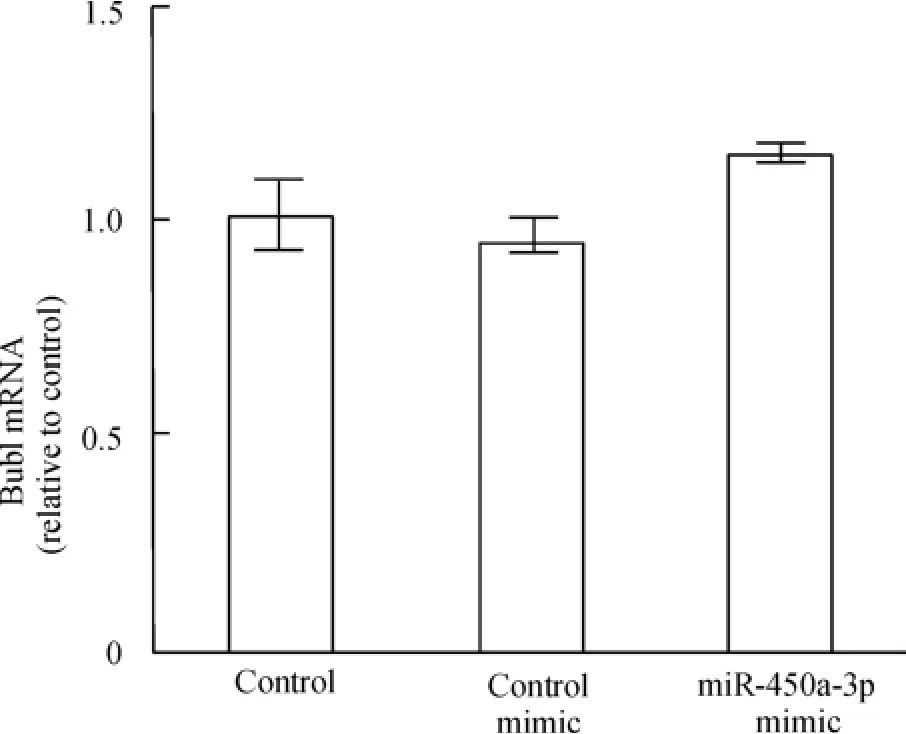
Figure 4. Bub1 mRNA expression in MEFs 48 h after transfected with miR -450a -3p mimic was detected by qRT -PCR. ±s.n=3.圖4 qRT-PCR 檢測miR-450a-3p mimic 轉染前后Bub1 mRNA 的表達
Hoechst 染色檢測細胞凋亡結果顯示,經mimic處理后48 h,與空白對照組相比,實驗組細胞凋亡的百分比明顯增加,Hoechst 染色細胞陽性率由2.33%上升至7.85%(P <0.01)。而陰性對照組Hoechst染色細胞陽性率為2.58%,與空白對照組之間無顯著差異。但在加入miR -450a -3p 的同時過表達Bub1,Hoechst 染色細胞陽性率相比較對照組不會出現明顯的升高。這表明miR -450a -3p 可以引起MEFs 的凋亡,且加入外源性的Bub1 能干擾其促凋亡的作用,見圖5B、C。
6 miR-450a-3p 對MEFs 細胞周期的影響
流式細胞術分析結果顯示,經mimic 處理后48 h,與空白對照組相比,實驗組細胞大多數被阻滯在G1/G0期,由35.89%上升至55.04%(P <0.01),而陰性對照組細胞G1/G0期占39.38%,與空白對照組之間無顯著差異,見圖6。這就說明在Mefs細胞中miRNA-450a-3p 所引起的Bub1 表達的下調,會導致SAC 功能異常,多數細胞過早地停止分裂,被阻滯在G1/G0期。

Figure 5. Effects of miR-450a -3p on proliferation and apoptosis of MEFs. A:the proliferation of MEFs was measured using the MTT;B:the apoptosis of MEFs was measured using Hoechst staining (×200);C:300 cells were counted in every experiment to calculate the Hoechst positive cell percentage. ±s.n=3. **P <0.01 vs control mimic group.圖5 miR-450a-3p mimic 轉染前后增殖和凋亡的變化

Figure 6. Effects of miR-450a-3p on cell cycle of MEFs. ±s.n=3. **P <0.01 vs control mimic group.圖6 miR-450a-3p mimic 轉染前后細胞周期的變化
7 miR-450a-3p 對細胞染色體數目的影響
染色體核型分析結果顯示,與空白對照組相比,實驗組細胞染色體數目異常率由4. 75% 上升至28.74%(P <0.01),而陰性對照組細胞染色體數目異常率為5.02%,與空白對照組之間無顯著差異,見圖7A。由miR -450a -3p 所引起的染色體數目異常有非整倍體和多倍體,其中非整倍體包括XXY 和2n-1,多倍體包括3n 和4n,見圖7B。
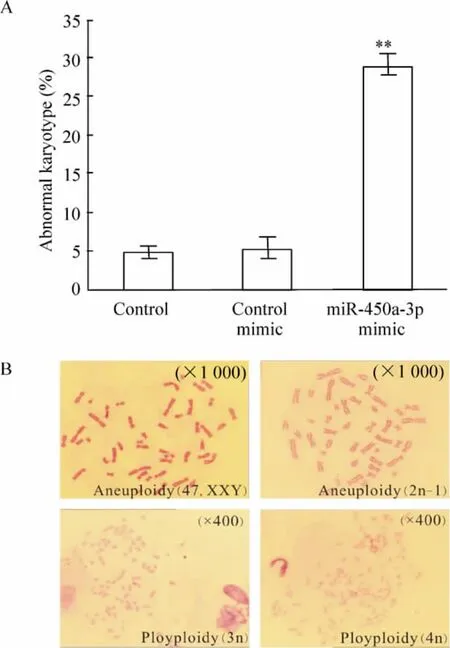
Figure 7. Abnormal karyotype in MEFs with overexpressed miR-450a -3p. A:abnormal karyotype cell percentage.±s.n=3. **P <0. 01 vs control mimic group. B:presentative abnormal karyotypes of MEFs in miR -450a-3p group (Giemsa staining).圖7 miR-450a-3p mimic 轉染前后染色質核型分析
討 論
近年來,國內外對miRNA 的研究不斷增多,人們逐漸認識到其在基因表達調控中的重要性。miRNA 是一類大小約21 ~23 個核苷酸的非編碼單鏈小分子RNA,由pri-miRNA 經Drosha 處理和Dicer 剪切所生成[4]。通常miRNA 可識別特異的mRNA,并通過不完全配對靶結合到mRNA 的3’-UTR,影響靶向mRNA 的穩定性或抑制其翻譯,進而調節靶基因的表達[5],這就揭示了一個嶄新的轉錄后基因調控機制[6]。而對miRNA 的研究,大多數都是通過體外構建miRNA 的模擬體miRNA mimics 實現的。Bernstein 等[7]指出,敲除Dicer 這一miRNA 生成過程中重要的核酸酶會導致小鼠胚胎在7.5 dpc 前死亡。同時,Perera 等[3]證明了敲除Bub1 的小鼠胚胎在3.5 dpc 后也會死亡。這些結果說明miRNA 在胚胎干細胞的增殖分化和早期胚胎發育中起著重要作用,而這一作用很可能是通過靶作用于Bub1 來實現的。
Bub1 作為CP 的主要組件蛋白之一[8],可以通過調節相應蛋白的活性起到調節紡錘體微管和著絲粒連接的作用,在有絲分裂過程中監控染色體正確排列和等量分離,為細胞有絲分裂的正常進行提供保障。此前有學者指出Bub1 失調所致的SAC 病變在腫瘤形成過程中有重要作用[9]。我們在前期實驗中發現Bub1 基因的缺失會導致小鼠胚胎細胞有絲分裂出現異常,這不僅會導致細胞染色體數目的異常,還會改變細胞周期、中止細胞分裂甚至細胞的死亡。同時,在對人類自然流產胚胎細胞的分析中也發現有明顯的Bub1 下調以及染色體核型異常[10]。
本實驗室在前期研究中,通過生物信息學方法發現有8 種miRNA 均能靶作用于Bub1 3’-UTR,分別是miRNA -30a、30e、297b、450a -3p、466a -3p、467a、467e 和494,其中miR -450a -3p 的作用尤為顯著。miR-450a-3p 在多種組織中廣泛表達,但對其生物學功能知之甚少,僅僅有研究指出其在子宮內膜癌肉瘤和前列腺癌[11]中有表達差異,但是差異都不大。在本實驗中,以Bub1 基因作為主要研究對象,通過螢光素酶報告實驗證實了miR -450a -3p可以下調pMIR -3’的熒光素酶活性,即靶作用于Bub1 3’-UTR。隨后,我們又用了2 個方法來驗證以上結論:(1)將MRE -450a -3p 與miR -450a -3p mimic 共轉染HEK-293 細胞。MRE 主要存在于mRNA 的3’UTR 中,內含7 個堿基大小的特征性位點能與相對應miRNA 的5’端高度結合[12]。我們可以看到共轉染MRE -450a -3p 能明顯抑制熒光素酶活性。(2)將Bub1 3’-UTR 區域的2 個miR -450a-3p 結合位點突變,構建了突變體螢光素酶報告基因載體,與miR -450a -3p mimic 轉染HEK -293 細胞,與pMIR -3’相比,螢光素酶活性明顯恢復,證明miR-450a-3p 通過與Bub1 3’-UTR 的結合位點相結合發揮作用。
我們采用Western blotting 和qRT - PCR 的方法,發現實驗組的Bub1 蛋白水平有明顯降低,但是mRNA 水平受實驗干預因素的影響不大。這可能是因為miR-450a -3p 作為一個翻譯抑制子,主要是對基因表達翻譯水平的調節,但卻不會影響靶基因mRNA 水平的降解。但同時也有學者指出,有一些miRNA 會誘導靶作用mRNA 的降解從而抑制蛋白質合成[13],且miR-10a 能夠通過與核糖體蛋白mRNA 5’-UTR 結合增強翻譯,而不是抑制翻譯[14]。因此miRNA 調控基因表達方式的不同,也成為miRNA 研究中一個急需解決的問題。
本文結果同時也表明,過表達miR -450a -3p會通過下調Bub1 的表達而抑制MEFs 的增殖,這與Perera 等[3]指出的Bub1 缺失會影響MEFs 增殖的結論是一致的。究其抑制增殖的原因可能有2 個:(1)促進Mefs 細胞的凋亡;(2)將細胞大量阻滯在G1/G0期,使細胞過早地停止分裂。同時經過染色體核型分析,可以看到非整倍體、多倍體等異常核型頻率增高,這與Perera 等[3]指出的Bub1 缺失致有絲分裂異常的結論也是一致的。
綜上所述,miR -450a -3p 能夠通過靶結合到Bub1 3’-UTR 并干擾Bub1 的表達,抑制胚胎細胞的增殖和發育,導致細胞染色體數目異常。為研究因染色體數目異常所導致的自然流產及產前診斷提供了新的思路,為提高臨床妊娠質量奠定了基礎。
[1] 雷 瓊,王 瓊,周燦權,等. 不同分子遺傳學方法用于自然流產絨毛細胞遺傳分析的效果[J]. 中華婦產科雜志,2009,44(4):253 -256.
[2] Rieder CL,Cole RW,Khodjakov A,et al. The checkpoint delaying anaphase in response to chromosome monoorientation is mediated by an inhibitory signal produced by unattached kinetochores [J]. J Cell Biol,1995,130(4):941 -948.
[3] Perera D,Tilston V,Hopwood JA,et al. Bub1 maintains centromeric cohesion by activation of the spindle checkpoint[J]. Dev Cell,2007,13(4):566 -579.
[4] Cai X,Hagedorn CH,Cullen BR. Human microRNAs are processed from capped,polyadenylated transcripts that can also function as mRNAs[J]. RNA,2004,10(12):1957-1966.
[5] Zhang R,Su B. Small but influential:the role of microRNAs on gene regulatory network and 3'UTR evolution[J].J Genet Genomics,2009,36(1):1 -6.
[6] Bartel DP. MicroRNAs:genomics,biogenesis,mechanism,and function [J]. Cell,2004,116(2):281 -297.
[7] Bernstein E,Kim SY,Carmell MA,et al. Dicer is essential for mouse development[J]. Nat Genet,2003,35(3):215 -217.
[8] Boyarchuk Y,Salic A,Dasso M,et al. BUB1 is essential for assembly of the functional inner centromere[J]. J Cell Biol,2007,176(7):919 -928.
[9] Masuda A,Takahashi T. Chromosome instability in human lung cancer:possible underlying mechanism and potential consequences in the pathogenesis[J]. Oncogene,2002,21(45):6884 -6897.
[10] 施 瓊,袁泰先,王 箭,等. 有絲分裂關卡基因致染色體數目異常自然流產胚胎發生的機制[J]. 中華檢驗醫學雜志,2008,21(3):309 -315.
[11] Castilla Má,Moreno -Bueno G,Romero - Pérez L,et al. Micro-RNA signature of the epithelial-mesenchymal transition in endometrial carcinosarcoma[J]. J Pathol,2011,223(1):72 -80.
[12] Nahvi A,Shoemaker CJ,Green R. An expanded seed sequence definition accounts for full regulation of the hid 3’UTR by bantam miRNA[J]. RNA,2009,15(5):814 -822.
[13] Liu Q,Fu H,Sun F,et al. MiR-16 family induces cell cycle arrest by regulating multiple cell cycle genes[J].Nucleic Acids Res,2008,36(16):5391 -5404.
[14] ?rom UA,Nielsen FC,Lund AH. MicroRNA-10a binds the 5’UTR of ribosomal protein mRNAs and enhances their translation[J]. Mol Cell,2008,30(4):460 -471.

