下呼吸道感染患者銅綠假單胞菌分離株氨基糖苷類耐藥相關基因分析
畢 玲,葛庚芝,賴雁平,于樹云,司 進,李 彬,張貴生
(天津醫科大學第二醫院,天津300211)
銅綠假單胞菌(PAE)廣泛分布于自然界及健康人的皮膚、腸道和呼吸道,當人體免疫力降低、嚴重創傷或進行創傷性醫療操作時容易引起內源性感染[1],是下呼吸道感染的重要病原體[2]。氨基糖苷類藥物為廣譜抗生素,一直與β-內酰胺類合用作為治療PAE感染的一線藥物[3]。隨著氨基糖苷類藥物的長期使用,PAE對這類藥物的耐藥率明顯升高。研究發現,其耐藥機制主要是產生AMEs、16S rRNA甲基化酶和氨基糖苷類藥物作用靶位16S rRNA基因突變,以產生AMEs為常見[4]。16S rRNA甲基化酶首次發現于產氨基糖苷的放線菌中,近年來在人類致病菌中亦相繼報道了這一機制介導的高水平氨基糖苷類耐藥[5]。為調查對氨基糖苷類耐藥的PAE下呼吸道感染分離株中與耐藥相關的氨基糖苷類修飾酶(AMEs)基因和16S rRNA甲基化酶基因(以下簡稱甲基化酶基因)的存在狀況,2009~2010年,我們收集了從下呼吸道感染患者合格痰標本中分離的對臨床常用氨基糖苷類藥物耐藥的52株PAE,檢測了6種AMEs基因及6種甲基化酶基因,旨在探討下呼吸道感染分離的PAE對氨基糖苷類藥物的耐藥機制。
1 材料與方法
1.1 材料 52株PAE分離自下呼吸道感染患者合格痰標本(天津醫科大學第二醫院32株,天津醫科大學總醫院20株),經K-B法證實對慶大霉素、妥布霉素、阿米卡星及奈替米星中至少1種藥物耐藥,結果判讀依照美國臨床實驗室標準化委員會(CLSI)2008年版標準。半數抑菌濃度(MIC50)分別為1 024、128、16和>1 024 mg/L,均以AMS-60全自動微生物分析儀鑒定到種。培養基購自天津金章科技發展有限公司。主要實驗儀器有Thermomixer恒溫振蕩儀、Centrifuge 5415D離心機、PCR儀及微量移液器,DYY-6D型電泳儀,GELDOC-200型凝膠成像系統。主要試劑為Premix Taq、DNA marker (DL 1 000)及6×Loading Buffer(大連TaKaRa生物技術公司),PCR引物由上海生物工程有限公司合成。
1.2 PCR擴增模板制備及耐藥基因檢測 采用煮沸法制備PCR擴增模板。取1.5 mL離心管加入200 μL、滅菌去離子水,刮取血平板上培養16~18 h的菌落,充分振蕩混勻后達到5號麥氏比濁管的濁度,98℃恒溫振蕩加熱10 min,12 000 r/min離心6 min,吸取上清液-20℃保存備用。PCR法檢測52株PAE的6種AMEs基因aac(3)-Ⅱ、aac(6')-Ⅰb、aac(6')-Ⅱ、ant(2″)-Ⅰ、ant(3″)-Ⅰ和aph(3')-Ⅵ,并檢測其中25株對4種藥物全部耐藥菌株(泛耐藥菌)的甲基化酶基因armA、rmtA、rmtB、rmtC、rmtD和npmA。aac(3)-Ⅱ、aac(6')-Ⅰb、ant(3″)-Ⅰ和npmA基因使用文獻[6]的 PCR引物,其他基因的PCR引物使用Primer Premier 5.0軟件自行設計,見表1。PCR反應體系:Premix Taq酶12.5 μL,上游引物和下游引物各1 μL,DNA模板2 μL,加滅菌去離子水至25 μL。去離子水為陰性對照。PCR反應熱循環參數為:93℃預變性3 min,然后93℃變性30 s→退火30 s→72℃延伸1 min,共30個循環,最后一個72℃延長至5 min。擴增產物以DL 1 000為相對分子質量標準,用1%瓊脂糖凝膠在10 V/cm電壓下電泳20~30 min,用凝膠成像系統于紫外燈下觀察結果,Quantity One軟件分析PCR產物并照相保存。

表1 6種AMEs基因和6種16S rRNA甲基化酶基因PCR引物
1.3 陽性產物測序及分析 各種基因的PCR陽性產物各取1株送華大基因科技公司進行雙向測序,測序結果用Chromas軟件讀序后與GenBank中已發布的序列做BLASTn比對,判斷其同源性。
2 結果
2.1 耐藥基因檢出情況 52株PAE的耐藥譜及耐藥基因分布見表2。52株PAE中aac(3)-Ⅱ、aac (6')-Ⅰb、aac(6')-Ⅱ和ant(2″)-Ⅰ基因檢出率分別為53.8%(28/52)、51.9%(27/52)、40.4%(21/ 52)和21.2%(11/52),未檢出ant(3″)-Ⅰ和aph (3')-Ⅵ基因。AMEs基因總檢出率為92.3%(48/ 52)。其中4株未檢出AMEs基因,19株檢出一種AMEs基因,19株檢出兩種AMEs基因,10株檢出三種AMEs基因。泛耐藥菌株中rmtB基因的檢出率為52.0%(13/25),未檢出其他甲基化酶基因。aac (3)-Ⅱ基因和aac(6')-Ⅰb基因的PCR產物電泳圖分別見圖1和圖2。

表2 52株PAE的耐藥譜及耐藥基因分布
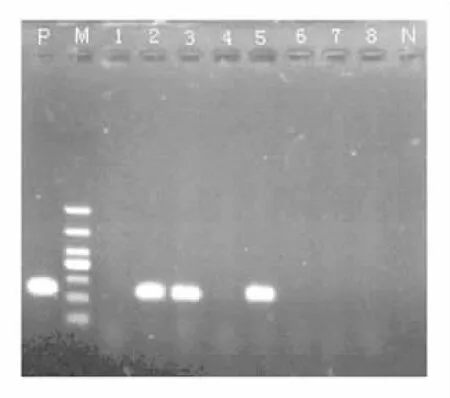
圖1 aac(3)-Ⅱ基因PCR產物電泳圖

圖2 aac(6')-Ⅰb基因PCR產物電泳圖
2.2 測序及序列分析結果 aac(6')-Ⅰb、aac(6')-Ⅱ、ant(2″)-Ⅰ和rmtB的陽性產物序列分別與Gen-Bank登錄號為HQ705763、HM366563、GU966683和 FJ483516的基因序列具有100% 的同源性;aac(3)-Ⅱ陽性產物序列與GenBank登錄號為AF466526的基因序列具有98%的同源性,存在四處堿基置換突變,翻譯成氨基酸序列后發現其中兩處為錯義突變,導致第78位賴氨酸被谷氨酸取代、第84位脯氨酸被亮氨酸取代,另外兩處為同義突變,氨基酸序列同源性為97%。aac(6')-Ⅱ基因和rmtB基因的陽性產物測序圖分別見圖3和圖4。

圖3 aac(6')-Ⅱ基因陽性產物測序圖(部分)

圖4 rmtB基因陽性產物測序圖(部分)
3 討論
氨基糖苷類藥物通過與細菌30 S核糖體亞基高度保守的A位點不可逆地結合抑制細菌蛋白質的合成從而導致細菌死亡。細菌產生的AMEs能夠對氨基糖苷類藥物分子中特定的氨基和羥基進行共價修飾使得藥物與細菌核糖體的結合能力大大降低[7],從而導致耐藥。AMEs按其催化的反應類型可分為乙酰轉移酶(AAC)、核苷轉移酶(ANT)、磷酸轉移酶(APH)三大類,每一類酶中又有許多亞類能修飾不同位置上的氨基或羥基而使細菌產生不同的耐藥表型。
AMEs滅活氨基糖苷類藥物的機制非常復雜。由于不同的氨基糖苷類藥物可具有相同的AMEs作用靶位,因而一種AMEs可以滅活多種氨基糖苷類藥物;由于一種氨基糖苷類藥物的分子結構中可存在多個AMEs作用靶位,因而不同種類的AMEs又可以滅活同種氨基糖苷類藥物。
目前已發現超過50種AMEs,其中已報道在銅綠假單胞菌中存在的有10多種,最常見的是AAC (6')-Ⅱ和ANT(2″)-Ⅰ[8]。本組PAE菌株中AMEs基因的總檢出率為92.3%,共檢出4種AMEs基因,其中aac(3)-Ⅱ、aac(6')-Ⅰb和aac(6')-Ⅱ為流行基因,與國內文獻[1,9,10]報道的流行基因型有一定差別,可能與各地區常用的氨基糖苷類藥物不同有關。
本組多數菌株的耐藥表型與其基因型相符。值得注意的是,雖然AAC(6')-Ⅰb能修飾阿米卡星藥物分子,但本組中除了有3株只攜帶aac(6')-Ⅰb的菌對阿米卡星耐藥之外,9株只攜帶aac(6')-Ⅰb和6株同時攜帶另外一種乙酰轉移酶基因的菌均對阿米卡星敏感,而5株同時攜帶核苷轉移酶基因和1株同時攜帶另外兩種乙酰轉移酶基因的菌均對阿米卡星耐藥,提示AAC(6')-Ⅰb往往需要與核苷轉移酶或另外兩種乙酰轉移酶同時作用才能引發對阿米卡星耐藥。本組中有6株菌只檢出對慶大霉素沒有修飾作用的aac(6')-Ⅰb但對慶大霉素耐藥,有2株菌只檢出對阿米卡星沒有修飾作用的aac(3)-Ⅱ和aac(6')-Ⅱ但對阿米卡星耐藥,另外還有4株耐藥菌未檢出測試的AMEs基因,可能是因為菌株攜帶其他不常見的AMEs基因、藥物外排泵表達增強、發生藥物作用靶位基因突變或核糖體蛋白編碼基因突變等,尚有待進一步研究。
本組aac(3)-Ⅱ陽性產物測序菌株只檢出aac (3)-Ⅱ1種耐藥基因,但對慶大霉素和奈替米星均呈高水平耐藥(MIC值均>1 024 mg/L)。其測序結果翻譯成氨基酸序列后與 GenBank登錄號為AF466526的基因序列相應的氨基酸序列比對,發現存在兩處錯義突變,即第78位賴氨酸被谷氨酸取代、第84位脯氨酸被亮氨酸取代。兩處突變從單個氨基酸殘基上來分析,賴氨酸→谷氨酸可使AAC (3)-Ⅱ修飾酶在相同的pH條件下負電荷數目增多,與帶正電荷的氨基糖苷抗生素作用增強,使菌株表現為高水平耐藥。而第84位脯氨酸→亮氨酸會改變AAC(3)-Ⅱ修飾酶保守區的二級結構,從而使酶的活性發生變化[11]。
rmtB基因首次發現是分離自日本的一株黏質沙雷菌[12]。本組PAE中只檢出rmtB 1種甲基化酶基因,與文獻[9,10]報道相同。4種氨基糖苷類藥物對所有rmtB陽性菌株的MIC值均>1 024 mg/L,呈現高水平泛耐藥。MIC值均>1 024 mg/L的16株高水平泛耐藥菌中有13株檢出 rmtB基因,占81.3%,提示導致下呼吸道感染的氨基糖苷類耐藥PAE對氨基糖苷類高水平泛耐藥主要與rmtB有關。
由于AMEs基因和16S rRNA甲基化酶基因大多是由質粒、整合子及轉座子等可移動遺傳元件介導,易于在細菌之間傳播[9],從而造成耐藥菌株的播散。加強實驗室對細菌耐藥的監測和耐藥基因的流行病學調查有助于了解耐藥菌株的傳播規律,對指導臨床合理使用抗菌藥物、有效控制醫院感染、控制耐藥菌株的播散以及指導抗菌藥物的研發方向均有重要意義。
[1]史偉峰,王玉月,何彩珍,等.銅綠假單胞菌氨基糖苷類藥物修飾酶基因研究[J].檢驗醫學,2007,22(1):67-70.
[2]王一兵,李衛光,朱其鳳.山東省醫院感染控制網下呼吸道感染病原菌分布及耐藥分析[J].中華醫院感染學雜志,2005,15 (5):490-492.
[3]顧覺奮.抗生素的合理應用[M].上海:上海科學技術出版社,2004:55-67.
[4]Doi Y,Arakawa Y.16S Ribosomal RNA Methylation:Emerging Resistance Mechanism against Aminoglycosides[J].Clin Infect Dis,2007,45(1):88-94.
[5]吳瓊,倪語星.一種新的氨基糖苷類耐藥決定因子—質粒介導的16S rRNA甲基化酶[J].微生物與感染,2009,4(1):45-48,58.
[6]糜祖煌,陸亞華.氨基糖苷類修飾酶及其基因檢測[J].現代實用醫學,2004,16(1):13-14.
[7]鄭衛.氨基糖苷類抗生素研究的新進展[J].國外醫藥:抗生素分冊,2005,26(3):101-110.
[8]Poole K.Aminoglycoside resistance in pseudomonas aeruginosa[J].Antimicrob Agents Chemother,2005,49(2):479-487.
[9]汪宏良,鄒義春,柯俊,等.多藥耐藥銅綠假單胞菌16S rRNA甲基化酶、氨基糖苷類修飾酶基因研究[J].中華醫院感染學雜志,2008,18(11):1505-1508.
[10]糜祖煌,秦玲.泛耐藥銅綠假單胞菌16S rRNA甲基化酶、氨基糖苷類修飾酶基因研究[J].中華醫院感染學雜志,2008,18 (12):1656-1658.
[11]陳接根,呂建新,樓永良,等.大腸埃希菌氨基糖苷類耐藥株aac (3)-Ⅱ基因保守區分析[J].遺傳,2004,26(2):202-204.
[12]Doi Y,Yokoyama K,Yamane K,et al.Plasmid-mediated 16S rRNA methylase in Serratia marcescens conferring high-level resistance to aminoglycosides[J].Ant Agents Chem,2004,48(2):491-496.

