鞘氨醇激酶通過調控血管發生促進肝癌轉移
賽巖,代學強,白紀民,劉勇,常菁,范禮斌,崔春萍
鞘氨醇激酶通過調控血管發生促進肝癌轉移
賽巖,代學強,白紀民,劉勇,常菁,范禮斌,崔春萍
目的確定鞘氨醇激酶(SPK)在肝癌轉移中的作用。
方法用 Ad-SPK1 腺病毒感染肝癌細胞 LM-3 使其 SPK過表達,Western blot 檢測 SPK1 表達及激活情況;Transwell、劃痕實驗檢測肝癌細胞遷移情況。體外管狀結構形成實驗檢測 SPK 對臍靜脈內皮細胞(HUVEC)管狀化形成的影響。建立 SPK 過表達裸鼠模型,體內檢測肝癌遷移情況。
結果在體外 SPK 對肝癌細胞的遷移無顯著影響;Ad-SPK 能夠促進 HUVEC 管狀結構形成;裸鼠皮下移植瘤結果顯示 Ad-SPK 促進腫瘤生長和轉移。
結論鞘氨醇激酶通過調控血管發生促進肝癌轉移。
疾病模型,動物; 肝腫瘤; 腫瘤移植; 移植,異種; 鞘氨醇激酶
1 材料和方法
1.1 材料
1.1.1 實驗動物和細胞 BALB/c 裸鼠,雌性,4 周齡,體重 16 ~ 18 g,購自軍事醫學科學院實驗動物中心,飼養于解放軍總醫院 SPF 級動物房。人肝癌細胞 LM-3 購自中國科學院上海細胞庫;人臍靜脈內皮細胞(HUVEC)購自中國協和細胞庫;人胚腎細胞(HEK293)購自中國科學院上海細胞庫。
1.1.2 主要試劑與儀器 BCA-200 蛋白檢測試劑盒購自美國 Pierce 公司;蛋白質分子量標準購于北京全式金生物技術公司;DMEM 培養基、小牛血清購自美國 Gibco 公司;ECM 培養基、內皮細胞生長添加物(ECGS)均購自美國 ScienCell 公司;胰蛋白酶購自美國 Sigma 公司;基質膠(Matrigel 膠)購自美國 BD 公司;SPK1 抗體購自美國 Abcam 公司;GAPDH 抗體購自中杉金橋公司;其他試劑均為國產分析純試劑。細胞培養器材購自美國 Costar 公司;電泳儀、轉膜儀為美國Bio-Rad 公司產品。
1.2 方法
1.2.1 Ad-SPK 的擴增、純化及滴度的測定 將HEK293 細胞接種于 150 mm 平皿中,待細胞生長至 90% 匯合狀態時,加入 Ad-SPK1 病毒,感染復數(multiplicity of infection,MOI)約為 10 個蝕斑形成單位(plaque forming unit,pfu)/細胞[7],36 ~ 48 h 后,當細胞出現完全病變(CPE)時,收集細胞,凍存于 -70 ℃,待累計到 50 ~ 60 個平皿時,統一純化病毒。
將出現 CPE 的 HEK293 細胞于 -70 ℃ 和37 ℃ 之間反復凍融 3 次,2500 r/min 離心 10 min,除去細胞碎片;配制 CsCl 密度梯度液,將凍融后的待純化病毒液加于各管的 CsCl 梯度液之上;10 ℃,136 000 ×g離心 1.5 h,于 1.35 g/ml CsCl溶液和 1.25 g/ml CsCl 溶液之間出現白色霧狀病毒帶;收集病毒帶,并與 1.35 g/ml CsCl 溶液混合,10 ℃,136 000 ×g離心 5.5 h,進一步純化病毒,以 PBS 液為透析液于 4 ℃ 透析病毒,每 2 小時更換一次透析液,共換 5 次;取出純化的病毒液,加無菌甘油至終濃度為 10%,分裝,-70 ℃ 保存。用 TCID50 法測定病毒滴度(IU/ml)[8]。
1.2.2 細胞的感染效率確定 為評價 Ad-SPK 的感染效率,以 Ad5/F11p-GFP(劉楊博士提供,感染滴度 1.0 × 1010pfu/ml)為對照,分別用 0、50、100、150、200 MOI 感染肝癌細胞 LM-3和臍靜脈內皮細胞 HUVEC,2 h 后換液,繼續培養 48 h 后熒光顯微鏡觀察綠色熒光蛋白的表達情況,收集細胞進行流式細胞儀檢測[9]。
1.2.3 SPK 在肝癌細胞中的表達及激酶活性鑒定 用腺病毒 Ad-SPK 感染 LM-3 細胞。48 h 和72 h 后收集細胞,棄上清,加入冰預冷的 1 ml PBS重懸細胞,500 ×g離心 10 min,吸凈上清,加入預冷的細胞裂解液;4 ℃ 放置 30 min 以上使細胞徹底裂解,隨后 16 000 ×g、4 ℃ 離心 30 min,收集上清。蛋白定量后,進行 SDS-PAGE 凝膠電泳,將蛋白轉移至 PVDF 膜上,置于 5% 脫脂牛奶中封閉,用 SPK 多克隆抗體檢測 LM-3 細胞中SPK 的表達及 Ad-SPK 對 LM-3 細胞中 SPK 的激活情況[10]。
1.2.4 Transwell 和劃痕實驗檢測肝癌細胞遷移情況 Transwell:24 孔板下室加入 600 μl 含 5%FBS 的 DMEM 培養基,將小室嵌入。Ad-SPK 感染 LM-3 細胞 36 h 后,胰酶消化細胞,使濃度為1 × 106個/ml,懸于 2% FBS 的 DMEM 培養基中,每孔加入 200 μl;37 ℃ 常規培養 12 ~ 48 h;將 Transwells 轉移至另一加有 4% 多聚甲醛的孔中,固定細胞 15 min;結晶紫染色 10 min;用棉簽輕輕擦去膜上未遷移細胞,光鏡下觀察結果[11]。
劃痕實驗:用馬克筆在 6 孔板背面畫橫線。Ad-SPK 感染 LM-3 細胞 36 h 后且細胞匯合率100%,劃痕,PBS 洗 2 遍;無血清 DMEM 培養液繼續培養 24 h 后顯微鏡下觀察劃痕距離[12]。
1.2.5 HUVEC 體外管狀結構形成實驗 用添加ECGS 的 ECM 培養基常規培養 HUVEC,待細胞長至密度 70% ~ 80%,PBS 輕洗 4 ~ 5 次后加入無血清無生長因子的 ECM 培養基 10 ml。收集培養 24 h 后的條件培養基,500 ×g,4 ℃ 離心10 min,除去死細胞。將上清轉移 EP 管中 -80 ℃備用。
將 Matrigel 膠放于冰水中,置于 4 ℃ 冰箱過夜,使膠完全融化[13]。并預冷所需的吸管、槍頭和培養板;將培養板放在冰上,將膠混勻,用遇冷的無血清無生長因子的 ECM 培養基將 Matrigel 膠稀釋為 30% 的濃度。按 50 μl/cm2比例將膠液加入培養板中;將培養板置于 37 ℃ 細胞培養箱,放置 1 h,使膠凝固。將無血清無生長因子的 ECM 培養基與收集的條件培養基等比例混合,加入胎牛血清,使其濃度達到 10% ~ 20%,將該混合物加到凝固的 Matrigel 膠上。按每孔 1.5 × 105個/100 μl 加入細胞,6 h 后顯微鏡下觀察結果[14]。
1.2.6 SPK 過表達裸鼠模型的建立及組織學檢測 皮下種植:選取 4 周齡雌性 BALB/c 裸鼠12 只,分為 Ad-SPK-LM-3 組與 Ad-null-LM-3組,每組 6 只。取對數生長期的肝癌細胞 LM-3,分別感染 Ad-SPK和 Ad-null 36 h 后消化計數,PBS 洗滌 2 次,重懸于 PBS 中制備成濃度為 1 ×107個/100 μl 的細胞懸液。以 100 μl/只的細胞懸液接種于裸鼠左前肢腋下[15],3 d 后觀察皮下成瘤情況。接種 7 d 后,瘤體成型,此時瘤內注射腺病毒[16-17]。每周注射 2 次至實驗終點。7 周后頸椎脫臼法處死小鼠,將腫瘤組織剝離,取出肝臟和肺臟固定于 10% 緩沖福爾馬林液中 48 h,將肺臟每隔 2 mm 水平剖開查找轉移灶,進行脫水、包埋、切片、HE 染色。
尾靜脈注射:選取 4 周齡雌性 BALB/c 裸鼠12 只,分為 Ad-SPK-LM-3組與 Ad-null-LM-3組,每組 6 只。取對數生長期的肝癌細胞 LM-3,分別感染 Ad-SPK 和 Ad-null 36 h 后消化計數,PBS 洗滌 2 次,重懸于 PBS 中制備成濃度為 1 ×106個/100 μl 的細胞懸液。以 100 μl/只的細胞懸液注射于裸鼠尾靜脈[18-19]。7 d 后,尾靜脈注射腺病毒。每周注射 2 次至實驗終點。4 周后頸椎脫臼法處死小鼠,取出肝臟和肺臟固定于 10% 緩沖福爾馬林液中 48 h,將肺臟每隔 2 mm 水平剖開查找轉移灶,進行脫水、包埋、切片、HE 染色。
1.3 統計學處理
應用 SAS 8.2 統計學軟件進行數據處理。實驗組與對照組檢測結果的比較采用 Student’st檢驗,均以P< 0.05 為差異有統計學意義。
2 結果
2.1 重組腺病毒的感染滴度
重組腺病毒在 HEK293 細胞中大量擴增(圖1),收集細胞,釋放出病毒。經 CsCl 密度梯度和連續密度超速離心,獲得高度濃縮的腺病毒帶。感染滴度為 1.0 × 1011pfu/ml。
2.2 Ad5/F11P-GFP 對 LM-3 細胞和 HUVEC 細胞的感染效率
結果如圖 2所示:隨著 MOI 的增加 Ad5/F11P-GFP 對 LM-3 細胞和 HUVEC 細胞的感染效率增加,在 50 MOI 時均高達 90% 以上,說明Ad5/F11P 腺病毒載體對細胞的感染效率滿足后續實驗要求。

圖 1 HEK293 細胞出現病變效應(A:正常細胞;B:病變區域)Figure 1 HEK293 cells with CPE (A: HEK293 cells; B:CPU)
2.3 SPK 在肝癌細胞中的表達
肝癌細胞 LM-3 中的 SPK 活性高于正常細胞,利用這株細胞為模型,檢測 Ad-SPK 對 SPK的激活情況。結果如圖 3 所示:Ad-SPK 能有效激活 SPK酶活性。
2.4 Ad-SPK 對 LM-3 細胞的遷移的影響
結果如圖 4、圖 5 所示:Ad-SPK 感染 LM-3細胞 36 h 后對細胞遷移并沒有顯著影響。Transwell實驗結果顯示,穿過小室的細胞并無明顯增加;劃痕實驗結果顯示未促進肝癌細胞遷移。
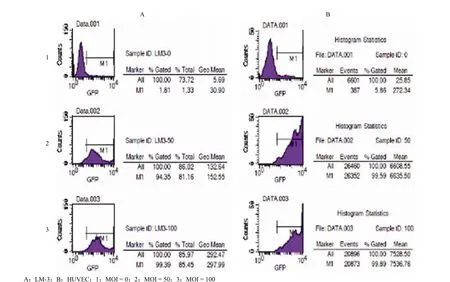
圖 2 Ad5/F11P-GFP 對細胞的感染效率Figure 2 Cells were transfected with Ad5/F11P-GFP

圖 3 Ad-SPK 對 LM-3 細胞 SPK 酶活性的激活Figure 3 Activation of SPK by Ad-SPK
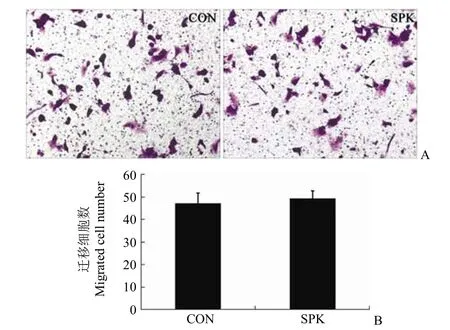
圖 4 SPK 誘導 LM-3 細胞的遷移[A:光學顯微鏡下觀察的細胞遷移結果(100 ×);B:鏡下細胞計數結果]Figure 4 The effect of SPK to migration ability of LM-3 cells (A: The result of LM-3 cell migration; B: The result of LM-3 cell count)
2.5 Ad-SPK 促進 HUVEC 細胞管狀化結構形成
用腺病毒 Ad-SPK 感染 HUVEC 24 h 后,收集細胞進行管狀化實驗分析,結果如圖 6 所示,50 MOI Ad-SPK 感染能夠顯著增加內皮細胞的成管。

圖 5 SPK 誘導 LM-3 細胞的遷移光學顯微鏡下觀察的細胞遷移結果(100 ×)2.0 mmFigure 5 The effect of SPK to migration ability of LM-3 cell
2.6 Ad-SPK 在體內促進腫瘤生長
實驗終點時脫臼法處死小鼠,剝取腫瘤,去除表面脂類和結締組織,如圖 7A。可見瘤體表面光滑,表面被一層薄膜包裹,形狀不規則,質軟。統計腫瘤體積和重量如圖 7B。結果顯示 Ad-SPK 在體內明顯促進腫瘤生長,隨瘤內注射病毒刺激7 周后移植瘤體積明顯高于正常組。其稱重結果顯示,正常組較病毒組輕。
2.7 Ad-SPK 在體內促進腫瘤生長
實驗終點時脫臼法處死小鼠,剝取腫瘤,去除表面脂類和結締組織,如圖 7A。可見瘤體表面光滑,表面被一層薄膜包裹,形狀不規則,質軟。統計腫瘤體積和重量如圖 7B。結果顯示 Ad-SPK 可在體內促進腫瘤生長,瘤內注射病毒刺激 7 周后移植瘤體積明顯高于對照給藥組。稱重結果顯示,對照給藥組較病毒組輕 40% 左右。HE 染色結果顯示肝肺部均未見轉移。
2.8 Ad-SPK 在體內促進腫瘤轉移
實驗終點時脫臼處死小鼠,將肺臟每隔 2 mm水平剖開查找轉移灶,Ad-null-LM-3 組 6 只小鼠肺部切面正常;Ad-SPK-LM-3 組 6 只小鼠中 4 只可見灰白色粟粒狀結節。取全部小鼠肝臟和肺臟做HE 切片染色如圖 8,肝臟中均無明顯轉移灶;尾靜脈注射病毒組在肺部發現多處轉移灶,對照給藥組未見轉移灶。
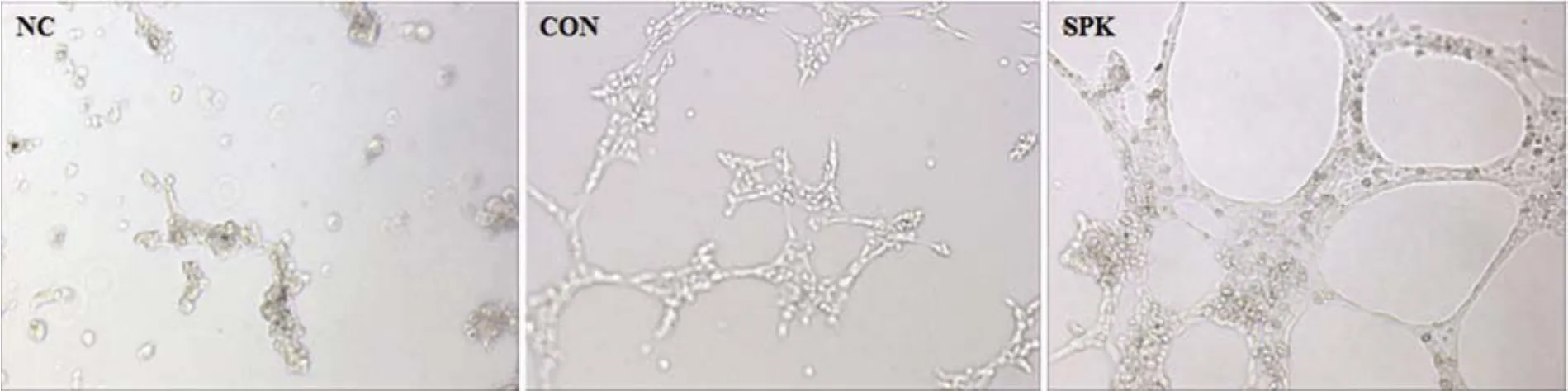
圖 6 SPK 對 HUVEC 細胞管狀化結構形成的影響(100 ×)(NC:DMEM 培養 HUVEC 組;CON:正常 HUVEC 組;SPK:Ad-SPK 感染 HUVEC 組)Figure 6 Effect of SPK on the tubular morphogenesis of HUVEC cells (100 ×).The cells were stimulated with Ad-SPHK (MOI 50)and plated on the Matrigel-coated 24-well plate; NC: DMEM culture; CON: Control group; SPK: SPK treat group
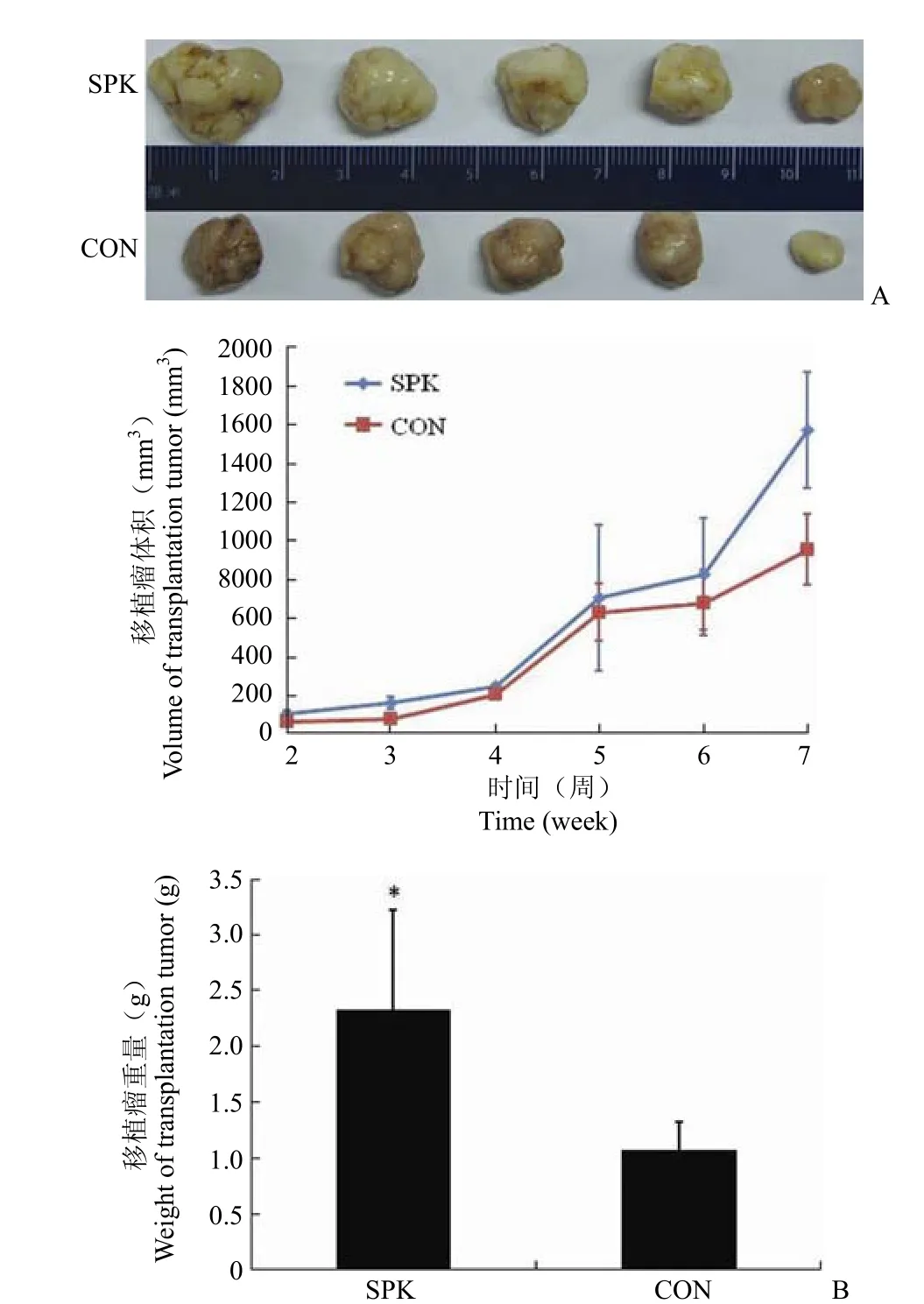
圖 7 移植瘤的體積和重量統計[A:皮下移植瘤的大體觀察;B:移植瘤的體積和重量(SPK:Ad-SPK 給藥組;CON:Ad-null 對照給藥組)]Figure 7 Volume and weight of the transplantation tumors of SPK and control groups [A: Observation of tumor; B: Volume and weight of the transplantation tumors (SPK: Ad-SPK treat group; CON: Ad-null treat group)]
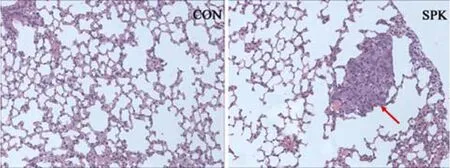
圖 8 裸鼠肺臟 HE 染色(紅色箭頭:轉移灶)Figure 8 Histology of lung sections (HE stain, original magnification ×400; Red-arrow: observed in lung sections of tumor)
3 討論
磷脂代謝產生多種磷脂代謝產物,如神經酰胺、SPK、S1P 等。SPK 是細胞內合成 S1P 的關鍵酶,它可以使 SPK 磷酸化生成 S1P,是細胞增殖及存活的重要信號分子。S1P 在人胃腺癌細胞的增殖中起著極其關鍵的調控作用[20]。在氧化偶氮甲烷(azoxymethane,AOM)誘發的小鼠腸腺癌中,SPK 在 mRNA 水平的表達增高,說明 SPK/S1P信號途徑與結腸癌的發生是密切相關的[21]。
SPK 與肝癌相關報道仍不多見,肝臟是磷脂類代謝的重要器官,SPK/S1P 作為細胞微環境的重要信號途徑之一,其調節肝癌發生發展的作用和機制并不清楚。目前許多研究只停留在體外試驗,還有一些問題需要進一步研究,例如 SPK 與腫瘤的關系,本文就 SPK/S1P 信號通路和肝癌轉移的關系作為研究重點,在體內外研究 SPK 與肝癌轉移是否存在聯系。
在體外實驗中,我們用 Ad-SPK 感染肝癌細胞系 LM-3,使其高表達 SPK,用 Transwell、劃痕實驗檢測肝癌細胞遷移情況。結果顯示,SPK 在肝癌細胞中高表達并不能明顯促進其遷移。但在體內實驗中我們卻發現 Ad-SPK 可以明顯促進肝癌細胞轉移。我們推斷 SPK 可能是通過調控血管發生促進肝癌轉移。動物實驗中首先我們用 Ad-SPK 感染 LM-3 細胞 36 h,收集細胞接種于裸鼠皮下。因為腺病毒 Ad-SPK 不能長期穩定使 SPK 高表達,所以待成瘤后我們于瘤體內多點注射病毒以使其持續 SPK 高表達。實驗終點處死小鼠發現腫瘤周圍血管豐富,腫瘤體積及重量都有明顯區別,但體內轉移并不明顯。之后我們同樣處理的細胞給裸鼠尾靜脈注射。據文獻[22-23]報道,肝癌細胞尾靜脈注射約 5 ~ 6 周發生轉移,鑒于肝癌本身具備高轉移性,本研究中尾靜脈注射小鼠 4 周處死,擬選擇這個時間點是為了使 Ad-null-LM-3 組與Ad-SPK- LM-3 組產生明顯區別。處死小鼠后,將肺部每隔 2 mm 水平剖開查找轉移灶,Ad-null-LM-3 組 6 只小鼠肺部切面正常;Ad-SPK-LM-3組 6 只小鼠中 4 只可見灰白色粟粒狀結節。HE染色后 Ad-null-LM-3 組切片中未明顯轉移灶,但尾靜脈補注 Ad-SPK 組肺部見多處轉移灶。
大量研究表明,VEGF 在肝癌組織中表達較肝硬化和正常肝組織顯著增高[24]。VEGF 高表達有利于原發性肝癌的復發、侵襲和轉移,并且與肝癌的臨床病理特征密切相關。文獻[25]報道,在內皮細胞及膀胱癌細胞中,VEGF 可以通過蛋白激酶 C(protein kinase C,PKC)激活 SPK 信號途徑,表明 SPK/S1P 參與 VEGF 的信號傳導,但 SPK/S1P是否參與調節 VEGF 的表達和其在肝癌細胞信息傳導通路間的相互作用仍不清楚。人肝癌細胞HepG2 能夠合成和分泌 VEGF,而且經不同濃度的 DMS 作用 12 h 后,其 VEGF 的表達較對照組明顯減少。因此,在肝癌細胞中,SPK/S1P 信號途徑是調節 VEGF 信號傳導的重要途徑之一[26-27]。所以我們用 Ad-SPK 感染 HUVEC,發現高表達SPK 可以明顯促進臍靜脈內皮細胞管狀化形成,較未處理的 HUVEC 管狀化密度更大。該結果與體內實驗結果吻合。
在體內研究中,我們通過注射 Ad-SPK 促進其VEGF 表達從而促進腫瘤的生長。SPK/S1P 是維持細胞存活的重要分子,并且參與了肝癌細胞的增殖及腫瘤血管生成的調節過程。
[1]Tanaka M, Katayama F, Kato H, et al.Hepatitis B and C virus infection and hepatocellular carcinoma in China: a review of epidemiology and control measures.J Epidemiol, 2011, 21(6):401-416.
[2]El-Serag HB.Hepatocellular carcinoma: an epidemiologic view.J Clin Gastroenterol, 2002, 35(5 Suppl 2):S72-S78.
[3]Breuhahn K, Longerich T, Schirmacher P.Dysregulation of growth factor signaling in human hepatocellular carcinoma.Oncogene, 2006,25(27):3787-3800.
[4]LaBrecque DR, Pesch LA.Preparation and partial characterization of hepatic regeneration stimulator substance from rat liver.J Physiol,1975, 248(2):273-284.
[5]LaBrecque DR, Steek G, Fogertys, et al.Purification and physical-chemical characterization of hepatic stimulator substance.Hepatology, 1987, 7(1):100-106.
[6]Cuvillier O, Levade T.Sphingosine 1-phosphate antagonizes apoptosis of human leukemia cells by inhibiting release of cytochrome c and Smac/DIABLO from mitochondria.Blood, 2001, 98(9):2828-2836.
[7]Moehler TM, Ho AD, Goldschmidt H, et al.Angiogenesis in hematologic malignancies.Crit Rev Oncol Hematol, 2003, 45(3):227-244.
[8]Bonhoure E, Pchejetski D, Aouali N, et al.Overcoming MDR-associated chemoresistance in HL-60 acute myeloid leukemia cells by targeting sphingosine kinase-1.Leukemia, 2006, 20(1):95-102.
[9]Yabu T, Tomimoto H, Taguchi Y, et al.Thalidomide-induced antiangiogenic action is mediated by ceramide through depletion of VEGF receptors, and is antagonized by sphingosine-1-phosphate.Blood, 2005, 106(1):125-134.
[10]Krump-Konvalinkova V, Yasuda S, Rubic T, et al.Stable knock-down of the sphingosine 1-phosphate receptor S1P1 influences multiple functions of human endothelial cells.Arterioscler Thromb Vasc Biol,2005, 25(3):546-552.
[11]Tarui T, Majumdar M, Miles LA, et al.Plasmin-induced migration of endothelial cells.A potential target for the anti-angiogenic action of angiostatin.J Biol Chem, 2002, 277(37):33564-33570.
[12]Hla T.Signaling and biological actions of sphingosine 1-phosphate.Pharmacol Res, 2003, 47(5):401-407.
[13]Szpaderska AM, DiPietro LA.In vitro matrigel angiogenesis model.Methods Mol Med, 2003, 78:311-315.
[14]Duan HF, Wu CT, Lu Y, et a1.Sphingosine kinase active-tion regulates hepatocyte growth factor induced migration of endothelial cells.Exp Cel Res, 2004, 298(2):593-601.
[15]Shu X, Wu W, Mosteller RD, et al.Sphingosine kinase mediates vascular endothelial growth factor-induced activation of ras and mitogen-activated protein kinases.Mol Cell Biol, 2002, 22(22):7758-7768.
[16]Xin X, Yang S, Ingle G, et al.Hepatocyte growth factor enhances vascular endothelial growth factor-induced angiogenesis in vitro and in vivo.Am J Pathol, 2001, 158(3):1111-1120.
[17]Endo A, Nagashima K, Kurose H, et al.Sphingosine 1-phosphate induces membrane ruffling and increases motility of human umbilical vein endothelial cells via vascular endothelial growth factor receptor and CrkII.J Biol Chem, 2002, 277(26):23747-23754.
[18]Kluk MJ, Colmont C, Wu MT, et al.Platelet-derived growth factor(PDGF)-induced chemotaxis does not require the G protein-coupled receptor S1P1 in murine embryonic fibroblasts and vascular smooth muscle cells.FEBS Lett, 2003, 533(1-3):25-28.
[19]Li QF, Huang WR, Duan HF, et al.Sphingosine kinase-1 mediates BCR/ABL-induced upregulation of Mcl-1 in chronic myeloid leukemia cells.Oncogene, 2007, 26(57):7904-7908.
[20]Li QF, Wu CT, Duan HF, et al.Activation of sphingosine kinase mediates suppressive effect of interleukin-6 on human multiple myeloma cell apoptosis.Br J Haematol, 2007, 138(5):632-639.
[21]Li QF, Wu CT, Guo Q, et al.Sphingosine 1-phosphate induces Mcl-1 upregulation and protects multiple myeloma cells against apoptosis.Biochem Biophys Res Commun, 2008, 371(1):159-162.
[22]Ogawa K, Nakanishi H, Takeshita F, et al.Establishment of rat hepatocellular carcinoma cell lines with differing metastatic potential in nude mice.Int J Cancer, 2001, 91(6):797-802.
[23]Ogawa K, Pitchakarn P, Suzuki S, et al.Silencing of connexin 43 suppresses invasion, migration and lung metastasis of rat hepatocellular carcinoma cells.Cancer Sci, 2012, 103(5):860-867.
[24]Guo Q, Li QF, Liu HJ, et al.Sphingosine kinase 1 gene transfer reduces postoperative peritoneal adhesion in an experimental model.Br J Surg, 2008, 95(2):252-258.
[25]Purdie KJ, Whitley GS, Johnstone AP, et al.Hepatocyte growth factor-induced endothelial cell motility is mediated by the upregulation of inducible nitric oxide synthase expression.Cardiovasc Res, 2002, 54(3):659-668.
[26]Younes MN, Park YW, Yazici YD, et a1.Concomitant inhibition of epidermal growth factor and vascular endothelial growth factor reptor tyrosine kinases reduces growth and metastasis of human salivary adenoid cystic carcinoma in an orthotopic nude mouse model.Mol Cancer Ther, 2006, 5(11):2696-2705.
[27]Hirohashi T, Yamamoto T, Uenishi T, et a1.CD44 and VEGF expression in extrahepatic metastasis of human hepatic carcinoma.Hepatogastroentemlogy, 2004, 51(58):1121-1123.
www.cmbp.net.cn Chin Med Biotechnol, 2012, 7(3):171-177
Sphingosine kinase promote HCC metastasis via regulation of angiogenesis
SAI Yan, DAI Xue-qiang, BAI Ji-min, LIU Yong, CHANG Jing, FAN Li-bin, CUI Chun-ping
ObjectiveTo determine the role of sphingosine kinase (SPK) in hepatocyte carcinoma (HCC) metastasis.
MethodsThe expression and activation of SPK in Ad-SPK infected LM-3 HCC cell line was detected by Western blot; and HCC cells migration was evaluated by Transwell and scar-healing experiments.The impact of SPK on HUVEC tube morphologenesis was examined byin vitrotube formation assay.The SPK-overexpressing nude mice model was established to access HCC metastasisin vivo.
ResultsSPK did not influence significantly HCC cells migrationin vitro; HUVEC tube formation was stimulate by Ad-SPK.Ad-SPK accelerated the tumor growth and metastasisin vivo.
Conclusion Sphingosine kinase promotes the HCC metastasis via regulating angiogenesis.
Disease models, animal; Liver neoplasms; Neoplasm transplantation; Transplantation, heterologous;Sphingosine kinase
s: FAN Li-bin, Email: lfan@ahmu.edu.cn; CUI Chun-ping, Email: cui_chunping2000@yahoo.com.cn
www.cmbp.net.cn 中國醫藥生物技術, 2012, 7(3):171-177
肝細胞癌(hepatocellular carcinoma,HCC)流行性廣、病程短、病死率高,是嚴重危害人類健康的重大疾病。2010年統計數據顯示我國每年約有34.4 萬人死于肝細胞癌,占全球肝癌死亡人數的55%[1]。因此,深入研究肝癌發病機制并開發新的治療策略是關系人類健康的重大科學問題。
肝癌浸潤和轉移特性是影響腫瘤患者生存和預后的關鍵因素,基質膠原纖維的降解、腫瘤細胞的遷移、腫瘤血管形成等過程參與了腫瘤的轉移[2]。在許多腫瘤的發生發展過程中,鞘磷脂的代謝產物神經酰胺(ceramide,Cer)、神經鞘氨醇(sphingosine,Sph)和 1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)發揮著極為重要的作用,它們調節著細胞的增殖、存活和凋亡[3]。在細胞內,這些代謝產物可以相互轉化,鞘氨醇激酶(sphingosine kinase,SPK)則是維系 Cer、Sph 和 S1P 三者間代謝平衡的關鍵酶,具有調節 Cer 和 S1P 的雙重功能。SPK可誘導血管內皮細胞和血管平滑肌細胞等多種與血管生成有關的細胞的生物學反應,通過其表面受體EDGs 依賴的細胞骨架重組維持內皮細胞屏障的
10.3969/cmba.j.issn.1673-713X.2012.03.003
國家自然科學基金(30930041、30800558、81070330);“重大新藥創制”科技重大專項(2012ZX09102301-012)
230032 合肥,安徽醫科大學生命科學院生物學教研室(賽巖、范禮斌);100850 北京,軍事醫學科學院放射與輻射醫學研究所(賽巖、代學強、白紀民、劉勇、常菁、崔春萍)
范禮斌,Email:lfan@ahmu.edu.cn;崔春萍,Email:cui_chunping2000@yahoo.com.cn
2012-02-20完整性[4],促進內皮細胞向血管樣結構的形態轉變等,從而完成血管內皮細胞的增殖和遷移[5]。SPK在多種實體腫瘤中均有表達,如結腸癌、乳腺癌、胃癌、肺癌,其基因具有癌基因的特征,并且通過SPK/S1P 信號途徑對腫瘤發揮著促進細胞生長的作用[6]。本文主要分析鞘氨醇激酶在肝癌轉移中的作用。
Author Affiliations: Biology Laboratory of Life Science Academy, Anhui Medical University, Hefei 230032, China (SAI Yan, FAN Li-bin); Institute of Radiation Medicine, Academy of Military Medical Sciences, Beijing 100850, China (SAI Yan, DAI Xue-qiang,BAI Ji-min, LIU Yong, CHANG Jing, CUI Chun-ping)
·信息站點·

