α-Fe2O3/SiO2納米顆粒混合體系表面的酸堿性質及其對重金屬離子的吸附行為
孫和云 樊佳妮 黃佩佩 孫中溪
(濟南大學化學化工學院,濟南250022)
1 引言
隨著有色金屬工業的迅速發展,工業生產排放的廢水、廢氣、廢渣中的大量重金屬離子對土壤和水體造成了嚴重的污染.這些重金屬離子可通過動植物食物鏈進入人體,且毒性隨著其濃度的增加而增大,當攝入的重金屬離子量超過人體承受限度時就會引發各種疾病.1-4因此與有效治理土壤等的重金屬污染問題相關的課題成為了當前環境科學和工程研究的熱點.5-15
為了準確評價銅、鉛、鋅等金屬離子對環境的潛在危害,我們有必要弄清楚這些金屬離子和土壤及土壤組分之間的相互作用.16-18土壤的主要成分是氧化硅和氧化鋁,但不同地域的土壤因組分不同而顯示不同的化學性能,例如中國江南丘陵為紅色土,其化學成分主要為SiO2、Fe2O3和Al2O3,特點是土壤顯酸性,鐵含量相對較多,且隨著鐵含量的不同,土壤顏色也隨之改變;黃土高原為黃土,主要化學成分是SiO2和Al2O3,其次是Fe2O3和CaO,并含有大量碳酸鹽礦物,特點是鈣含量比其它類型的土壤多,表面聚集石灰質,石膏和鹽類.因此,僅僅研究某一區域天然土壤的酸堿性質及其對重金屬離子的吸附行為,所得到的實驗結果對治理重金屬污染的土壤往往不具有普適性.鑒于天然土壤為多組分體系,且主要組分為SiO2、Fe2O3和Al2O3,而礦物之間存在吸附、離子交換等相互作用,所以單一礦物體系對重金屬離子的吸附規律與天然土壤必定存在一定的差異.因此關于多組分體系對重金屬離子吸附的研究引起我們的研究興趣.本研究組已對γ-Al2O3/α-Fe2O3和γ-Al2O3/SiO2二礦物混合體系及γ-Al2O3/α-Fe2O3/SiO2三礦物混合體系的表面酸堿性質及其對重金屬離子的表面配位平衡常數進行了報道,19-21得出了不同混合體系的酸堿平衡常數,及其對銅、鉛、鋅金屬離子的絡合常數,混合體系的平衡常數不是其單一體系平衡常數的簡單加和等結論.
到目前為止,對于體現紅色土壤主要特點的α-Fe2O3/SiO2混合體系的表面酸堿性質及對重金屬離子吸附反應平衡常數的研究尚未見報道.因此,本實驗以人工合成的納米α-Fe2O3、SiO2為原料,將它們以等比表面積混合,對其混合體系的表面酸堿性質和對金屬離子的吸附行為進行了研究.首次利用WinSGW軟件(瑞典Ume?大學無機化學系開發)依據表面配位理論恒電容模型22-29計算探討了α-Fe2O3/ SiO2混合體系表面酸堿配位常數.同時模擬出了α-Fe2O3/SiO2混合體系吸附重金屬離子Cu2+、Pb2+、Zn2+的配合常數;研究結果對了解重金屬離子在土壤中的分布有重要的意義,進而可為治理重金屬離子的污染提供理論依據.
2 實驗部分
2.1 主要試劑與儀器
實驗用水均為二次蒸餾水,實驗所用的黃原酸鉀由實驗室制備和提純,純度99%以上,其它試劑均為分析純,由國藥集團化學試劑有限公司等國內試劑廠家提供;所得樣品分別用美國Quantachrome公司的NOVA2000e型比表面孔徑分析儀和日本理學公司的D/max-rA型X射線衍射儀進行表征.使用瑞士萬通公司的775 Dosima型電位滴定儀對納米混合體系進行酸堿滴定.使用日本SHIMADZU公司的UV-2450型紫外分光光度計通過測定烷基黃原酸鹽的吸光度來間接確定重金屬離子的吸附量.
2.2 納米α-Fe2O3和納米SiO2的制備
納米α-Fe2O3的制備:20稱取89.0813 g Fe(NO3)3· 9H2O加入到盛有300 mL蒸餾水的三口燒瓶中.用NH3·H2O調節pH為7.9(7.0-8.0之間即可),在攪拌下,逐滴加入氨水80 mL,邊加氨水邊加熱,氨水滴加完畢后,使溶液在60-70°C加熱30 min.離心分離沉淀,除去上清液.于1 L圓底燒瓶中將所得沉淀重新分散于蒸餾水中,調節體積至400 mL,用NH3· H2O調節pH為10.9(11.0-12.0之間即可),在170°C油浴加熱2 h.離心分離沉淀,除去上清液.向所得沉淀中加入無水乙醇,震蕩4 h,離心分離沉淀,反復兩次.將所得沉淀物60°C干燥24 h,540°C煅燒2 h,并將樣品碾磨成粉末狀,轉入稱量瓶中以待用.納米SiO2的制備參見文獻.19
將制備得到的α-Fe2O3和SiO2按照等比表面混合,得到α-Fe2O3/SiO2納米顆粒混合體系.
2.3 樣品的表征
2.3.1 粉末X射線衍射(XRD)
實驗中采用日本理學D/max-rA型旋轉陽極X射線衍射儀測量樣品的晶體結構,測定參數為:Cu Kα,λ=0.154178 nm,靶電壓40 kV,電流50 mA,掃描速率2.4(°)·min-1.
2.3.2 BET表征
采用美國Quantachrome公司的NOVA2000e型比表面孔徑分析儀對樣品的比表面積進行了分析.比表面積(SBET)采用BET(Brunauer-Emmet-Teller)方法來計算,相對壓力范圍為0.05-0.3,并在此范圍內選擇6個數據點進行計算.孔徑分布情況可利用BJH(Barrett-Joyner-Halinda)方法來計算.選擇相對壓力范圍0.05-1.0(飽和蒸汽壓),采用脫附分支的數據來計算,總孔容選擇在相對壓力0.995時的實驗數值.樣品的脫氣溫度為150°C,脫氣時間為16 h.
2.4 α-Fe2O3/SiO2混合體系的酸堿滴定
分別稱取0.0032 g的SiO2和0.1168 g的α-Fe2O3置于100 mL燒杯中,用移液管向燒杯中移入50 mL 0.1 mol·L-1NaNO3溶液,得到固體濃度為2.4 g·L-1的α-Fe2O3/SiO2混合體系懸浮液,磁力攪拌,水化12 h.用標準溶液(pH值分別為4.0,6.9,9.2的鄰苯二甲酸氫鉀,磷酸二氫鉀和硼砂溶液)校準電位滴定儀的pH計電極,在pH 3.0-10.0內,分別用0.04757 mol· L-1的HNO3和0.02946 mol·L-1的NaOH對納米α-Fe2O3/SiO2混合體系和空白0.1 mol·L-1NaNO3溶液進行酸堿滴定,每次滴加酸、堿的體積約為0.1 mL,各滴定點之間的平衡時間為10 min.記錄滴加HNO3溶液和NaOH溶液的體積及其對應的pH值.混合體系滴定參數設定列于表1.
2.5 α-Fe2O3/SiO2體系吸附Cu2+、Pb2+、Zn2+的測定
配制7.728×10-3mol·L-1的Cu(NO3)2,Pb(NO3)2, Zn(NO3)2溶液各100 mL.分別配制2.319×10-3mol· L-1丁基黃原酸鉀(與Cu2+和Pb2+反應)和辛基黃原酸鉀(與Zn2+反應)各250 mL.
在室溫((23±2)°C)條件下,使用Sartorius公司的BS224S型電子天平準確稱取0.0016 g SiO2, 0.0584 gα-Fe2O3于8個50 mL離心管中.在8個25.00 mL容量瓶中加入1.5 mL7.728×10-3mol·L-1的Cu2+,稀釋至刻度,用0.1 mol·L-1的硝酸和0.1 mol·L-1的氫氧化鈉溶液調節酸度使得8個容量瓶的pH值分布在3.0-10.0之間(6.0-8.0之間的點盡量多些),轉入盛有樣品的50 mL離心管中,此時固體濃度為2.4 g·L-1,Cu2+離子的初始濃度為0.4636 mol·L-1.將離心管震蕩3 h,準確測定pH值,離心,取離心后上層清液1.5 mL到25.00 mL容量瓶中,加入1.2 mL 2.319×10-3mol·L-1的丁基黃原酸鉀,定容至刻度,轉入50 mL離心管中,震蕩半小時,離心,取上清液,使用紫外分光光度計在波長為301 nm條件下測黃藥的殘余濃度.空白體系為不加固體吸附劑重復上述實驗步驟進行測定的.
3 實驗結果與討論
3.1 樣品的表征
圖1為所制樣品α-Fe2O3的X射線粉末衍射圖,從圖可看出樣品的衍射峰尖銳,結晶程度良好,在2θ為30.3°、35.7°、62.8°處分別為(104)、(110)、(214)晶面的特征衍射峰,表明制備的Fe2O3是α-Fe2O3.實驗所制納米SiO2為無定形態.
α-Fe2O3的N2吸附-脫附等溫線和孔徑分布曲線見圖2.孔徑分布曲線采用BJH模式處理脫附實驗數據得到.本實驗所用樣品SiO2的比表面積測定見文獻.19已知樣品的BET比表面積,利用經驗公式30S=6/(ρd)可以計算出它們的粒徑大小;其中S為樣品比表面積(m2·g-1),d為樣品直徑(cm),ρ為樣品密度(g·cm-3).α-Fe2O3的密度為5.24 g·cm-3,SiO2的密度為2.32 g·cm-3.根據以上公式可計算出樣品的粒徑.其所測得的樣品BET比表面積和粒徑列于表2,由實驗結果顯示所制備的樣品粒度均小于100 nm,屬于納米顆粒.
3.2 表面酸堿滴定數據處理
以酸滴定固體懸浮液時,滴入的酸溶液與固體表面羥基發生質子化反應,在強酸性環境下可以得到表面帶正電的組分用堿滴定固體懸浮液時,滴入的堿溶液分別與溶液中游離的H+和固體表面吸附的H+反應,即脫質子化反應,可以得到表面帶負電的組分≡XO-.酸堿滴定過程用以下方程式表示:

表1 α-Fe2O3/SiO2混合體系酸堿滴定參數設置Table 1 Titration parameters of α-Fe2O3/SiO2mixed system

圖1 α-Fe2O3的XRD衍射圖Fig.1 XRD pattern of α-Fe2O3
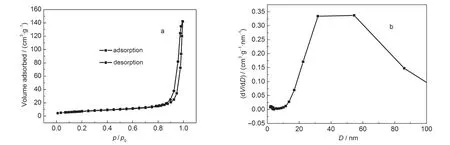
圖2 α-Fe2O3的N2吸附-脫附曲線圖(a)和孔徑(D)分布圖(b)Fig.2 N2adsorption-desorption isotherms(a)and pore size(D)distribution(b)of α-Fe2O3
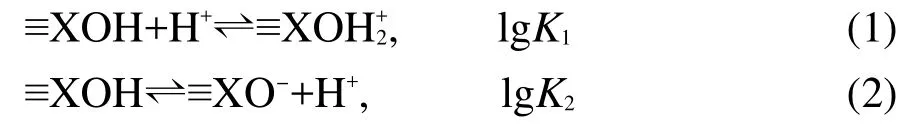
為了研究納米混合體系表面的酸堿緩沖性能,我們定義,滴定過程中每一個滴定點加入酸的總濃度為(Ht),并可通過以下公式計算得到:
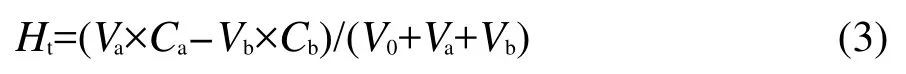
其中Ca、Cb分別為所滴加酸、堿的濃度,V0、Va、Vb分別為初始體積、滴加酸的體積、滴加堿的體積.以Ht值為橫坐標,pH值為縱坐標作圖得到pH-Ht圖見圖3.
從圖3中可看出,空白溶液在pH值為3.0-10.0之間幾乎沒有緩沖作用;而加入α-Fe2O3/SiO2納米混合礦物后,在pH值3.0到6.0范圍內緩沖作用沒有變化,而pH值在6.0到10.0范圍內有較強的緩沖作用.說明納米α-Fe2O3/SiO2混合體系與溶液中的OH-有較強的作用,對H+吸附能力較弱.這說明在溶液中混合體系表面以脫質子反應為主要反應,混合礦物體系的緩沖能力并非單一體系的簡單加和,這與文獻21中報道的結論一致.
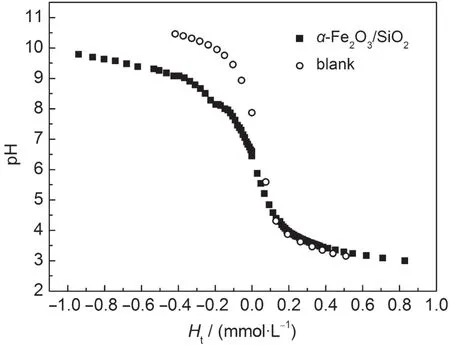
圖3 α-Fe2O3/SiO2混合體系的pH-Ht圖Fig.3 pH value of α-Fe2O3/SiO2systerm as a function of HtHt:the total concentraion
由于表面對H+吸附能力較弱,所以表面羥基位的濃度根據脫質子反應計算,表面脫質子消耗OH-的量為加入的OH-與游離的OH-之差,當表面脫質子反應完全之后,溶液中OH-的量將隨堿的加入線性增加,因此,可以利用線性回歸法由Gran27曲線與X軸的交點值Vsample計算該體系的表面羥基濃度(Hs(mol·L-1)),并由此可以得到α-Fe2O3/SiO2混合體系的表面羥基密度Ds(site·nm-2).Gran函數表示如下:

以Gran函數值為縱坐標,滴加堿的體積為橫坐標,做Gran函數圖見圖4.
Hs表示為:

其中,NA為阿佛加德羅常數,S為體系中固體顆粒的N2吸附-脫附實驗BET比表面積,Cs為懸浮液固體濃度.
從Gran圖可以得到Vsample為0.96 mL,從而可以計算出混合體系的Hs為0.57 mmol·L-1,Ds為2.93 site·nm-2.

表2 樣品的BET比表面積測定結果Table 2 BET specific surface area determination result of the samples
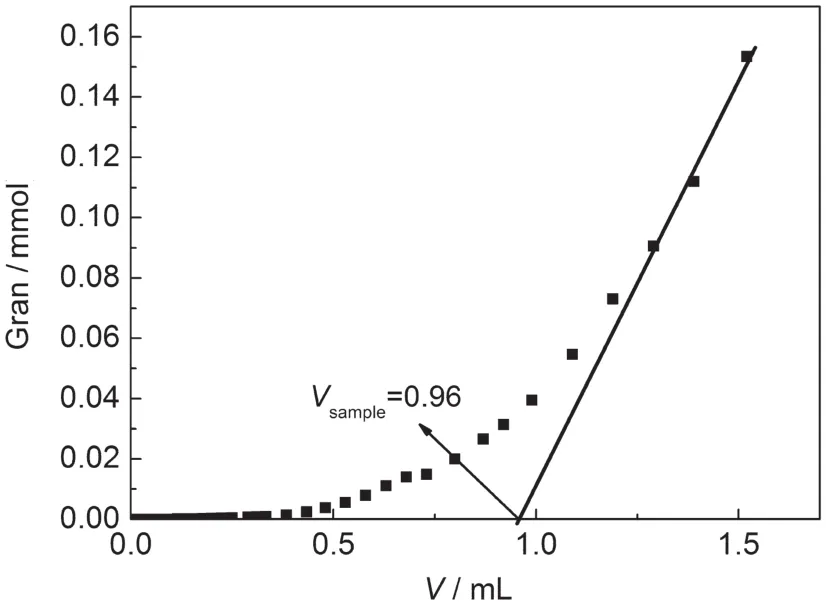
圖4 α-Fe2O3/SiO2混合體系的Gran函數圖Fig.4 Gran function plots of α-Fe2O3/SiO2mixed system
3.3 表面酸堿平衡常數計算
首先在WinSGW計算軟件里以矩陣的方式建立表示表面得失質子反應的模型.對于單表面,脫質子模型為:
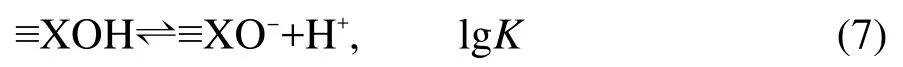
對于雙表面,脫質子模型為:
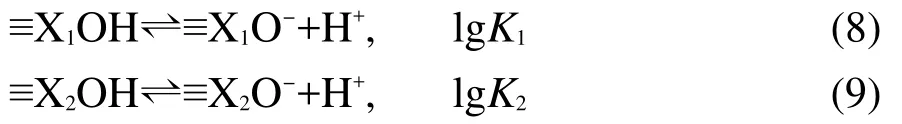
考慮α-Fe2O3、SiO2和空氣中CO2的溶液反應會對表面酸堿反應平衡常數有影響,31所以輸入計算矩陣時也要輸入有關α-Fe2O3、SiO2和CO2的溶液反應平衡常數.將每個滴定點的pH值經計算得到的氫離子的總濃度Ht,表面鍵位點濃度Hs以及固體濃度cs代入WinSGW計算軟件,采用恒電容雙電層模型分別計算α-Fe2O3/SiO2混合體系的單表面和雙表面模型的脫質子平衡常數,模擬α-Fe2O3/SiO2混合體系表面優勢組分分布.計算結果列入表3中.
從表3可看出,與SiO2、α-Fe2O3單一體系相比,不論是雙表面脫質子常數還是單表面脫質子常數,混合體系表面酸堿反應平衡常數與α-Fe2O3表面相應的平衡常數較為接近,而與SiO2差別較大,推測α-Fe2O3/SiO2混合體系中α-Fe2O3表面反應占優勢,因此選取單表面脫質子模型.綜合上述考慮,我們計算出α-Fe2O3/SiO2混合體系最優的脫質子常數為-8.2±0.15,此時的最優電容為24 F·m-2,二氧化碳的濃度為0.03 mmol·L-1,殘差平方和(SSR)為0.2762,擬合度為1.顯然,α-Fe2O3/SiO2混合體系不同于同時具有加質子和脫質子反應的α-Fe2O3/SiO2/ γ-Al2O3,α-Fe2O3/γ-Al2O3和SiO2/γ-Al2O3納米顆粒混合體系.通過實驗結果我們對α-Fe2O3/SiO2混合體系獨特的表面酸堿現象進行了進一步的分析:
對于純α-Fe2O3固體表面的得質子反應如反應式(10)所示:

而對于純固體SiO2表面的脫質子反應29如反應式(11)所示:
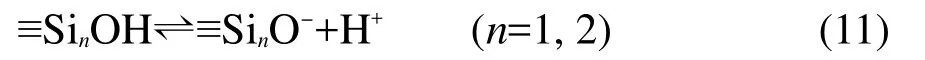
當純α-Fe2O3固體和純SiO2固體混合,表面之間可能會通過形成氫鍵而發生相互作用:
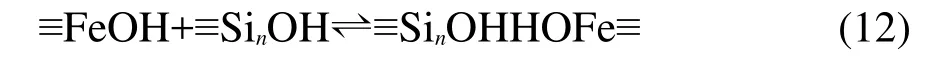
由上述反應式可以解釋為什么α-Fe2O3/SiO2混合體系的表面得質子反應消失且表面脫質子反應更接近于α-Fe2O3固體表面,原因即為混合體系中α-Fe2O3固體表面的得質子位點和SiO2固體表面的脫質子位點相互作用而消耗掉,α-Fe2O3固體表面的脫質子位點在混合體系表面中占主導,因此混合體系表面主要表現出接近于α-Fe2O3固體表面的脫質子反應的特性.
3.4 α-Fe2O3/SiO2納米顆粒混合體系對重金屬離子(Cu2+、Pb2+、Zn2+)的吸附
本文還探討了pH值對α-Fe2O3/SiO2納米顆粒混合體系吸附重金屬離子的影響.
圖5為吸附Cu2+、Pb2+、Zn2+后的殘余濃度與對應pH值的關系圖.從圖中可看出在不同pH值條件下Cu2+、Pb2+、Zn2+在混合體系的吸附行為.在pH值介于5.0-7.3之間時,各離子在α-Fe2O3/SiO2混合體系表面的吸附量隨著pH值的增大而增大,總體看來各個重金屬離子在混合體系表面的吸附能力的大小順序為Cu2+>Pb2+>Zn2+,當pH>7.3時,金屬離子在α-Fe2O3/SiO2混合體系表面的吸附達最大值.
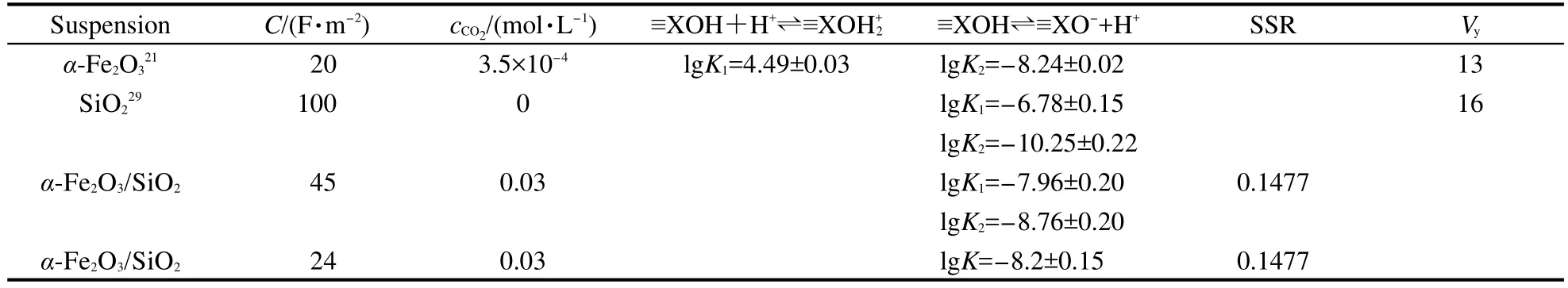
表3 α-Fe2O3/SiO2混合體系表面酸堿平衡常數Table 3 Surface equilibrium constants of α-Fe2O3/SiO2nano-mixed system
將得到的實驗數據經WinSGW軟件計算,得到Cu2+、Pb2+、Zn2+在α-Fe2O3/SiO2納米顆粒混合體系中的表面絡合反應式(13)、(14)和相應平衡常數列于表4中.
表4中計算得出的α-Fe2O3/SiO2體系的兩組表面絡合常數分別基于不同的假設,第一組計算結果是假定固體表面配合物≡XOMOH的生成反應≡XOM++H2O?≡XOMOH+H+平衡常數與溶液反應MOH++H2O?M(OH)2+H+平衡常數相等,20第二組計算結果則是為使實驗值和理論值達到最佳擬合,而在計算中同時優化兩個未知反應平衡常數所得.
由計算得到的表面配位平衡常數模擬出Cu2+、Pb2+、Zn2+在α-Fe2O3/SiO2懸浮液體系固體表面的組分分布如圖6所示.

圖5 不同pH值條件下α-Fe2O3/SiO2納米顆粒混合體系對重金屬離子的吸附Fig.5 Adsorption of heavy metal ions on the surface of α-Fe2O3/SiO2mixed nanoparticle system at different pH values
圖6中的組分分布圖依次對應于表4中的兩組絡合反應平衡常數的計算結果.圖6A為固定反應式(14)的平衡常數而僅僅優化反應式(13)的平衡常數,通過WinSGW計算所得的表面組分分布圖.從圖6A的表面組分分布圖中可以看出,Zn2+的吸附實驗值與理論值擬合情況不甚理想;圖6B是同時優化反應式(13)和(14)的平衡常數,而使模擬值與實驗值達到最佳擬合狀態,通過WinSGW計算所得到的表面優勢組分分布圖.圖中Cu2+、Pb2+、Zn2+的吸附實驗值與理論值較為一致;對應的表面絡合反應及平衡常數分別為≡XOH+M2+?≡XOM++H+,lgK=-3.1, -3.6,-3.8(M=Cu,Pb,Zn).當α-Fe2O3/SiO2納米混合體系中不存在重金屬離子時,固體表面組分有≡XOH、≡XO-兩種形式,各組分相對含量隨pH值變化如圖6B中a所示.≡XOH隨pH值的增大而降低,≡XO-隨pH值的增大而逐漸升高.當pH<8.4時,固體表面組分以≡XOH為主;pH>8.4時,表面組分以≡XO-為主;圖6B中b、c、d為重金屬離子存在時,固體表面組分分布圖.金屬離子在表面的存在狀態以≡XOM+、≡XOMOH(M=Cu,Pb,Zn)表示,在低pH值下≡XOM+、≡XOMOH同時存在.隨著pH的增大≡XOM+水解完全轉變成≡XOMOH,其變化順序為Pb2+>Cu2+>Zn2+.對比圖6A和6B,可以看出金屬離子發生吸附后,圖6B中表面含有金屬離子的優勢組分為≡XOMOH;而圖6A中在中性和弱堿性pH范圍內表面含有金屬離子的優勢組分為≡XOM+.
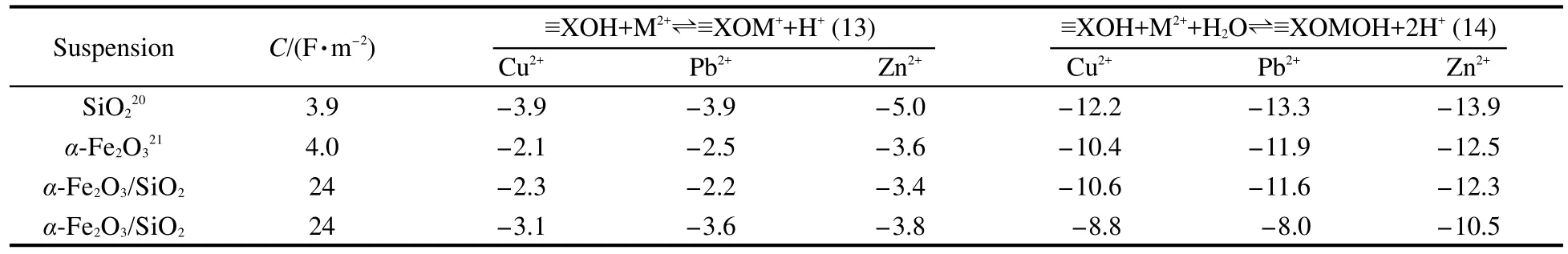
表4 重金屬離子(Cu2+,Pb2+,Zn2+)在α-Fe2O3/SiO2體系固體表面的表面配位平衡常數Table 4 The surface complexation constants of heavy metal ions(Cu2+,Pb2+,Zn2+)on the surface of α-Fe2O3/SiO2mixed system
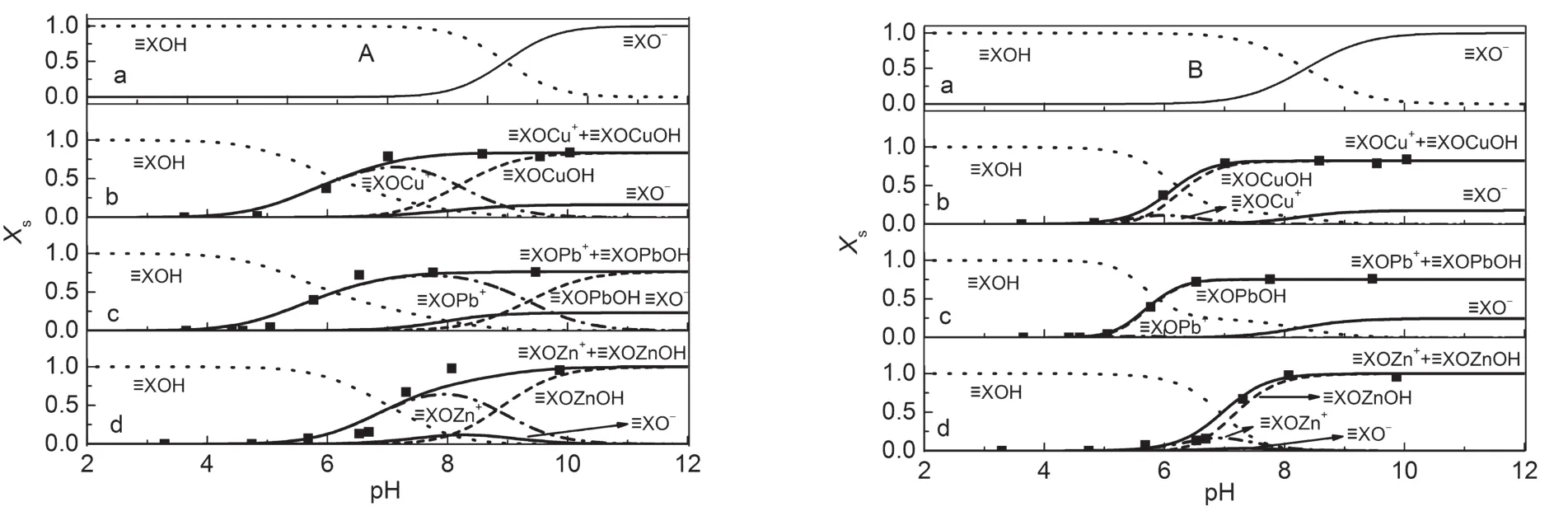
圖6 重金屬離子在α-Fe2O3/SiO2納米混合體系的吸附擬合圖Fig.6 Fitting curves for adsorption of heavy metal ions on the surface of α-Fe2O3/SiO2mixed system(a)without heavy metal ion;(b)Cu2+;(c)Pb2+;(d)Zn2+.The black square dots denote the experimental data,and the surface speciation of≡XOH,≡XO-,XOM+,and≡XOMOH are denoted by the dot line···,B-spline solid line-,B-spline dash dot-·-,and 3 point segment dash dot--·--,respectively.The total fraction of insoluble metal species is expressed as the sum of≡XOM+and≡XOMOH,denoted by the fitting line.Xs:the molar fraction of the surface speciation
4 結論
使用WinSGW軟件基于表面絡合理論恒電容模型計算得出α-Fe2O3/SiO2納米顆粒混合體系表面脫質子反應及平衡常數為:

其主要表現為α-Fe2O3表面的脫質子性質,明顯區別于同時具有加質子和脫質子反應的α-Fe2O3/SiO2/ γ-Al2O3、α-Fe2O3/γ-Al2O3和SiO2/γ-Al2O3納米顆粒混合體系.根據混合體系對重金屬離子的吸附實驗數據及所計算出的酸堿反應平衡常數,模擬得出Cu2+、Pb2+、Zn2+在α-Fe2O3/SiO2納米顆粒混合體系中的表面絡合反應及平衡常數如下:
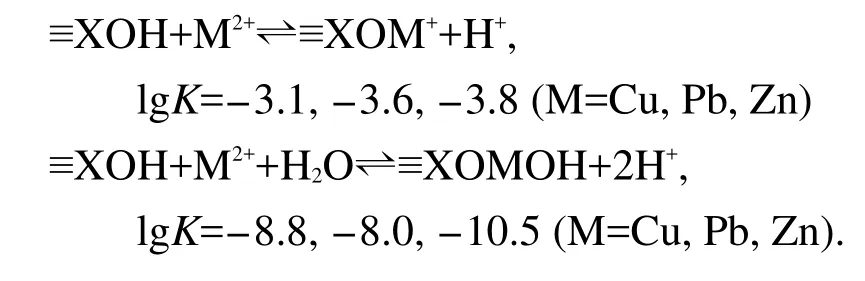
(1) Hashim,M.A.;Mukhopadhyay,S.;Sahu,J.N.;Sengupta,B. Journal of Environmental Management 2011,92,2355.doi: 10.1016/j.jenvman.2011.06.009
(2) Eren,E.;Afsin,B.;Onal,Y.J.Hazard.Mater.2009,161,677. doi:10.1016/j.jhazmat.2008.04.020
(3) Grossl,P.R.;Sparks,D.L.;Ainsworth,C.C.Environ.Sci. Technol.1994,28,1422.doi:10.1021/es00057a008
(4)Yang,H.;Xu,R.;Xue,X.M.;Li,F.T.;Li,G.T.J.Hazard. Mater.2008,152,690.doi:10.1016/j.jhazmat.2007.07.060
(5) Yu,J.;Hao,P.;Bing,L.J.Hazard.Mater.2009,164,1.doi: 10.1016/j.jhazmat.2008.07.107
(6) Chen,Y.H.;Li,F.A.J.Colloid Interface Sci.2010,347,277. doi:10.1016/j.jcis.2010.03.050
(7) Demirbas,A.;Pehlivan,E.;Gode,F.;Altun,T.;Arslan,G. J.Colloid Interface Sci.2005,282,20.doi:10.1016/j.jcis. 2004.08.147
(8) Fan,M.;Boonfueng,T.;Xu,Y.;Axe,L.;Tyson,T.A.J.Colloid Interface Sci.2005,281,39.doi:10.1016/j.jcis.2004.08.050
(9) Batista,A.P.S.;Romeo,L.P.C.;Arguelho,M.L.P.M.;Garcia, C.A.B.;Alves,J.P.H.;Passosa,E.A.;Rosa,A.H.J.Hazard. Mater.2009,163,517.doi:10.1016/j.jhazmat.2008.06.129
(10) Zhong,L.S.;Hu,J.S.;Liang,H.P.;Cao,A.M.;Song,W.G.; Wan,L.J.Adv.Mater.2006,18,2426.doi:10.1002/adma. 200600504
(11) Maryam,A.T.;Toraj,M.J.Hazard.Mater.2011,185,140.doi: 10.1016/j.jhazmat.2010.09.008
(12) Demirbas,E.;Dizge,N.;Sulak,M.T.;Kobya,M.Chem.Eng.J. 2009,148,480.doi:10.1016/j.cej.2008.09.027
(13) Hu,J.S.;Zhong,L.S.;Song,W.G.;Wan,L.J.Adv.Mater. 2008,20,2977.doi:10.1002/adma.200800623
(14) Ijagbemi,C.O.;Baek,M.H.;Kim,D.S.J.Hazard.Mater. 2009,166,538.doi:10.1016/j.jhazmat.2008.11.085
(15) Li,H.;Li,W.;Zhang,Y.J.;Wang,T.S.;Wang,B.;Xu,W.; Jiang,L.;Song,W.G.;Shu,C.Y.;Wang,C.R.J.Mater.Chem. 2011,21,7878.doi:10.1039/c1jm10979k
(16) Lofts,S.;Spurgeon,D.J.;Svendsen,C.;Tipping,E.Environ. Sci.Technol.2004,38,3623.doi:10.1021/es030155h
(17) Reich,T.;Das,S.;Koretsky,C.M.;Lund,T.;Landry,C. Chemical Geology 2010,275,262.doi:10.1016/j.chemgeo. 2010.05.017
(18)Wang,X.T.;Tang,H.X.;Hang,J.L.Chemical Engineer 2001, 82,33. [王向天,湯鴻霄,黃君禮.化學工程師,2001,82,33.] doi:10.1016/S1385-8947(00)00343-0
(19) Huang,P.P.;Sun,H.Y.;Fan,J.N.;Sun,Z.X.Acta Phys.-Chim.Sin.2012,28,1425.[黃佩佩,孫和云,樊佳妮,孫中溪.物理化學學報,2012,28,1425.]doi:10.3866/PKU. WHXB201203091
(20) Liu,J.;Zhang,W.M.;Huang,P.P.;Fan,J.N.;Sun,R.G.;Sun, Z.X.Acta Phys.-Chim.Sin.2011,27,186. [劉 嘉,張衛民,黃佩佩,樊佳妮,孫仁貴,孫中溪.物理化學學報,2011,27, 186.]doi:10.3866/PKU.WHXB20110115
(21) Liu,J.;Zhang,W.M.;Wu,Z.S.;Qin,L.H.;Sun,R.G.;Sun,Z. X.Chinese Journal of Inorganic Chemistry 2010,26,1967. [劉 嘉,張衛民,吳震生,秦利紅,孫仁貴,孫中溪.無機化學學報,2010,26,1967.]
(22) Schindler,P.W.;Kamber,H.R.Chim.Acta 1968,51,1781.doi: 10.1002/hlca.19680510738
(23) Stumm,W.;Huang,C.P.;Jenkins,S.R.Croatica Chemica Acta 1970,42,223.
(24)Brown,G.E.;Henrich,V.E.;Casey,W.H.;Clark,D.L.; Eggleston,C.;Felmy,A.;Goodman,D.W.;Gr?tzel,M.;Maciel, G.;McCarthy,M.I.;Nealson,K.H.;Sverjensky,D.A.;Toney, M.F.;Zachara,J.M.J.Chem.Rev.1999,99,77.doi:10.1021/ cr980011z
(25) Wei,J.F.;Wu,D.Q.Advances in Earth Science 2000,15,90. [魏俊峰,吳大清.地球科學進展,2000,15,90.]doi:10.3321/ j.issn:1001-8166.2000.01.014
(26) Xue,H.T.;Shen,S.F.;Pan,H.B.;Xie,C.H.Journal of Inorganic Materials 2009,24,577.[薛紅濤,沈水發,潘海波,謝長淮.無機材料學報,2009,24,577.]doi:10.3724/SP.J.1077. 2009.00577
(27) Du,Q.;Sun,Z.X.;Forsling,W.;Tang,H.X.J.Colloid Interface Sci.1997,187,232.doi:10.1006/jcis.1996.4676
(28) Wu,Z.S.;Zhang,W.M.;Sun,Z.X.Acta Chimica Sinica 2010, 68,769.[吳震生,張衛民,孫中溪,化學學報,2010,68,769]
(29) Zhang,W.M.;Yang,Z.D.;Liu,J.Acta Phys.-Chim.Sin.2010, 26,2109.[張衛民,楊振東,劉 嘉.物理化學學報,2010,26, 2109.]doi:10.3866/PKU.WHXB20100801
(30)Sun,Z.X.;Su,F.W.;Forsling,W.;Samskog,P.O.J.Colloid Interface Sci.1998,197,151.doi:10.1006/jcis.1997.5239
(31)Al-Hosney,H.A.;Grassian,V.H.J.Am.Chem.Soc.2004,126, 8068.doi:10.1021/ja0490774