橙色大白菜遺傳轉化體系的初步建立
范愛麗,張魯剛
(1.西北農林科技大學園藝學院/旱區作物逆境生物學國家重點實驗室,陜西楊陵,712100;2.廣西農業科學院蔬菜研究所)
橙色大白菜遺傳轉化體系的初步建立
范愛麗1,2,張魯剛1
(1.西北農林科技大學園藝學院/旱區作物逆境生物學國家重點實驗室,陜西楊陵,712100;2.廣西農業科學院蔬菜研究所)
以06J28橙色大白菜子葉段為外植體,通過根癌農桿菌介導CMS7311-orf224基因,探討了潮霉素、頭孢霉素、預培養時間、農桿菌濃度、感菌時間和共培養時間等因素對橙色大白菜遺傳轉化的影響。試驗結果表明,子葉段預培養2~3 d后,在OD600值為0.3~0.5的農桿菌EHA-105菌液中侵染5min,再共培養2~3 d,在培養基中加入5mg/L Hyg(抗性篩選)和500mg/LCef(脫菌)可得到轉化植株。試驗初步建立了橙色大白菜遺傳轉化體系,為大白菜種質資源創新奠定了基礎。
橙色大白菜;CMS7311-orf224基因;遺傳轉化
利用DNA重組技術可使目標基因在不同植物間轉移,突破了遠緣雜交不親和障礙,且保持了受體本身主要性狀不被改變,然而遺傳轉化效率與植物基因型等密切相關。橙色大白菜口感好、營養豐富、抗病毒病等病害,商品性好,是適應性較廣的彩色大白菜新品種[1]。但由于A基因型限制,大白菜在遺傳轉化中存在周期長、轉化頻率低及重復性差等問題,制約了轉基因技術在大白菜育種中的應用[2,3]。本文在已建立的大白菜再生體系的基礎上[4],通過根癌農桿菌介導CMS7311-orf224基因[5],研究潮霉素(Hygromycin B,Hyg)、頭孢霉素(Cefotaxime,Cef)、預培養時間、農桿菌濃度、感菌時間和共培養時間等對橙色大白菜遺傳轉化的影響,初步建立橙色大白菜離體遺傳轉化體系,以期為創新大白菜種質資源和品種改良奠定基礎。
1 材料與方法
1.1 試驗材料
①植物材料、農桿菌菌株和質粒 植物材料為06J28橙色大白菜,取2片綠色子葉展平、第1片真葉未露出(播種5~6 d)的無菌苗;農桿菌菌株為EHA-105;質粒T-DNA區含有CaMV35S啟動子所驅動的Hyg、GUS和CMS7311-orf224基因。
②培養基 無菌苗培養基:MS基本培養基中添加蔗糖30 g/L,瓊脂7 g/L,pH值5.8;預培養培養基:7.0mg/L 6-BA+0.5mg/LNAA;共培養培養基:5.5mg/L 6-BA+0.5mg/LNAA+5mg/LHyg;篩選培養基:5.5mg/L 6-BA+0.5mg/L NAA+5mg/L Hyg+500mg/LCef;生根培養基:1/2 MS+0.5 mg/L NAA+5mg/L Hyg+500mg/L Cef;繼代培養基:MS+500mg/L Cef;LB液體培養基:10 g/LTryptone(胰蛋白胨)+5 g/L Yeast extract(酵母提取物)+10 g/L NaCl,pH值7.0(固體培養基加5%的瓊脂);農桿菌液體培養基:LB+60mg/L Rif(利福平)+ 50mg/L Str(鏈霉素)+50mg/L Kan(卡那霉素),pH值7.2(固體培養基加12.0mg/L的瓊脂)。
1.2 試驗方法
①外植體子葉段的獲得 在無菌條件下,保留大白菜單片子葉,在生長點處(即子葉葉柄基部和下胚軸交接處)先橫切,再縱切去除頂芽,同時切除此子葉頂端的1/3。
②農桿菌菌液的制備 從-80℃超低溫冰箱中取出攜帶質粒CMS7311-orf224基因的EHA-105菌液,在冰上緩慢融化,然后在超凈工作臺上用接種環蘸取少量菌液,在添加Kan 50mg/L、Rif60mg/L和Str50mg/L抗生素的LB固體培養基上劃線;28℃倒置培養48~36 h,菌斑出現后,挑取單菌落接種到含Kan 50mg/L、Rif 60mg/L、Str 50mg/L的LB液體培養基中 (pH值7.2),于28℃、200 r/min振蕩培養過夜。取對數生長期菌液,在4℃、5 000 r/min條件下離心5 min,棄上清液,取沉淀重新懸浮于10倍MS液體培養基中(pH值5.3),振蕩后稀釋不同濃度作為侵染液。
③影響大白菜遺傳轉化主要因素的試驗 A.Hyg選擇壓的確定。a.無菌條件下,將06J28子葉段分別豎直插入Hyg濃度為0,3,5,7,10 mg/L的芽誘導培養基上,觀察不定芽分化對Hyg的敏感性,2周換1次培養基,統計芽分化數情況。b.無菌條件下,將06J28幼苗分別豎直插入Hyg濃度為0,3,5,7,10mg/L的生根培養基上,觀察根系生長對Hyg的敏感性,2周換1次培養基,觀察統計生根情況。
B.Cef抑菌劑濃度對抑菌和芽分化的影響。無菌條件下,06J28子葉段經農桿菌菌液 (OD600值為0.3~0.5)振蕩侵染5 min后,將其取出用無菌濾紙吸干表面的菌液,豎直插入含不同濃度Cef(0,300,400,500,600mg/L)的芽誘導培養基上分化。每隔2周換1次培養基,觀察抑菌情況和芽分化情況,篩選最適的Cef濃度。
C.預培養時間。無菌條件下,將06J28子葉段分別進行 0,1,2,3,4,5,6,7 d的預培養,后投入OD600值為0.3~0.5的菌液中,振蕩侵染5min后,將其取出用無菌濾紙吸干表面的菌液,豎直插入共培養基上培養2 d后,再轉接到芽誘導培養基上分化。每隔2周換1次培養基,統計抗性芽數,分析預培養時間對大白菜遺傳轉化的影響。
D.農桿菌濃度。制備好的菌液分別用MS液稀釋至 OD600值分別為 0,0.1,0.3,0.4,0.5,0.6(OD600值為1時,菌液濃度約為8×108個/mL)。無菌條件下,06J28子葉段經預培養2~3 d后投入OD600值分別為0,0.1,0.3,0.4,0.5,0.6的菌液中振蕩侵染5 min,然后取出用無菌濾紙吸干表面的菌液,豎直插入共培養培養基上培養2 d,再轉接到芽誘導培養基上分化,每隔2周換1次培養基,統計抗性芽數,分析農桿菌濃度對大白菜遺傳轉化的影響。
E.侵染時間。無菌條件下,06J28子葉段經預培養 2~3 d后投入 OD600值為0.3~0.5的菌液中侵染,時間分別為1,5,10,15,20,25,30min,其間不停搖動。將侵染后的外植體取出,用無菌濾紙吸干表面菌液,豎直插入共培養基上培養2 d后,再轉接到芽誘導培養基上分化,每2周換1次培養基,統計抗性芽數,分析侵染時間對大白菜遺傳轉化的影響。
F.共培養時間。無菌條件下,06J28子葉段經預培養2~3 d后投入OD600值為0.3~0.5的菌液中,振蕩侵染5 min后,取出用無菌濾紙吸干表面的菌液,豎直插入培養基,在光下分別共培養0,1,2,3,4,5,6,7 d,然后再轉接到芽誘導培養基上分化,每隔2周換1次培養基,統計抗性芽數,分析共培養時間對大白菜遺傳轉化的影響。
2 結果與分析
2.1 Hyg的敏感濃度篩選
①Hyg濃度對大白菜子葉段不定芽再生的影響 從表1可以看出,Hyg濃度越大,不定芽分化所需時間越長,芽的生長狀況越差。當Hyg濃度低于5mg/L時有不定芽的分化,而當濃度高于7mg/L時無不定芽的分化。因此選擇5mg/L為Hyg對子葉段不定芽誘導的臨界點。
②大白菜幼苗生根的Hyg濃度篩選 從表2可看出,Hyg濃度越大,幼苗生長情況越弱,根系出現的時間越晚。當Hyg濃度為5mg/L時,根系生長受限,植株的生長也受到明顯抑制,故選擇濃度5mg/L為Hyg抑制大白菜幼苗根系生長的臨界濃度。
2.2 Cef抑菌劑對抑菌效果和芽分化的影響
從表 3可以看出,Cef濃度為 300~600 mg/L時,濃度越大抑菌效果越明顯,污染率也越低。當Cef濃度為500mg/L時,得到了最多的抗性芽。試驗中觀察到Cef濃度低于500mg/L時,促進不定芽發生,而Cef濃度超過500mg/L時對不定芽生長有一定抑制。綜合考慮抑菌效果、污染率和獲得的不定芽數認為,Cef最佳抑菌濃度為500mg/L。
2.3 預培養時間對大白菜遺傳轉化的影響
從表4可以看出,未進行預培養的大白菜子葉段有明顯的農桿菌污染,而經1~7 d預培養的大白菜子葉段,隨著預培養時間的延長,子葉段感染農桿菌的污染率顯著降低,然而抗性芽并沒有隨之增加。綜合比較得出,預培養子葉段2~3 d有利于大白菜遺傳轉化。

表1 Hyg濃度對大白菜子葉段不定芽再生的影響

表2 大白菜幼苗生根的Hyg濃度篩選
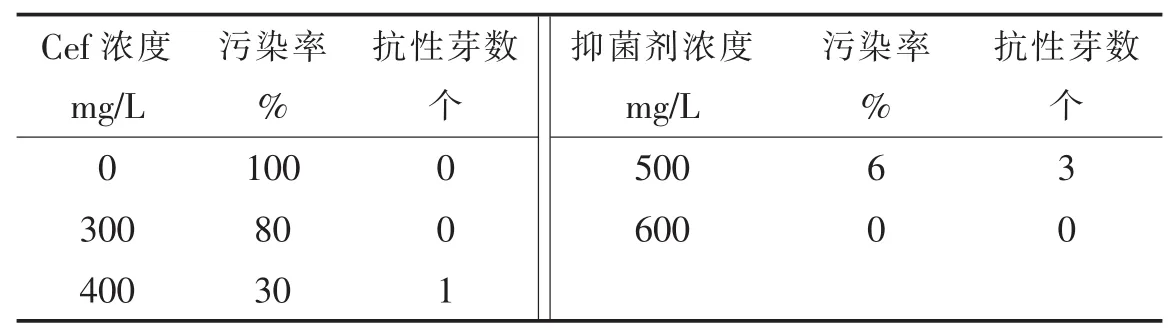
表3 不同Cef濃度的抑菌效果和對芽分化的影響
2.4 農桿菌濃度對大白菜遺傳轉化的影響
表5結果顯示,農桿菌濃度過高或過低都不利于抗性芽再生,當OD600值低于0.1時沒有抗性芽產生,OD600值高于0.7時觀察到子葉段污染加重,傷口褐化,軟腐增多,沒有抗性芽生成。OD600值為0.3~0.5時,農桿菌對大白菜子葉段毒害程度最小,外植體無污染且有抗性芽再生,故最適的OD600值為0.3~0.5。
2.5 感菌時間對大白菜遺傳轉化的影響
從表6可以看出,農桿菌侵染時間短于5min時,子葉段無污染也沒有抗性芽產生;侵染時間為5min時,子葉段無污染且有3個抗性芽產生;當侵染時間為10min時,雖有抗性芽產生,但是外植體有70%污染;侵染時間超過20 min,子葉段全部污染導致死亡。故以5min的侵染效果為最優。
2.6 共培養時間對大白菜遺傳轉化的影響
從表7看出,共培養1~4 d獲到1~3個抗性芽,無污染的情況下共培養時間為2~3 d時抗性芽最多。試驗中觀察到,隨著共培養時間的延長,農桿菌過度生長,外植體受感染和褐化嚴重,再生困難,同時后繼培養中抑菌相當困難。故共培養的最佳時間為2~3 d。

表4 預培養時間對大白菜遺傳轉化的影響
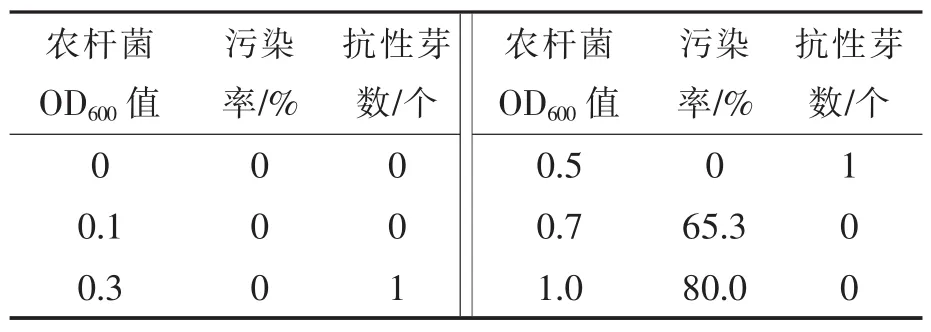
表5 農桿菌濃度對大白菜遺傳轉化的影響

表6 感菌時間對大白菜遺傳轉化的影響
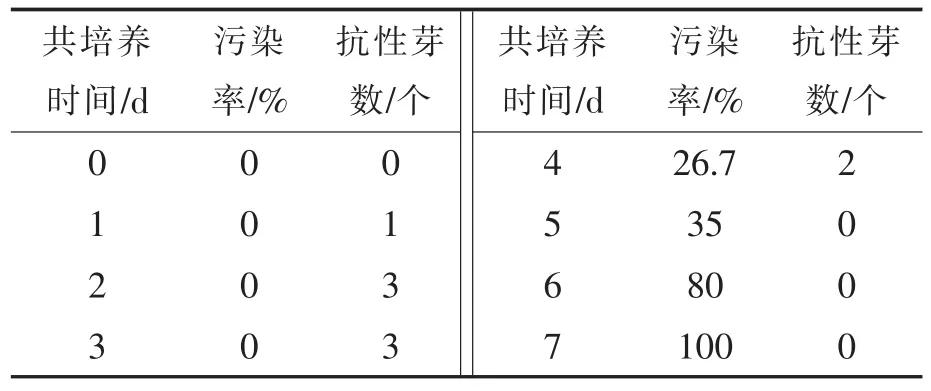
表7 共培養時間對大白菜遺傳轉化的影響
3 小結與討論
合適的選擇壓是植物遺傳轉化成功的關鍵之一。當選擇壓低時,部分未轉化的植物細胞由于產生耐受性而分化成假陽性植株;當選擇壓高時,轉化的植物細胞由于不能承受高選擇壓而同樣被抑制,使轉化效率降低。白菜類中常用的篩選標記有卡那霉素和潮霉素抗性基因。王峰等[6]認為5mg/L卡那霉素可完全抑制大白菜、小白菜及菜心子葉的再生。而余沛濤等[7]用50mg/L卡那霉素篩選轉化后的幼苗,其卡那霉素的選擇濃度是王峰等[6]試驗結果的 10倍。張艷萍等[8]研究得出,卡那霉素濃度為10mg/L時對大白菜轉化體的篩選是有效的,藺忠龍等[9]和楊廣東等[10,11]與張艷萍有相同報道。 楊廣東等[12]采用分級分布篩選研究認為,共培養后先在不含卡那霉素的誘導培養基上恢復生長7~ 10 d,再轉到含5mg/L卡那霉素的篩選培養基上選擇,當抗性芽叢分化后轉到含7.5 mg/L卡那霉素的伸長培養基上,將伸長的單芽切下再轉到含5mg/L卡那霉素的生根培養基上生根,總共得到GP-11轉化苗9株,中白4號轉化苗6株。謝建坤等[13]研究白菜抗蟲基因轉化受體體系時,潮霉素的選擇濃度為20mg/L,獲得了52株抗性苗,其中20%為GUS陽性植株。田志宏等[14]利用1 mg/L潮霉素篩選出魯白六號8株潮霉素抗性苗。張蕊等[15]以5mg/L潮霉素作為大白菜津育60轉化的抗生素篩選濃度。張曉東等[16]認為在篩選培養基中添加10 mg/L潮霉素對大白菜抗性芽的篩選最有效。本試驗篩選的潮霉素濃度為5mg/L,和張蕊等[15]研究結果相同,與其他研究結果有差異[14,16]。從以上研究可以看出,研究者根據植物表達載體上篩選抗性標記基因選擇不同的抗生素,主要有卡那霉素和潮霉素2類抗生素,卡那霉素的濃度選擇范圍為5~50mg/L,潮霉素的濃度選擇范圍為1~20mg/L,總的說來,卡那霉素選擇壓一般比潮霉素高,可能因為大白菜基因型不同以及潮霉素對外源基因表達水平低的芽產生了強的抑制作用。
在農桿菌介導的轉化過程中,為了抑制農桿菌的生長,需要在培養基中加入抗生素。抗生素抑菌的好壞直接影響轉化效率高低,白菜類作物常用的抗生素有氨芐青霉素 (Ampicillin)、 羧芐青霉素(Carbenillin)、頭孢霉素和淡紫青霉素(Lilacillin)等。張鳳蘭[17]認為淡紫青霉素效果較好,她通過研究不同濃度的淡紫青霉素對白菜子葉不定芽的影響,發現白菜不定芽再生幾乎不受淡紫青霉素的影響,但淡紫青霉素在國內較難買到,關于它的應用報道較少。謝建坤等[13]選擇500mg/L羧芐青霉素抑制農桿菌的生長。藺忠龍等[9]得出氨芐青霉素濃度為500mg/L時,大白菜抗性芽產生頻率最高。張蕊等[15]利用卡那霉素抑菌的研究得出,在培養基中加入400 mg/L卡那霉素既可抑制農桿菌的過度生長,又對白菜外植體的出芽率無致命影響。余小林等[18]觀察到,頭孢霉素對白菜和菜心的外植體不定芽的再生有明顯的抑制作用,在抑菌效果相當的情況下,選擇價格便宜、易獲得的氨芐青霉素作為抑菌劑,其適宜濃度為300mg/L。楊廣東等[10,11]認為頭孢霉素濃度為400 mg/L時對抑菌是有效的。本試驗得出,頭孢霉素濃度低于500mg/L時有促進不定芽再生的作用,而試驗得出的頭孢霉素最佳濃度500mg/L比楊廣東等[10,11]的研究結果稍高。總之,不同的研究者采用不同的抗生素進行抑菌,造成試驗結果存在差異的原因可能是不同基因型大白菜對抗生素濃度及類型的敏感性不同。
此外,影響大白菜遺傳轉化的因素還有農桿菌株種類、菌液培養時間、菌液濃度、菌液感染時間、預培養時間、共培養時間等。王火旭等[19]在以根癌農桿菌介導的大白菜轉化研究中得出,子葉預培養2~3 d后,在OD600值為0.3~0.5的工程菌液中侵染2~10min,再共培養2~3 d,大白菜的轉化效率較高。邢德峰等[20]得到大白菜遺傳轉化最佳轉化受體和因素組合是:帶柄子葉侵染菌液OD600值為0.3,在pH值為5.2的MSC培養基中共培養60 h。各因素對抗性芽分化的影響程度依次為:外植體類型>(菌液濃度×共培養pH值)>(菌液濃度×共培養時間);與EHA 105相比,R1000轉化大白菜子葉和下胚軸獲得的抗性芽頻率差異顯著。余小林等[18]試驗得出,LBA4404/pBI355-AMF菌株的感染效率遠高于EHA105/pBI355-AMF。張鳳蘭[17]認為用OD600值為0.8的菌液侵染外植體15min,再在pH值為5.2的共培養基中共培養3 d遺傳轉化效果最佳。田志宏等[14]研究得出,魯白六號子葉的最佳遺傳轉化條件為:農桿菌Hn1301菌液OD600值0.3~0.5,侵染時間10min,共培養2 d。朱常香等[21]認為最佳的預培養時間為2~3 d,共培養時間以2 d為宜。楊廣東等[10]在大白菜遺傳轉化系統優化的研究中認為,OD600值為0.3、侵染時間為5min時,抗性芽產生的頻率較高。楊廣東等[12]將豇豆胰蛋白酶抑制劑基因導入大白菜自交系GP-11和雜交種中白4號中,以預培養1 d的3 d苗齡的大白菜帶柄子葉為外植體,在OD600值為0.5的農桿菌菌液中侵染5min,再在pH值為5.2的共培養基中暗培養2~3 d,得到了大白菜抗性植株。張艷萍等[8]以預培養2 d、苗齡4 d的大白菜不帶柄半子葉為外植體,在OD600值為0.6的菌液中侵染8min,再在pH值為5.8的共培養基中培養2 d,得到了抗性植株。張蕊等[15]的研究結果得出,在OD600值為0.8的菌液中侵染5 min且共培養2 d轉化效果最優。本試驗研究得出,06J28橙色大白菜子葉段預培養和共培養時間均為2~3 d,農桿菌菌液OD600值為0.3~0.5,侵染5min。
總結前人研究結果可得出,預培養和共培養的時間一般不超過3 d;農桿菌菌液OD600值為0.3~0.8;侵染2~15min,最高達15min。總之,農桿菌侵染菌液濃度、侵染時間及培養時間差異較大,不能普遍適用,這可能與大白菜的基因型和根癌農桿菌菌株的種類等有關。
本試驗以06J28橙色大白菜子葉段為外植體,子葉段預培養2~3 d后,在OD600值為0.3~0.5的菌液中侵染5min,再共培養2~3 d,培養基中加入5 mg/L潮霉素 (抗性篩選),500mg/L頭孢霉素 (抑制農桿菌),遺傳轉化效率較高,經檢測初步獲得了轉CMS7311-orf224基因橙色大白菜植株[5],后將對初步檢測的轉基因植株進行Southern雜交和Northern雜交檢測,進一步判斷該目的基因是否整合到橙色大白菜基因組中;同時通過轉基因植株花器官的觀察,驗證細胞質雄性不育系基因在橙色大白菜中的作用,創造新的大白菜不育系種質資源,也為研究細胞質雄性不育機理奠定一定的基礎。
[1]張魯剛,惠麥俠,張明科.彩色大白菜新品種“金冠1號”的選育[J].北方園藝,2005(4):67-68.
[2]尹越,張耀偉,高國棟.根癌農桿菌介導的白菜類作物轉化體系研究進展[J].中國瓜菜,2009(2):28-32.
[3]楊龑,徐碧玉,金志強.蕓薹屬蔬菜作物的遺傳轉化研究進展[J].華南熱帶農業大學學報,2003,9(1):13-18.
[4]范愛麗,張魯剛,武云霞,等.大白菜子葉段高頻再生體系的建立[J].核農學報,2009,23(4):581-586.
[5]范愛麗,張魯剛,惠麥俠,等.大白菜orf224基因植物表達載體的構建及遺傳轉化[J].西北植物學報,2008,28(7):1 296-1 302.
[6]王峰,盧永恩,李漢霞.幾種白菜類蔬菜卡那霉素抗性的研究[J].武漢植物學研究,2006,24(4):377-380.
[7]余沛濤,王煒,何玉科,等.大白菜(Brassica chinensis)的雄性不育基因轉化[J].上海農業學報,2000,16(1):17-19.
[8]張艷萍,陳玉梁,張正英,等.農桿菌介導法將硝酸還原酶基因轉入大白菜的研究[J].安徽農業科學,2009,37(30):14 597-14 599.
[9]藺忠龍,李維薇,白現廣,等.大白菜遺傳轉化體系的建立[J].石河子大學學報:自然科學版,2008,26(4):449-452.
[10]楊廣東,李艷娥,上官曉霞.大白菜遺傳轉化系統優化的研究[C]//中國園藝學會.中國園藝學會第四屆青年學術討論會論文集.哈爾濱:哈爾濱工程大學出版社,2000: 300-304.
[11]楊廣東,朱禎,李燕娥,等.幾種抗生素對大白菜種子發芽及離體子葉再生的影響[J].華北農學報,2002,17(1):55-59.
[12]楊廣東,朱禎,李燕娥,等.大白菜轉修飾豇豆胰蛋白酶抑制劑基因獲得抗蟲植株[J].園藝學報,2002,29(3):224-228.
[13]謝建坤,崔海瑞,舒慶堯,等.白菜抗蟲基因轉化受體體系的建立[J].園藝學報,2001,28(2):175-176.
[14]田志宏,鐘燕華,何勇,等.根瘤農桿菌介導aiiA基因對大白菜的遺傳轉化研究[C]//中國遺傳學會.中國遺傳學會第八次代表大會暨學術討論會論文摘要匯編.重慶:西南大學出版社,(2004-2008):73-75.
[15]張蕊,張愛紅,常安濤,等.大白菜‘津育60’遺傳轉化前后組織培養條件的優化[J].中國農學通報,2011,27(4):165-168.
[16]張曉東,李利斌,宋宜現,等.大白菜高效穩定遺傳轉化體系的建立[J].山東農業科學,2010(2):1-7.
[17]張鳳蘭.白菜根癌農桿菌介導法基因轉化體系的建立[C]//中國園藝學會.蔬菜分子育種研討會論文集.北京:中國農業出版社,2004:22-29.
[18]余小林,曹家樹,許立奎,等.優化白菜類蔬菜遺傳轉化體系的研究[J].浙江大學學報,2005,31(5):529-534.
[19]王火旭,王關林,王曉巖,等.大白菜AB-81高頻再生系統的建立及gusA基因瞬時表達的研究 [J].園藝學報,2001,28(1):74-76.
[20]邢德峰,李新玲,徐香玲,等.農桿菌介導法獲得抗病毒病轉基因大白菜[J].哈爾濱工業大學學報,2006,38(5):793-796.
[21]朱常香,宋云枝,張松,等.抗蕪菁花葉病毒轉基因大白菜的培育[J].植物病理學報,2001,3(31):257-263.
Establishment of Genetic Transformation System for Orange Heading Chinese Cabbage
FAN Aili1,2,ZHANG Lugang1
(1.College ofHorticulture,Northwest A&FUniversity/State Key Laboratory ofCrop Stress Biology for Arid Area,Yangling 712100;2.Vegetable Research Institute,Guangxi Academy ofAgricultural Sciences)
In this study,several factors affecting the transformation rate were studied by Agrobacterium-mediated CMS7311-orf224 gene in 06J28 Chinese cabbage,and these factors included sensitivity of cotyledon segments to hygromycin (Hyg)and Cefotaxime (Cef),pre-culture days,concentrations of Agrobacterium tumefaciens,co-culture days and times of being infected on the optimum culturemedium.The results showed that,resistant plants could be obtained with the conditions as follows:the cotyledon segments of 06J28 Chinese cabbage were pre-cultured for 2-3 days,and then infected with EHA-105 (the OD600value ranged from 0.3 to 0.5)for 5minutes and were co-cultured for 2-3 days,lastly were transformed to screening-culture medium (adding 5 mg/L Hyg and 500 mg/L Cef).A higher efficient genetic transformation system was established for orange Chinese cabbage,which set up a basis for germplasm resources innovation of Chinese cabbage.
Orange heading Chinese cabbage;CMS7311-orf224 gene;Genetic transformation
10.3865/j.issn.1001-3547.2012.18.003
國家科技支撐計劃(2009BADB8B03),陜西省蔬菜產業體系,廣西農業科學院基本科研業務專項項目(2011YZ17),廣西農業科學院博士科研啟動基金項目
范愛麗(1975-),女,博士,助理研究員,主要從事蔬菜育種與生物技術研究,電話:18778043495,E-mail:fanaili@gxaas.net
張魯剛(1963-),男,通信作者,教授,博士生導師,主要從事蔬菜育種與生物技術研究,電話:029-87082131,15091199690,E-mail:lugangzh@163.com
2012-06-12

