大鼠慢性潰瘍性結腸炎模型的建立及操作規范探討*
孫曉萍,侯麗娟,王曉紅,唐 方
(天津醫科大學總醫院中醫科,天津 300052)
大鼠慢性潰瘍性結腸炎模型的建立及操作規范探討*
孫曉萍,侯麗娟,王曉紅,唐 方
(天津醫科大學總醫院中醫科,天津 300052)
[目的]建立大鼠慢性潰瘍性結腸炎(UC)模型,探討建立模型的操作規范。[方法]雄性Wistar大鼠,除正常對照(NC)組,其余大鼠用100mg/kg2,4,6-三硝基苯磺酸(TNBS)/50%乙醇溶液建立潰瘍性結腸炎急性模型,在造模10 d后,當所有模型大鼠便潛血轉為“1+”時,隨機抽取模型大鼠觀察結腸病理組織學改變,剩余模型大鼠隨機分為陽性對照(PC)組、UC組,用5%葡聚糖硫酸鈉(DSS)水溶液或生理鹽水進行致炎誘導結腸炎復發,造模后觀察各組大鼠疾病活動指數(DAI),實驗終點期處死觀察結腸黏膜損傷指數(CMDI)及病理組織學改變。[結果]與正常對照組比較,慢性潰瘍性結腸炎組飲DSS后再次出現結腸炎發作,DAI及CMDI評分明顯增高(P<0.05),而陽性對照組逐漸好轉;病理組織學改變亦有顯著差異。[結論]采用TNBS/乙醇溶液首次致炎,用DSS間斷進行誘導復發,可以模擬UC急性期與緩解期交替發作的特點,病理組織學改變與人類相似。
2,4,6-三硝基苯磺酸;葡聚糖硫酸鈉;慢性潰瘍性結腸炎;動物模型
慢性潰瘍性結腸炎(UC)是一種病因不明的結腸和直腸炎性病變,臨床表現為腹痛腹瀉、黏液膿血便及不同程度的全身癥狀,呈現緩解復發交替出現的發病特點。近年來UC在中國發病總體呈現上升趨勢,建立與之相類似的模型對于深入研究此疾病具有重大意義。目前,有多種用于UC研究的動物模型[1],化學物誘導法如乙酸法、葡聚糖硫酸鈉法、惡唑酮法等,免疫法如2,4,6-三硝基苯磺酸(TNBS)法、二硝基氯苯法等,另還有免疫復合法、特定基因敲除、T細胞移植等模型,這些模型各具優勢,但始終缺少UC緩解復發交替出現的變化。TNBS/乙醇模型以及5%葡聚糖硫酸鈉(DSS)致UC模型以價廉又與人病變相似的優勢成為炎癥性腸病的經典模型被普遍應用,目前認為TNBS模型慢性緩解期持續時間較長,有文獻表明人為反復運用DSS刺激,可誘導大鼠出現類似人類UC急性期與緩解期交替出現的變化,且病變與人類類似[2],采兩者之長聯合應用探索UC慢性模型的建立,將為后續研究提供借鑒。
1 材料和方法
1.1 實驗動物 SPF級雄性Wistar大鼠40只,體質量180~220 g,購自中國醫學科學院,合格證號:SCXK(京)2009-0004。
1.2 主要器材及試劑 5%TNBS(批號:068k5001,美國Sigma公司),D SS(分子量5000,日本光和純藥株式會社,批號:STF2213 REFBMS622),無水乙醇(天津江天化工技術公司),便潛血(OB)試劑(珠海貝索生物技術有限公司),8號導尿管,1mL注射器。
1.3 造模方法
1.3.1 動物分組 將40只大鼠于清潔級動物飼養室適應性飼養3 d后,采用隨機數字表法隨機分為正常對照組10只、模型組30只。
1.3.2 模型制備 1)5%TNBS與50%無水乙醇以體積1∶1配成TNBS/乙醇混合液;DSS用蒸餾水配成5%DSS水溶液。2)大鼠禁食不禁水24 h,稱質量,采用10%水合氯醛以3mL/kg劑量腹腔注射麻醉后,將8號導尿管輕輕插入肛門上端8 cm,以4mL/kg(相當于TNBS 100mg/kg)劑量,用1mL注射器緩慢注入相應體質量比例造模劑,模型組為TNBS,NC組為生理鹽水,再注入0.5mL空氣,倒立5min,仰臥歸籠,保溫燈照射至大鼠蘇醒,自由飲食。實驗第11天時模型大鼠便潛血已轉為“1+”,隨機抽取10只處死取結腸組織進行蘇木—伊紅(HE)染色,剩余模型大鼠隨機分為PC組、UC組,進行誘導復發,UC組以5%DSS水溶液代替飲水自由飲用24 h,NC組及PC組則飲用生理鹽水;實驗第16天時模型大鼠便潛血又轉為“1+”,再予DSS、生理鹽水自由飲用24 h進行第3次致炎,實驗第21天時處死取材。
1.4 觀察指標
1.4.1 疾病活動指數(DAI) 自造模后第1天起,每日觀察大鼠精神狀態、活動、皮毛色澤、體質量、大便性狀及便隱血狀況。按表1進行評分[3-4],見表1。

表1 DAI評分表Tab.1 DAIscore table
1.4.2 結腸黏膜損傷指數(CMDI) 剖取大鼠肛門至盲腸末端的結腸段,清理腸系膜及粘連組織,沿腸系膜縱軸剪開,冰生理鹽水反復沖洗干凈,平鋪于濾紙上,參照文獻[5-6]按表2立即進行肉眼大體黏膜損傷程度評分,見表2。

表2 CMDI評分表Tab.2 CMDIscore table 分
1.4.3 病理組織學觀察 取大鼠結腸病變最明顯處組織一小部分,用4%甲醛溶液固定,常規石蠟包埋切片,HE染色。
1.5 統計方法 應用統計軟件SPSS 18.0處理數據,計量資料采用均數±標準差(±s)進行描述,兩組正態分布計量資料組間比較采用t檢驗,多組正態分布計量資料組間比較采用單因素方差分析,兩組及多組偏態分布計量資料組間比較采用秩和檢驗,P<0.05為有統計學意義。
2 結果
2.1 結腸黏膜損傷指數(CMDI) 結果見表3。
表3 實驗終期CMDI評分比較(±s)Tab.3 Com parison of CMDIscoreat the end of the experimen(t±s) 分
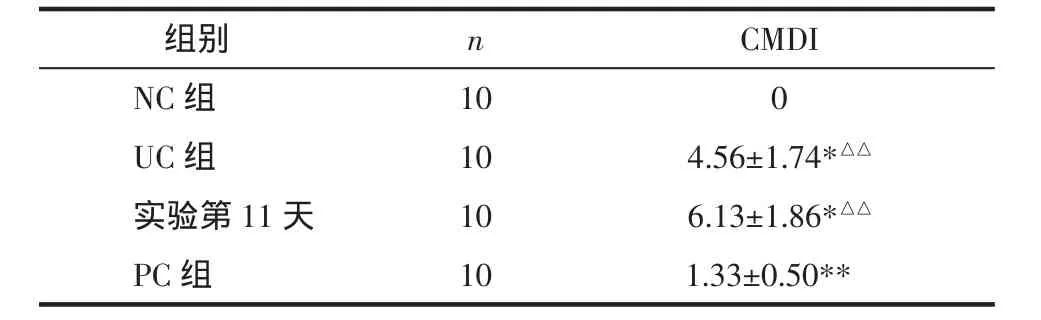
表3 實驗終期CMDI評分比較(±s)Tab.3 Com parison of CMDIscoreat the end of the experimen(t±s) 分
注:與 NC 組比較,*P<0.01,**P<0.05;與 PC 組比較,△△P<0.05。
組別 n CMDI NC組 10 0 UC 組 10 4.56±1.74*△△實驗第 11 天 10 6.13±1.86*△△PC 組 10 1.33±0.50**
2.2 疾病活動指數(DAI) 結果見表4、表5。
表4 TNBS致炎前10 d DAI評分比較(±s)Tab.4 Com parison of DAIscore ofeach group in the first ten days(±s) 分
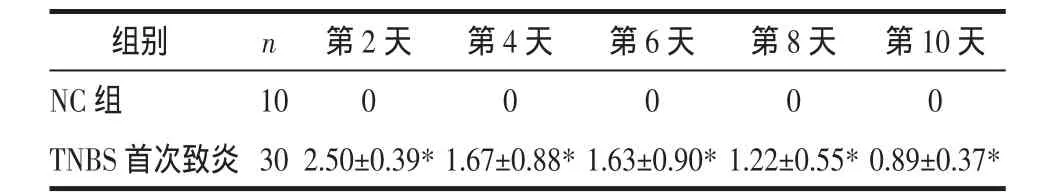
表4 TNBS致炎前10 d DAI評分比較(±s)Tab.4 Com parison of DAIscore ofeach group in the first ten days(±s) 分
注:與NC組比較,*P<0.01。
組別 n 第2天 第4天 第6天 第8天 第10天NC組 10 0 0 0 0 0 TNBS 首次致炎 30 2.50±0.39*1.67±0.88*1.63±0.90*1.22±0.55*0.89±0.37*
2.3 組織病理學觀察(光鏡×100倍) 結果見圖1~圖4。
3 討論
一般情況:應用TNBS造模后,模型大鼠均出現蜷臥少動,被毛松散,肉眼血便或黏液稀便,便次增多,體質量不同程度下降,約1周時間癥狀即有緩解,大便變實,便潛血陽性,體質量回增。誘導復發后,UC組又出現兩次結腸炎發作,以稀薄血便、體質量下降為主要癥狀,復發高峰期在飲DSS當天及飲后1~2 d,PC組狀態良好,體質量繼續增長,便潛血逐漸減輕或轉陰。正常對照組大鼠實驗全程狀態良好,大便正常,體質量增長。
表5 復發致炎后DAI評分比較(±s)Tab.5 Com parison of DAIscore after inflammation recurrence(±s) 分
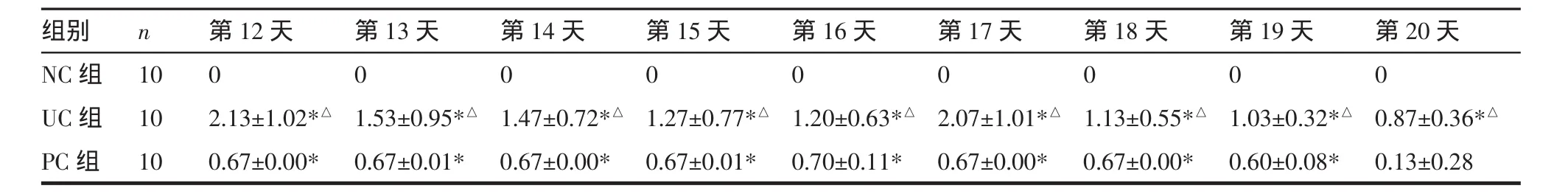
表5 復發致炎后DAI評分比較(±s)Tab.5 Com parison of DAIscore after inflammation recurrence(±s) 分
注:與 NC 組比較,*P<0.01;與 PC 組比較,△P<0.01。
組別 n NC組 10 UC組 10 PC組 10第12天 第13天 第14天 第15天0 0 0 0 2.13±1.02*△ 1.53±0.95*△ 1.47±0.72*△ 1.27±0.77*△0.67±0.00* 0.67±0.01* 0.67±0.00* 0.67±0.01*第16天0 1.20±0.63*△0.70±0.11*第17天 第18天 第19天 第20天0 0 0 0 2.07±1.01*△ 1.13±0.55*△ 1.03±0.32*△ 0.87±0.36*△0.67±0.00* 0.67±0.00* 0.60±0.08* 0.13±0.28
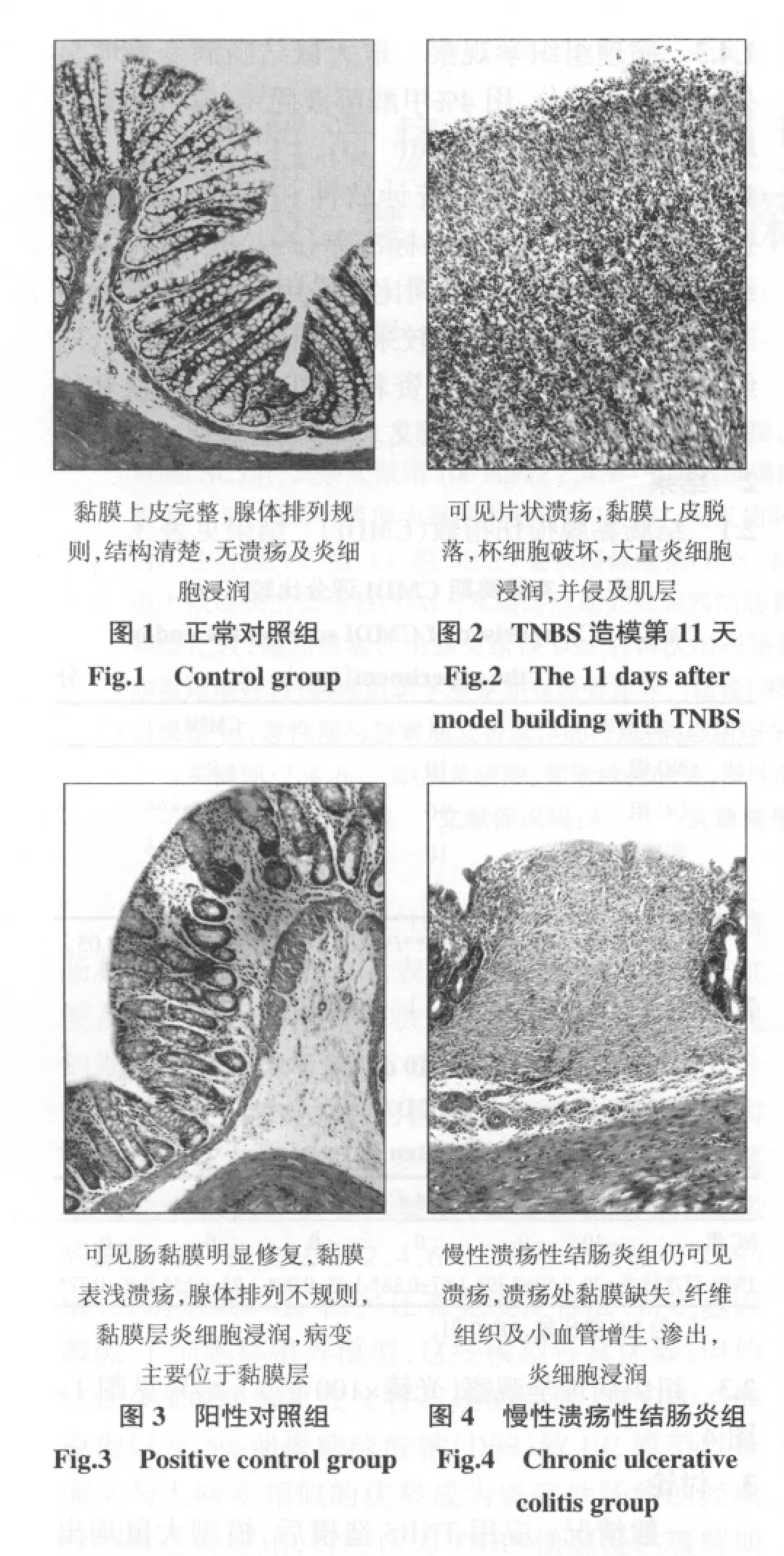
表3 CMDI統計證實UC組大鼠結腸黏膜明顯損傷(P<0.01或 P<0.05),而PC組結腸黏膜損傷趨近恢復,但未恢復到正常水平(P<0.01),仍處于TNBS致炎緩解期,這與目前認為TNBS致UC模型的緩解期持續時間較長一致。光鏡下UC組組織病理與PC組、NC組相比可見潰瘍、瘢痕,潰瘍處黏膜缺失、纖維組織及小血管增生、滲出,炎細胞浸潤,病變以黏膜和黏膜下層為主,而潰瘍和炎細胞浸潤正是評判潰瘍性結腸炎模型成功的主要標準。隔日抽取大鼠DAI評分比較,如表4所示,應用TNBS致炎后模型大鼠DAI評分顯著增高,結合圖2病理表現證實:應用TNBS致炎成功,模型第11天時仍可見潰瘍及炎細胞浸潤。由表5提示,未予DSS刺激,PC組DAI評分逐漸好轉,實驗終期時與NC組相比未見顯著差異,UC組大鼠給予DSS刺激后出現相應的DAI升高(P<0.01)。肉眼觀察大鼠結腸黏膜發現,NC組大鼠色澤淡紅,黏膜皺襞清晰完整,腸壁厚薄適中;TNBS造模第11天時可見糜爛、潰瘍,部分大鼠伴腸粘連;UC組大鼠見潰瘍、瘢痕、肉芽腫,病灶腸壁變厚,部分大鼠有腸粘連;PC組腸黏膜皺襞變淺,無明顯潰瘍。
實驗發現規范實驗各環節操作對于提高成模率十分必要,探討如下。1)DSS間斷給飲標準:正式建模前預實驗證實大鼠每隔1日飲用1次DSS,實驗終期大鼠死亡過半,推測因DSS具有和肝素同樣的抗止血抗凝血作用,可導致嚴重的脫水和肝凝血機制損害,致動物失血過多死亡,其可能死因已被報道過[7];而每隔至少4 d、大鼠便潛血已恢復為“1+”后再給飲則大鼠無死亡。因此,給飲DSS應以便潛血“1+”為度,每次給飲24 h,兩次給飲間隔至少4 d。2)麻醉后保溫:低溫是麻醉常見的并發癥,可導致藥物代謝下降、抗感染能力下降等并發癥。文獻報道麻醉后采取保溫措施能夠縮短麻醉恢復時間,減少各種并發癥的發生,降低麻醉風險[8-9]。實驗在24℃室溫使用水合氯醛常規3mL/kg體質量腹腔注射麻醉,高達10%的麻醉大鼠未蘇醒死亡,采取保溫大鼠可全部蘇醒,提示保溫是降低模型大鼠制備過程中因麻醉而死亡的重要因素,是提高成模率的關鍵環節之一。經此規范,將有效提高成模率。
以上結論表明,單用TNBS 1次致炎,約3周時間大鼠結腸大致愈合,而聯合DSS在TNBS致炎后間斷刺激,能誘導大鼠出現類似人類UC急性期與緩解期交替出現的變化,這是一般UC模型所不具備的。此模型以稀薄血便及體質量下降為主要癥狀,病變主要局限于結腸黏膜及黏膜下層,以潰瘍和炎細胞浸潤為主,與人類UC病變相似。該模型還具有制作簡單,周期短,重復性好的優點,可作為平臺用于深入了解UC的病因、發病機制,有助于藥物在不同時期的介入研究以及中醫中藥辨證論治的探索,能滿足一般模型不能滿足的長期長效實驗觀察,對UC緩解復發的更深入探索研究具有重要價值。
[1]祁向爭,劉 潔.潰瘍性結腸炎動物模型研究進展[J].天津中醫藥大學學報,2010,29(4):220-220.
[2]Osman N,Adawi D,Ahrne S,eta1.Modulation of the effectof dextran sulfate sodium-induced acute colitis by the administration of different probiotic strains of Lactobacillus and Bifidobacterium[J].Dig Dis Sci,2004,49(2):320-327.
[3]Steidler L,HansW,Schotte L,et al.Treatmentofmurine colitis by lactococcus lactis secreting interleukin-10[J].Science,2000,289(5483):1352-1355.
[4]陳 遲,冉志華,蕭樹東,等.普伐他汀對乙酸誘導大鼠結腸炎的治療作用及其機制的研究[J].中華醫學雜志,2006,86(18):1284-1288.
[5]Butzner JD,Parmar R,BellCJ,etal.Butyrateenema therapy stimulatesmucsal repair in experimental colitis in the rat[J].Gut,1996,38(4):568-573.
[6]王 皓,歐陽欽,胡仁偉.三硝基苯磺酸結腸炎動物模型的建立[J].胃腸病學,2001,6(1):7-10.
[7]楊富強,陳光明,吳樂園,等.葡聚糖硫酸鈉誘導動物潰瘍性結腸炎及其機制[J].天津醫藥,2000,28(1):40-42
[8]蔣正英,喻永敏.術中低體溫對實驗動物模型麻醉恢復期的影響[J].臨床合理用藥雜志,2009,2(9):11-12.
[9]嚴國鋒,張 健,周 勇,等.保溫措施對小鼠麻醉效果的影響[J].實驗動物與比較醫學,2008,28(5):70-71.
Reproducing chronic ulcerative colitis in ratsand itsprocedure conform ity
SUNXiao-ping,HOU Li-juan,WANGXiao-hong,TANGFang
(TC M Department,GeneralHospitalof Tianjin MedicalUniversity,Tianjin 300052,Chin a)
[Objective]To reproduce chronic ulcerative colitis(UC)in rats and establish its procedure conformity.[Methods]MaleWistar ratswere random ly divided into normal control group andmodel group.Acute colitiswas induced by rectal administration of2,4,6-trinitrobenzenesulfonic acid solution(TNBS)dissolved in 50%ethanol,100mg/kg.Ten days later,when thestooloccultblood of ratsshowed“1+”,tenmodel ratswere random ly selected and killed to observe colon histologicalchanges;the othermodel ratswere random ly divided into positive(PC)group and(UC)group.The occurrence of colitiswas induced with drinking 5%dextran sulfate sodium(DSS)solution or normal saline.Aftermodeling the disease activity index(DAI)was observed in each group.The colonicmucosal damage index(CMDI)and the histological changeswere assessed et the end on experiment.[Results]Compared with normal group and positive group,DAI and CMDIscores of chronic ulcerative colitis group were significantly increased (P<0.05);the histological changeswere also differed significantly between them.[Conclusion]The chronic ulcerative colitiswas successfully reproduced in rats.Themethod ofusing TNBS/alcohol solution to induce inflammation firstand using DDS to induce its recurrence can imitate the characteristics of replaced onsetof acute and chronic stage in UCgroup.Ithassimilar pathological changes to that in human body.
2,4,6-trinitrobenzenesulfonic acid;dextran sulfatesodium;chronic ulcerative colitis;animalmodel
R574
A
1672-1519(2012)03-0270-04
天津市科技創新專項資金項目(06FZZDSH00405)。
孫曉萍(1986-),女,碩士研究生,主要從事中藥藥理及消化系統疾病研究。
唐 方。
2012-01-05)