貝那普利對糖尿病腎病抗血管緊張素II 1型受體自身抗體陽性患者腎小球濾過率的影響*
趙林雙 譚學瑩 向光大 樂 嶺
糖尿病腎病(Diabetic Nephropathy,DN)是糖尿病最常見腎臟微血管病變,但其早期無任何臨床指征,易被忽視,一旦進入臨床蛋白尿,則病情重、預后差。因此,早期診斷及干預尤其重要。腎小球濾過率(Glomerular Filtration Rate,GFR)是反映腎臟血流動力學的敏感指標,其水平降低可作為DN最早期診斷指標[1,2]。血管緊張素轉換酶抑制劑(ACEⅠ)對腎臟的保護及減少蛋白尿的研究有不少報道[3],但針對抗血管緊張素ⅠⅠ 1型受體自身抗體(Autoantibodies Against AT1Receptor,AT1-AA)陽性患者給予相應受體拮抗劑靶向治療,并監測患者GFR變化尚未見報道。本課題組前期研究業已發現DN患者中GFR降低患者血清AT1-AA陽性率明顯升高,本研究在此基礎上擴大樣本量,檢測血清AT1-AA,并進行GFR測定,進一步探討ACEⅠ藥物貝那普利對AT1-AA陽性DN患者GFR的影響,為DN早期個體化診療提供理論依據。
1 資料與方法
1.1 對象及分組
2001年11月~2007年1月廣州軍區武漢總醫院內分泌科收治的368例DN患者,其診斷納入標準:(1)2周內尿白蛋白排泄率(UAER)>30mg/24h,但1個月內兩次檢測血清肌酐及尿素氮尚在正常范圍,并根據病史確定無其它原因所致腎損害;(2)DN3期(早期腎病,出現微量白蛋白尿);(3)DN 4期(臨床腎病);(4)1個月內未用 ACEⅠ。排除標準:(1)系統性紅斑狼瘡所致腎損害;(2)慢性腎小球腎炎及腎病綜合征;(3)其它內分泌疾病所致的腎損害;(4)藥物性腎損害;(5)5期DN(終末期腎功能衰竭)。UAER<20μg/min(或<30mg/24h)為健康者;UAER 20~200μg/min(30~300mg/24h)為微量白蛋白尿患者;UAER>200μg/min(>300mg/24h)為大量白蛋白尿患者[4]。并根據GFR檢查結果分為GFR異常組(GFR<90ml/min)和GFR正常組(GFR≥90ml/min),比較兩組DN患者 AT1-AA陽性率差異;再將GFR異常組分為AT1-AA陽性組(A1組)和AT1-AA陰性組(A2組),比較治療6個月和12個月后A1、A2組GFR變化。
1.2 AT1-AA檢測
1.2.1 AT1多肽合成:采用多肽自動合成儀(PSSM-8,Shimadzu公司,日本)[4],用固相多肽合成法合成AT1受體多肽,其片段序列經對比文獻[5],確認合成了具有抗原決定簇的人AT1受體細胞外第二環多肽,即AT1受體第165~191位氨基酸殘基片段(序列為 H-T-Ⅰ-H-A-A-Ⅴ-P-P-L-G-AL-T-Ⅴ-Y-A-P-H-T-G-S-G-A-S-T-L),經 高 壓 液 相色譜分析儀分析合成肽純度>95%。
1.2.2 ELⅠSA 檢測 AT1-AA:采集受檢者清晨空腹靜脈血5ml,離心取血清,按照本實驗室建立的方法檢測AT1-AA。以蒸餾水作為空白對照,以健康人血清為陰性對照,受檢者血清與陰性對照吸光度(OD值)之比,即(受檢者OD值-空白對照OD值)/(陰性對照OD值-空白對照OD值)大于2.1判為 AT1-AA 陽性[5,6]。
1.3 GFR檢測
分別于治療前及治療6個月、12個月后測定GFR。采用同位素99mTc-DTPA標記法,顯像儀器為德國西門子公司ECAM型,放化純度>90%,放射性活度為185~370MBq。儀器:SPECT,γ照相機(帶自動處理系統和平行孔準直器)。患者準備:正常進食飲水,顯像前20min再飲水300ml,排尿;測量身高和體重。操作:(1)輸入患者姓名、性別、年齡、身高、體重;(2)γ照相機探頭朝上,將裝有99mTc-DTPA的注射器放在距離探頭中心30cm處,由γ照相機測得放射性強度40~50mCi為注射前計數;(3)探頭置于檢查床下,患者仰臥于檢查床上,使雙腎、輸尿管、膀胱全包入視野內;(4)肘靜脈內 “彈丸”式注入99mTc-DTPA,當肺底顯影時立刻啟動計算機采集圖像,1幀/3s,共20幀,為腎血流圖像,接著1幀/30s,共38幀,為腎功能圖像,連續20min;(5)按照(2)方法計算注射后計數;(6)采用感興趣區域(Region of Ⅰnterest,ROⅠ)編碼技術,根據Gates法計算GFR。GFR<90ml/min為異常。
1.4 其它臨床和實驗室一般性指標檢測
治療前按常規方法對A1、A2兩組患者進行臨床指標和實驗指標檢查。(1)臨床指標包括年齡、性別、病程、體重指數、心率(HR)、收縮壓(SBP)、舒張壓(DBP)等;(2)實驗室指標包括尿素氮、血肌酐、尿微量白蛋白(UMA)、糖化血紅蛋白(HbA1C)、空腹血糖、餐后2h血糖、血脂等。
1.5 藥物治療方法
A1組、A2組治療方法相同,即在常規胰島素降糖治療基礎上加服鹽酸貝那普利片10mg/天(諾華制藥有限公司,批號:x1729,10mg/片)和阿司匹林100mg/天(拜耳制藥有限公司)。其間,對合并冠心病者給予消心痛10mg,3次/天,心率大于90次/min者給予β-受體阻滯劑美托洛爾25mg,2次/天。6個月為一個療程,治療兩個療程。觀察兩組治療一個療程和兩個療程前后GFR的變化。
1.6 統計學處理
應用SPSS 13.0統計軟件。計量數據用均數±標準差(±s)表示,多組比較用方差分析,兩組比較用t檢驗,計數資料用百分率(%)表示,采用χ2檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 GFR正常組及GFR異常組DN患者AT1-AA檢測結果
368例DN患者中,GFR異常者214例,GFR正常者154例。GFR異常組AT1-AA陽性率(54.67%)明顯高于GFR正常組(34.42%),差異有統計學意義(P<0.05)。見表1。
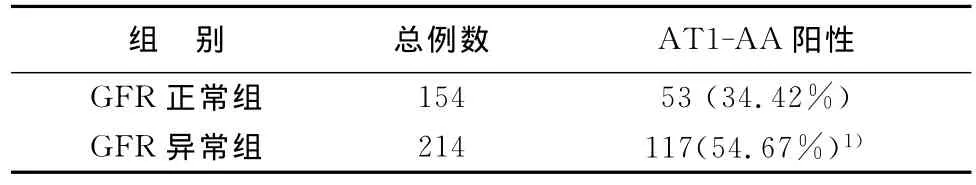
表1 GFR正常組及GFR異常組血清AT1-AA陽性率比較(n,%)
2.2 A1組、A2組臨床和相關實驗室資料比較
A1組SBP低于A2組,UMA高于A2組,差異具有統計學意義(P<0.05),其余指標比較均無統計學差異(P>0.05),見表2。
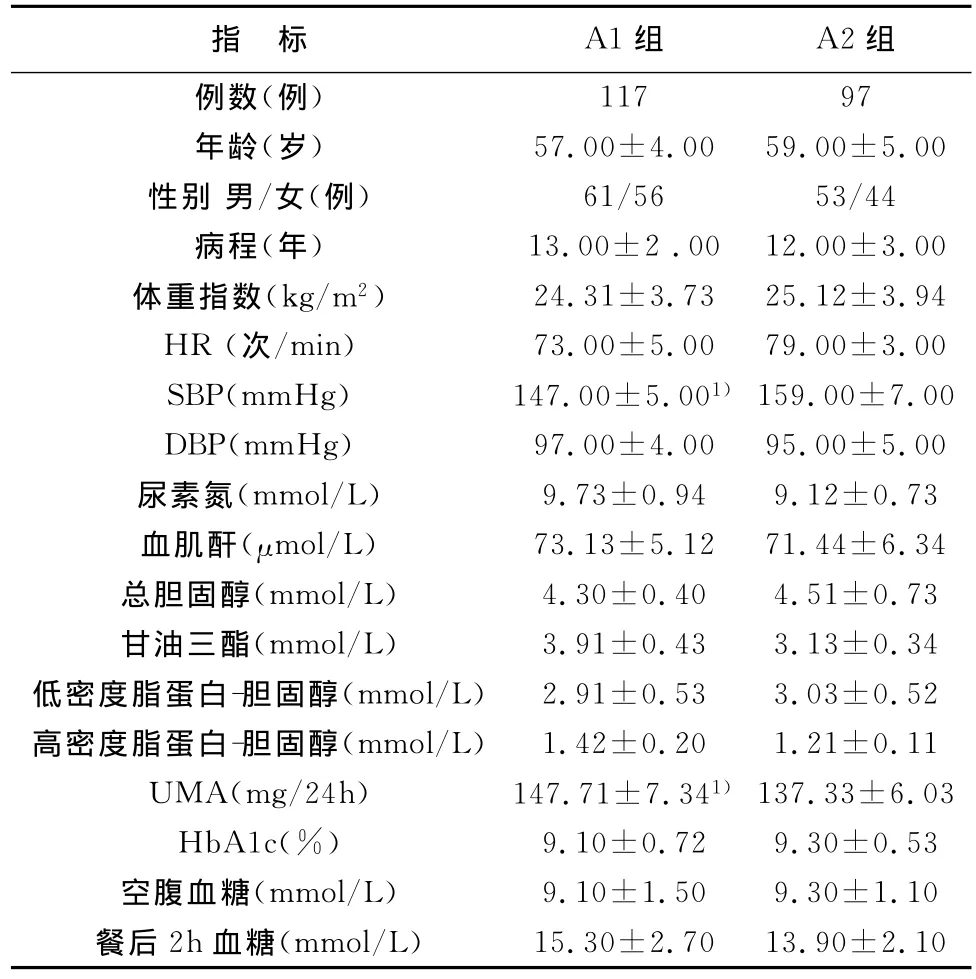
表2 A1組、A2組臨床和實驗室指標比較
2.3 藥物治療后A1、A2組GFR變化
貝那普利等治療一個療程及兩個療程后,A1組GFR的改善效果明顯優于A2組,差異有統計學意義(P<0.01);A1組GFR較治療前明顯改善,差異亦有統計學意義(P<0.01);A2組治療前后GFR改善不明顯(P>0.05)。見表3。
表3 貝那普利等治療后A1、A2組GFR檢測結果比較(±s,ml/min)

表3 貝那普利等治療后A1、A2組GFR檢測結果比較(±s,ml/min)
注:與 A2組比較,1)P<0.01;與治療前比較,2)P<0.01
?
3 討 論
AT1受體屬于G蛋白偶聯受體(G-Protein-Coupled-Receptor,GPCR)超家族,其肽鏈結構七次穿越胞膜并形成胞外三個環肽和胞內三個環肽的空間結構,其中細胞膜外的三個環肽及一個鏈肽結構是信號接受的部位。GPCR的活化途徑之一是在受到刺激后通過內化機制進入胞漿,內化的受體在溶酶體內發生降解、融合,轉移到細胞表面,進而呈遞給相應的免疫細胞。反復的受體刺激是促進其內化、降解,進而誘發自身免疫的重要機制[7],其介導的信號不僅涉及視覺調控,而且參與腎臟功能和調節免疫 應 答[4,8,9]。AT1-AA 具 有 病 理 激 動 劑 樣 活性,能通過相應受體引起病理效應,導致自身免疫反應和相應組織損傷。
核素腎功能動態顯像是一種功能代謝顯像,可觀察腎臟損害程度,能準確、靈敏測定GFR,早期診斷腎小球濾過功能的異常變化。DN的腎臟動力學改變出現在UAER增多之前,GFR下降幅度能直接反映腎小球受損程度[1,2,10,11|,比血肌酐敏感度更高,尤其對于由于肌肉萎縮、內源性肌酐產生下降的老年DN患者,血肌酐并未升高時,GFR已經開始下降。因而是評價腎功能減退早期腎小球濾過功能的敏感指標[12],有助于發現糖尿病患者早期腎功能損害。
本研究結果發現:(1)在DN患者GFR異常組中AT1-AA陽性率達54.67%,明顯高于GFR正常組(P<0.05),表明DN發病可能與AT1-AA有關。(2)進一步觀察貝那普利對GFR異常組AT1-AA陽性患者GFR的影響時發現,AT1-AA陽性組在治療6個月后GFR較治療前和AT1-AA陰性組明顯改善(P<0.01),而AT1-AA陰性組治療12個月后GFR雖有所升高,但與治療前比較仍無統計學意義(P>0.05),說明貝那普利對 AT1-AA陽性患者腎功能有保護作用。AT1-AA對DN腎損害機制及給予受體拮抗劑對GFR影響的可能機制:DN患者腎局部高濃度促血管生成素Ⅱ(AngⅡ)可引起巨噬細胞浸潤、細胞外基質增多以及趨化因子等增加,腎小球內壓增高,內皮細胞損傷,抗原暴露,使DN易感人群產生自身抗體[13,14],抗體可與相關受體特異性結合,產生受體激動樣活性,導致腎組織細胞鈣超負荷,引起腎組織損傷等病理效應,是導致糖尿病腎損害的主要原因之一。因為GPCR結構相對有規律,某一配體對其受體結合專一性很高,這種專一性構成了針對相關疾病特異靶點的藥物治療基礎[9,15,16]。所以根據檢測結果給予相應受體拮抗劑,對腎功能具有良好的保護作用。
總之,DN的防治,不僅需要早期診斷,更重要的是能夠早期針對性靶向治療。而AT1-AA拮抗劑的臨床應用可能是今后的治療方向。 ?

