殼聚糖固定瑞士乳桿菌蛋白酶的條件研究
王翠翠,郭宇星,*,潘道東,2
(1.南京師范大學金陵女子學院,江蘇 南京 210097;2.寧波大學海洋學院,浙江 寧波 315211)
殼聚糖固定瑞士乳桿菌蛋白酶的條件研究
王翠翠1,郭宇星1,*,潘道東1,2
(1.南京師范大學金陵女子學院,江蘇 南京 210097;2.寧波大學海洋學院,浙江 寧波 315211)
以殼聚糖為載體,戊二醛為交聯劑,采用交聯-吸附法對瑞士乳桿菌蛋白酶的固定化條件進行研究。在單因素試驗基礎上,以固定化酶活力為主要指標,研究凝結液、殼聚糖質量濃度、酶用量、交聯時間、戊二醛質量濃度對瑞士乳桿菌蛋白酶固定化的影響。運用響應面對固定化條件進行優化,確定瑞士乳桿菌蛋白酶的最優固定條件:凝結液為4g/100mL NaOH-甲醇(體積比3:1)、殼聚糖質量濃度2.89g/100mL、酶用量2.95mg、交聯時間1h、戊二醛質量濃度0.40g/100mL,此時固定化酶活力為28.67U。
瑞士乳桿菌蛋白酶;固定化;酶活力
近年來研究發現采用某些瑞士乳桿菌(Lactobacillus helveticus)菌株制作的發酵乳有較強的降高血壓功能,主要是因為瑞士乳桿菌的蛋白酶可分解乳蛋白產生多肽,這些多肽對血管緊張素轉移酶(angiotensin I-converting enzyme,ACE)[1]具有抑制作用,從而可降低人體血壓。血管緊張素轉化酶(angiotensin-I converting enzyme,EC3.4.15.1)抑制肽是一類具有抑制ACE活性的肽類物質,這些多肽具有降血壓的功能[2]。在瑞士乳桿菌蛋白酶研究方面,Guo Yuxing[3-4]、Yamamoto[5]、Fang[6]、Coolbear[7]等對細胞壁蛋白酶的純化、反應條件、特異性、生產利用及穩定性等進行了研究。郭宇星等[8]從瑞士乳桿菌ATCC15019發酵乳及其胞內粗提物水解脫脂乳的水解液中分離到具有較強ACE抑制活性和降高血壓功能的活性肽Ile-Pro-Pro (IPP)和Val-Pro-Pro (VPP)。
利用瑞士乳桿菌蛋白酶能水解乳蛋白產生ACE抑制肽,但采用游離瑞士乳桿菌蛋白酶存在以下不足之處:酶解產物與蛋白酶分離困難,增加分離提純成本;蛋白酶穩定性不好,保存不好易失活;蛋白酶不能回收重復利用等。這一系列弊端,會導致ACE抑制肽的生產成本較高,制約ACE抑制肽的大規模生產。所以如果能利用固定化瑞士乳桿菌蛋白酶[9-10]水解乳蛋白,將可以實現ACE抑制肽的大規模生產及工業應用。本研究采用殼聚糖[11]固定化瑞士乳桿菌蛋白酶,并利用響應面法進行固定化條件的優化研究,旨在為ACE抑制肽的大規模生產及工業應用提供基礎研究。
1 材料與方法
1.1 材料與試劑
瑞士乳桿菌15019(Lactobacillus helveticus 15019) 本實驗室保藏菌株;MeOsuc-Arg-Pro-Tyr-pNA (MS-Arg)美國MP Biomedicals公司合成;乙酸、殼聚糖、戊二醛 南京生興生物技術有限公司;其他試劑均購自上海久億化學試劑有限公司。
1.2 儀器與設備
AVY220電子天平 日本Shimadzu公司;YXQ-LS-50SII高壓滅菌鍋 西安常儀儀器設備有限公司;LRH-250A恒溫培養箱 廣東省醫療器械廠;A1301019低溫高速離心機、A1801023恒溫勻速搖床 上海艾測電子科技有限公司;SL-900D超聲波破碎儀 南京順流儀器有限公司;HH-4數顯恒溫水浴鍋、磁力攪拌器 南京智拓儀器儀表有限公司;HI9124N pH測定儀 上海米聯電子科技有限公司;722型可見分光光度計 上海精密科學儀器有限公司。
1.3 方法
1.3.1 瑞士乳桿菌蛋白酶的提取
瑞士乳桿菌菌體凍干粉(ˉ80℃冷藏)接種于MRS培養基,連續活化3代,按3%接種量接種于1L MRS培養基中,37℃擴大培養至生長對數期取出,4℃、4500r/min離心20min收集菌體沉淀。用50mmol/L Tris-HCl(pH7.1)緩沖液洗滌菌體,4℃、4500r/min離心20min,棄上清,重復洗滌3次,收集菌體備用。
采用超聲波破碎法提取:準確稱取菌體2g,用50mmol/L Tris-HCl緩沖液(pH7.1)10mL重新懸浮菌體,攪勻,進行超聲波破碎,超聲波破碎條件為300W、破碎時間3s、間隔時間5s、破碎200次。取破碎液4℃、4500r/min離心20min,取上清液即為粗酶液。
1.3.2 固定化瑞士乳桿菌蛋白酶活力測定
以MeOsuc-Arg-Pro-Tyr-pNA (MS-Arg)為底物,配成16.4mmol/L。取0.05mL底物,1g殼聚糖固定化瑞士乳桿菌蛋白酶小球,2.85mL Tris-HCl緩沖液(50mmol/L,pH7.8)混合,在37℃條件下保溫60min。用0.5mL 30%乙酸終止反應,于4℃、4500r/min離心20min,去除固定化小球后,取上清液在410nm波長處測定吸光度。空白對照管:以蒸餾水代替酶液進行同樣條件的操作。酶活力定義:37℃時,每小時吸光度上升0.01為一個活力單位(U)。
1.3.3 殼聚糖固定瑞士乳桿菌蛋白酶
取一定量殼聚糖溶解于100mL水,攪拌10min,加1mL乙酸,攪拌3h后,4℃條件下過夜。配成一定質量濃度的殼聚糖溶液,然后用注射器分批加入到凝結液中,使凝結成中空球形殼聚糖,靜置3h。取一定量的中空球形殼聚糖,蒸餾水洗滌至中性,放入一定質量濃度的戊二醛水溶液100mL中活化一定時間,再用蒸餾水洗滌至中性,制得經過戊二醛活化的中空球形殼聚糖。分別取一定量的瑞士乳桿菌蛋白酶溶液加入到1g戊二醛活化的中空球形殼聚糖,室溫下攪拌反應,于4℃靜置固定過夜,Tirs-HCl緩沖液(pH7.1)洗滌數次,除去游離蛋白酶,得到固定化蛋白酶[12],按照1.3.2節方法測定固定化瑞士乳桿菌蛋白酶的活力。
1.3.4 殼聚糖固定瑞士乳桿菌蛋白酶單因素試驗條件研究
1.3.4.1 凝結液的影響
在殼聚糖質量濃度2.5g/100mL、戊二醛質量濃度0.4g/100mL、戊二醛交聯時間2h、瑞士乳桿菌蛋白酶用量3mg的條件下,改變凝結液分別為:A液:15g/100mL NaOH-甲醇溶液體積比4:1;B液:4g/100mL NaOH-乙酸乙酯溶液體積比20:1;C液:4g/100mL NaOH-甲醇溶液體積比3:1;D液:20mg/mL三聚磷酸鈉,考察其對固定瑞士乳桿菌蛋白酶的影響,實驗重復3次[13]。
1.3.4.2 戊二醛質量濃度的影響
在凝結液4g/100mL NaOH-甲醇(體積比3:1)、殼聚糖質量濃度2.5g/100mL、戊二醛交聯時間2h、瑞士乳桿菌蛋白酶用量3mg的條件下,改變戊二醛質量濃度分別為0.1、0.2、0.3、0.4、0.5g/100mL,考察其對固定瑞士乳桿菌蛋白酶的影響,實驗重復3次[14]。
1.3.4.3 殼聚糖質量濃度的影響
在凝結液4g/100mL NaOH-甲醇(體積比3:1)、戊二醛質量濃度0.4g/100mL、戊二醛交聯時間2h、瑞士乳桿菌蛋白酶用量3mg的條件下,分別取殼聚糖1.5、2、2.5、3、3.5g,配成質量濃度1.5、2、2.5、3、3.5g/100mL 5種質量濃度的殼聚糖溶液制備殼聚糖小球,考察其對固定瑞士乳桿菌蛋白酶的影響,實驗重復3次[15]。
1.3.4.4 戊二醛交聯時間的影響
在凝結液4g/100mL NaOH-甲醇(體積比3:1)、殼聚糖質量濃度2.5g/100mL、戊二醛質量濃度0.4g/100mL、瑞士乳桿菌蛋白酶用量3mg的條件下,改變戊二醛交聯時間分別為1、2、3、4、5h,考察其對固定瑞士乳桿菌蛋白酶的影響,實驗重復3次[16]。
1.3.4.5 酶用量的影響
采用考馬斯亮藍法測瑞士乳桿菌蛋白酶液的蛋白含量,經計算每個反應中加入相應的酶量,使酶用量分別為1、2、3、4、5mg,在凝結液4g/100mL NaOH-甲醇(體積比3:1)、殼聚糖質量濃度2.5g/100mL、戊二醛質量濃度0.4g/100mL、戊二醛交聯時間2h的條件下,考察酶用量對固定瑞士乳桿菌蛋白酶的影響,實驗重復3次[17]。
1.3.5 殼聚糖固定瑞士乳桿菌蛋白酶響應面分析試驗
根據單因素試驗結果,采用響應面設計試驗,運用Box-Behnken的中心組合試驗設計原理。以殼聚糖質量濃度(X1)、酶用量(X2)、交聯時間(X3)、戊二醛質量濃度(X4)為變量,展開四因素三水平的響應面試驗,試驗設計見表1。采用Design-Expert 7.1.3進行方差分析以評價模型的統計意義。

表1 Box-Behnken設計試驗Table 1 Coded values and corresponding real values of the optimization parameters tested in Box-Behnken experimental design
2 結果與分析
2.1 殼聚糖凝結液的確定
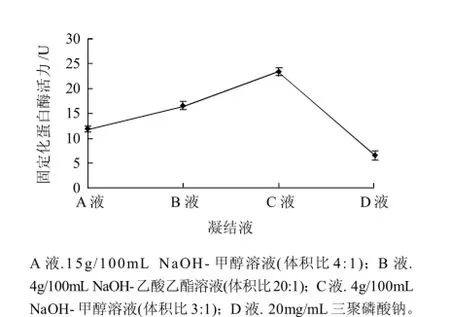
圖1 不同凝結液對固定化蛋白酶活力的影響Fig.1 Effect of condensate on the activity of immobilized enzyme
15g/100mL NaOH-甲醇溶液(A液):小球成型速度一般,呈規則小球狀,微透明純白色,加戊二醛交聯后呈淺黃色;4g/100mL NaOH-乙酸乙酯溶液(B液):小球成型速度較慢,易黏連,呈微透明純白色,加戊二醛交聯后呈微黃色。4g/100mL NaOH-甲醇溶液(C液):小球成型速度很快,呈規則小球狀,微透明純白色,加戊二醛交聯后呈淺黃色;20mg/mL三聚磷酸鈉(D液):小球成型速度一般,呈規則小球狀,不透明純白色,加戊二醛交聯后呈淺褐色,易碎。由圖1可知,以4g/100mL NaOH-甲醇溶液(體積比3:1)為殼聚糖凝結液時,固定化蛋白酶的活性最高;從小球凝結狀態看出,此條件下小球成型速度很快,呈規則小球狀。因此,兼顧固定化蛋白酶活性以及殼聚糖凝結小球的狀態,選取4g/100mL NaOH-甲醇溶液(3:1)為殼聚糖小球凝結液。
2.2 戊二醛質量濃度的確定
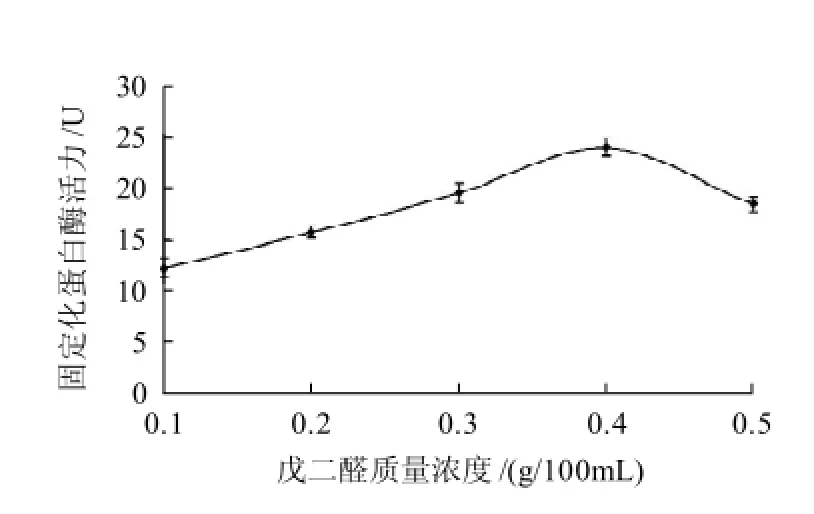
圖2 戊二醛質量濃度對固定化蛋白酶活力的影響Fig.2 Effect of glutaraldehyde concentration on the activity of immobilized enzyme
由圖2可知,當戊二醛質量濃度低于0.4g/100mL,隨著戊二醛質量濃度的增加,固定化酶活性增加,當戊二醛質量濃度高于0.4g/100mL時,固定化酶活性逐漸減小;當戊二醛質量濃度在0.4g/100mL時,固定化酶活性最高。隨著戊二醛質量濃度的緩慢增加,殼聚糖分子中被活化的氨基數量不斷增多,大量的酶蛋白被固定到殼聚糖微球上,使得固定化蛋白酶的活性不斷增大;當戊二醛質量濃度達到0.4g/100mL時,足以使殼聚糖分子上及酶蛋白上的氨基充分交聯,固定化蛋白酶活性達到最大值;但隨著戊二醛質量濃度的進一步增大,戊二醛對酶蛋白的變性作用增強,導致酶蛋白變性失活,使固定化蛋白酶活性降低。因此要得到較好的固定化效果,必須控制戊二醛質量濃度適當,本實驗確定其質量濃度為0.4g/100mL。
2.3 殼聚糖質量濃度的確定
小球狀態:1.5g/100mL殼聚糖溶液,溶液較稀,小球呈半透明白色,顏色很淡;2g/100mL殼聚糖溶液,溶液稀薄度適中,小球呈微透明白色,顏色適中;2.5g/100mL殼聚糖溶液,溶液稀薄度適中,小球呈不透明白色;3g/100mL殼聚糖溶液,溶液較濃,小球呈不透明白色,溶液濃度較高,較難形成小球形狀;3.5g/100mL殼聚糖溶液,溶液很濃,小球呈不透明白色,溶液質量濃度很高,幾乎無法形成小球。
由圖3可知,當殼聚糖質量濃度為2g/100mL時,固定化蛋白酶的活性最高;從小球狀態可以看出,使用2g/100mL殼聚糖溶液時,凝結小球易成型。因此,兼顧固定化蛋白酶活性與小球的凝結狀態,選取質量濃度為2g/100mL的殼聚糖溶液制作固定化小球。

圖3 殼聚糖質量濃度對固定化蛋白酶活力的影響Fig.3 Effect of chitosan concentration on the activity of immobilized enzyme
2.4 戊二醛交聯時間的影響

圖4 戊二醛交聯時間對固定化蛋白酶活力的影響Fig.4 Effect of cross-linking time on the activity of immobilized enzyme
由圖4可知,隨著交聯時間的延長,固定化蛋白酶活性由小變大,當交聯時間為3h,固定化蛋白酶活性最大,達到24.7U。3h后,隨著交聯時間的不斷延長,固定化蛋白酶活性有所下降,但趨于平緩。隨著交聯時間的延長,戊二醛與殼聚糖二者的交聯反應逐漸達到平衡,載體上的酶蛋白結合位點也不斷被飽和,當交聯時間進一步增加時,固定到載體上的酶蛋白的量基本恒定。因此合理控制交聯時間也比較重要,本實驗最終確定交聯時間3h為宜。
2.5 酶用量的影響

圖5 酶用量對固定化蛋白酶活力的影響Fig.5 Effect of proteinase amount on the activity of immobilized enzyme
載體上偶聯的酶量直接影響著固定化酶的活力,由圖5可知,開始隨著酶用量值的升高,固定化酶的活力增加,但酶用量3mg時,固定化酶活力達到最大值,之后酶活力曲線隨著酶使用量的升高而呈平緩趨勢,這是因為戊二醛交聯后的殼聚糖載體與酶結合的醛基數量是一定的。在本研究中,酶用量值為3mg時,固定化酶活力最大是25.6U。
2.6 響應面試驗分析
根據單因素試驗結果,以殼聚糖質量濃度、酶用量、交聯時間、戊二醛質量濃度為變量,展開四因素三水平的響應面試驗,試驗結果見表2。

表2 Box-Behnken試驗設計及其結果Table 2 Box-Behnken experimental design and results
殼聚糖固定瑞士乳桿菌蛋白酶的條件優化根據Box-Behnken響應面分析設計進行了29組試驗, 5組為中心點重復試驗(表2)。利用Design-Expert 7.1.3軟件對固定化酶活力(Y)進行多元回歸擬合,得到未編碼二次多項式擬合方程為:Y=30.16ˉ0.3583X1ˉ0.7167X2ˉ2.7417X3ˉ 0.2667X4+2.35X1X2ˉ0.675X1X3+1.65X2X3ˉ2.05X2X4+ 0.75X3X4ˉ4.855X12ˉ4.0425X22ˉ1.58X32ˉ6.4675X42。

表3 固定化酶活性的二次多項模型方差分析表Table 3 Variance analysis for the fitted quadratic polynomial model for the activity of immobilized enzyme
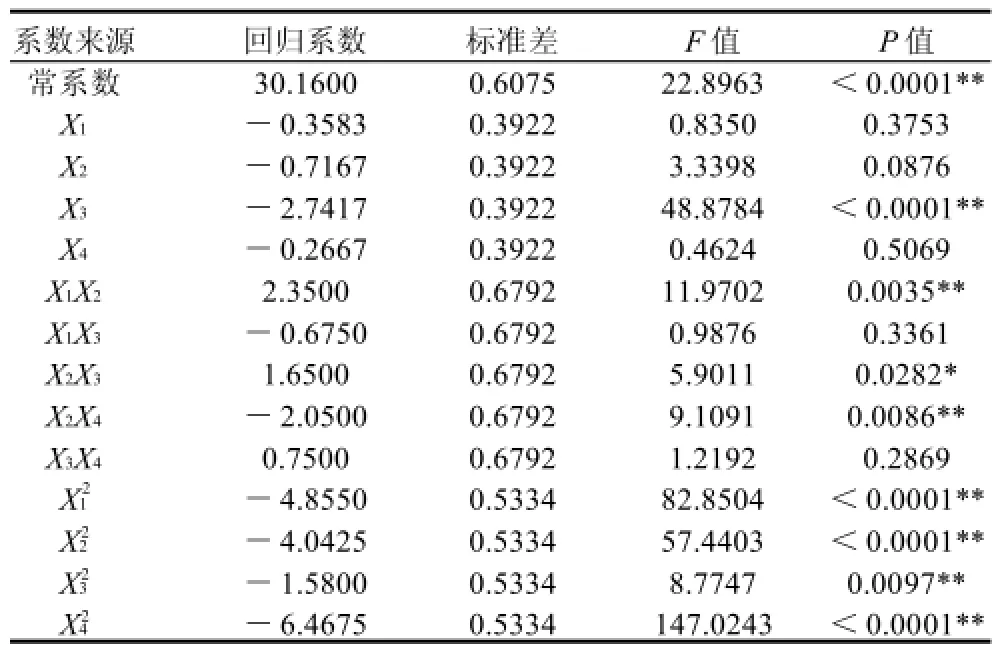
表4 固定化酶活力的回歸方程系數顯著性檢驗Table 4 Significance test of each regression coefficient in the fitted quadratic polynomial model for the activity of immobilized enzyme

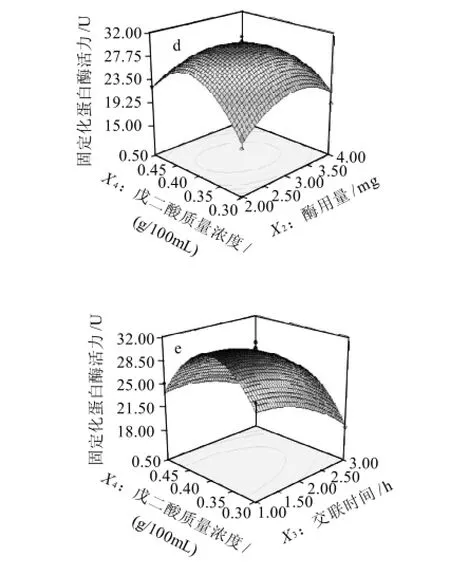
圖6 不同變量對固定化酶活力的響應曲面圖Fig.6 Response surface plots for the effects of different variables on the activity of immobilized enzyme
從該模型的表3方差分析可見,本實驗所選用的二次多項模型具有較高的顯著性。其中R2Adj=0.9104,失擬項P=0.1534<0.05,說明二次多項式回歸模型正確,回歸效果較好。用該模型對固定化蛋白酶的條件進行優化是合適的。由表4可知,交聯時間(X3)的P值小于0.01,說明其對固定化酶活力的影響最為顯著,影響固定化蛋白酶活性的因素為交聯時間(X3)>酶用量(X2)>殼聚糖質量濃度(X1)>戊二醛質量濃度(X4)。X1、X2和X4的二次項P值小于0.01,可以看出這3個因素對響應值的影響不是簡單的線性關系,而是二次拋物線的關系,從圖6可以看出響應面曲面彎曲,說明響應面的變化較為復雜。方程中交互項X1X2、X2X3、X2X4回歸系數顯著性較高,說明X1與X2,X2與X3,X2與X4交互影響顯著,正符合圖6中曲面彎曲較明顯。運用Design Expert 7.13得出殼聚糖固定化瑞士乳桿菌蛋白酶活力的最佳條件為:殼聚糖質量濃度2.89g/100mL、酶用量2.95mg、交聯時間1h、戊二醛質量濃度0.40g/100mL,此時固定化酶活力為28.67U。
2.7 驗證實驗
根據Box-Behnken試驗所得的結果和二次多項回歸方程,利用Design Expert 7.1.3軟件獲得了各個因素的最佳水解條件組合為殼聚糖質量濃度2.89g/100mL、酶用量2.95mg、交聯時間1h、戊二醛質量濃度0.40g/100mL,此時固定化酶活力為28.67U。為了檢驗模型預測的準確性,選取殼聚糖質量濃度2.8g/100mL、酶用量3mg、交聯時間1h、戊二醛質量濃度0.40g/100mL,做3組平行實驗,固定化酶活力可達(28.40±0.67)U,所得結果與最佳條件下所得的結果誤差均在±1%以內,由此可見,采用響應面分析法對瑞士乳桿菌蛋白酶的固定化條件的進行優化是可行的。
3 結 論
本實驗利用殼聚糖固定化瑞士乳桿菌蛋白酶,通過單因素分析和響應面試驗設計,確定了瑞士乳桿菌蛋白酶的固定條件:凝結液NaOH-甲醇(體積比3:1) 4g/100mL、殼聚糖質量濃度2.89g/100mL、酶用量2.95mg、交聯時間1h、戊二醛質量濃度0.40g/100mL。本實驗確定了殼聚糖固定化瑞士乳桿菌蛋白酶的固定化條件,為進一步實現ACE抑制肽的大規模生產及工業應用提供了參考。
[1]YAMAMOTO N, TAKANO T. Antihypertensive peptides derived from milk proteins[J]. Molecular Nutrition and Food Research, 1999, 43(3): 159-164.
[2]吳正鈞, 葉錦, 郭本恒. 乳酸菌的抗高血壓作用[J]. 乳業科學與技術, 2004(1): 1-8.
[3]GUO Yuxing, PAN Daodong, ZENG Xiaoqun, et al. Purification and characterization of CEP from Lactococcus lactis ssp. lactis[J]. Food Chemistry, 2009, 112(3): 533-538.
[4]GUO Yuxing, PAN Daodong, TANOKURA M. Optimisation of hydrolysis conditions for the production of the angiotensin-I-converting enzyme (ACE) inhibitory peptides from whey protein using response surface methodology[J]. Food Chemistry, 2009, 114: 328-333.
[5]YAMAMOTO N, AKINO A, TAKANO T. Purification and specificity of a cell-wall associated proteinase from Lactobacillus helveticus CP790 [J]. Journal of Biochemistry, 1993, 114(5): 740-745.
[6]FANG Gang, BERT P. Production and utilization of peptides in Lactococcus lactis[J]. Molecular Microbiology, 1998, 27: 1107-1118.
[7]COOLBEAR T, REID J R, PRITCHARD G G. Stability and specificity of the cell wall-associated proteinase from Lactococcus lactis subsp. cremoris H2 released by treatment with lysozyme in the presence of the calcium ions[J]. American Society for Microbiology, 1992, 58(10): 3263-3270.
[8]郭宇星, 潘道東. 瑞士乳桿菌細胞壁蛋白酶提取研究[J]. 食品科學, 2007, 28(10): 421-424.
[9]劉崢, 王麗娟, 王莉. 磁性固定化胃蛋白酶水解牛奶的研究[J]. 化學與生物工程, 2009, 26(1): 45-52.
[10]徐英操, 馮志彪. 磁性固定化胰蛋白酶水解乳清蛋白及清除DPPH研究[J]. 中國乳品工業, 2008, 36(11): 14-16.
[11]李紅, 王煒軍, 徐鳳彩. 殼聚糖微球的制備及其固定木瓜蛋白酶的研究[J]. 華南農業大學學報, 2000, 21(2): 49-52.
[12]鄭迎迎, 李大力. 殼聚糖載體的制備及脲酶的固定化研究[J]. 生物技術, 2005, 15(2): 56-59.
[13]張黎明, 袁永俊, 徐夢虬. 殼聚糖微球固定化胰蛋白酶條件初探[J].中國乳品工業, 2009, 37(5): 16-18.
[14]楊利花, 陳慶森. 蛋白酶的固定化及其在生物活性物質開發中應用的研究進展[J]. 食品科學, 2008, 29(2): 466-471.
[15]王海英, 孫謐, 王穎. 殼聚糖固定化海洋低溫堿性蛋白酶YS2802122的研究[J]. 海洋水產研究, 2008, 29(2): 41-47.
[16]鐘方旭, 張弦, 李春美. 多孔殼聚糖微球固定化堿性蛋白酶的研究[J]. 食品科技, 2008(3): 49-53.
[17]郭宇星, 陳慶森, 趙林森, 等. 瑞士乳桿菌發酵法制備乳清蛋白源性ACE抑制肽的研究[J]. 食品科學, 2006, 27(6): 151-154.
Optimization of Process Conditions for Immobilization of Lactobacillus helveticus Proteinase with Chitosan
WANG Cui-cui1,GUO Yu-xing1,*,PAN Dao-dong1,2
(1. Ginling College, Nanjing Normal University, Nanjing 210097, China;2. School of Marine Sciences, Ningbo University, Ningbo 315211, China)
Immobilized Lactobacillus helveticus proteinase was prepared using chitosan as carrier and glutaraldehyde as crosslinking agent by adsorption and cross-linking method. The effects of condensate, chitosan concentration, enzyme amount, crosslinking time, and glutaraldehyde concentration on immobilization efficiency of Lactobacillus helveticus proteinase as indicated by the activity of immobilized proteinase were explored based on single factor experiments. The optimal immobilization conditions were determined by response surface analysis to be a mixture of NaOH and methanol at a ratio of 3:1 as condensate at a dose of 4 g/100 mL, 2.89 g/100 mL chitosan concentration, 2.95 mg enzyme amount, 1 h cross-linking time and 0.4 g/100 mL glutaraldehyde concentration.
Lactobacillus helveticus proteinase;immobilization;enzyme activity
TS252.54
A
1002-6630(2012)03-0110-06
2011-09-20
國家自然科學基金青年科學基金項目(31101314);江蘇省自然科學基金項目(BK2011787);江蘇省教育廳高校自然科學基金項目(10KJB550003);南京師范大學特聘教授、高層次人才科研啟動基金項目(184070H2B08)
王翠翠(1987—),女,碩士研究生,研究方向為農產品加工。E-mail:yiyi-wcc@163.com
*通信作者:郭宇星(1981—),女,講師,博士,研究方向為乳品科學。E-mail:yuxingguo1981@yahoo.com.cn

