多菌靈高效降解菌的篩選與降解特性分析1)
李明石 曲 迪 李成龍 王呈玉 王玉軍 趙蘭坡
(吉林農業大學,長春,130118)
多菌靈(Carbendazim)是一種廣譜型內吸性、環境激素類化學農藥[1],化學名稱 N-(2-苯并咪唑基)氨基甲酸甲酯。許多國家用于農業上防治各種作物病害[2],其它內吸性殺菌劑如苯菌靈、苯并咪唑類和托布津類殺菌劑均可在土壤中和作物體中轉化為多菌靈而起到藥效作用[3]。多菌靈在土壤和水體中化學性質穩定,半衰期較長,長期施用多菌靈對土壤和水體造成污染,同時可以在水果蔬菜等作物中殘留,對哺乳動物易導致免疫功能下降和染色體畸變而影響后代繁衍[4-9]。
近年來,隨著農業的發展,在設施蔬菜生產過程中,大量的使用有機合成農藥——多菌靈,導致多菌靈在設施土壤中有一定的累積,造成了土壤和地下水污染加劇,這不僅影響到設施蔬菜的高產、高效及優質生產,而且影響蔬菜的質量安全,成為設施蔬菜可持續發展的關鍵制約因素[10]。多菌靈污染場地的生物修復作為多菌靈污染治理的一種易于實現原位修復、經濟、環保又有效的重要方法,受到國內外學者的廣泛關注。分離篩選高效降解菌是多菌靈污染土壤微生物修復技術中需要解決的關鍵問題,成為國內外的研究熱點。
本實驗針對設施蔬菜土壤多菌靈污染比較嚴重的特點,通過低溫條件下富集篩選,從長期施用多菌靈的設施蔬菜土壤中分離到一株高效降解菌Enterobacter sp.D5,并對其降解特性進行分析,以期為多菌靈污染設施蔬菜土壤及水體的生物修復提供實驗材料和科學依據。
1 材料與方法
1.1 材料
供試土壤和藥劑:供試土壤采自吉林省撫松市某長期施用多菌靈的土壤(0~30 cm);多菌靈標準品(有效成分含量≥98%)由吉林農業大學資源與環境學院農藥教研室提供;甲醇(色譜純)、三氯甲烷(色譜純)、丙酮(色譜純)、鹽酸(分析純)、氫氧化鈉(分析純)、無水硫酸鈉(分析純)。
儀器:Eppendorf 5810R低溫高速離心機(德國艾本德公司)、GA92-II2DB細胞超聲破碎儀(無錫上佳生物科技有限公司)、UV1200型紫外可見分光光度、1100液相色譜儀(美國Agilent公司)、BS224S電子天平、HZ-9211K恒溫振蕩器。
無機鹽培養液:Na2HPO4· 2H2O 8.5 g,KH2PO43.0 g,NaCl 0.5 g,NH4Cl 1.0 g,MgSO4·7H2O 0.5 g,CaCl214.7 mg,CuSO40.4 mg,KI 1.0 mg,MnSO4· H2O 4.0 mg,ZnSO4· 7H2O 4.0 mg,H3BO35.0 mg,H2MoO4·2H2O 1.6 mg,FeCl3·6H2O 2.0 mg,蒸餾水1 000 mL。pH 值7.0 ~7.2、121.3 ℃滅菌25 min。
富集培養基:無菌的無機鹽培養液中加入需要量的多菌靈。
分離培養基:無機鹽培養液,多菌靈15 g,瓊脂18 g。pH 值7.0 ~7.2、121.3 ℃滅菌25 min。
LB培養基:胰化蛋白胨10 g,NaCl 10 g,酵母提取物5 g,瓊脂18 g。
1.2 試驗方法
1.2.1 多菌靈高效降解菌的富集篩選
將10 g土樣加入到100 mL以多菌靈為唯一碳源的富集培養基中,15℃,200 r·min-1搖床培養5 d,取富集的菌懸液10 mL,加入到新鮮的富集培養基中,在相同條件下富集培養5 d,連續富集傳代5次,使多菌靈質量濃度依次為 20、40、60、80、100 mg·L-1。經鑒定能降解多菌靈達90%以上的富集液為有活性的富集液。將活性富集液進行梯度稀釋涂布LB平板。挑取單菌接種液體富集培養基,通過HPLC分析驗證其降解能力。
1.2.2 多菌靈降解菌的鑒定
對分離純化得到的菌株進行菌體形態觀察、生理生化試驗。同時將獲得的菌株接入LB液體培養基中擴大培養,離心收獲菌體,提取菌株RNA。以細菌16 S rRNA通用引物27 f和1 492 r對該菌株基因組進行PCR擴增。PCR擴增條件:95℃ 5 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1.5 min,30 個循環;72℃10 min。擴增產物經純化后送上海生物工程技術服務有限公司測序,用Clustal W對測序結果與GenBank中相關的16 S rRNA序列進行比對,通過MEGA4.0軟件對菌株進行系統發育分析,采用鄰接法(neighbor-joining)構建系統進化樹,用Bootstrap法(1 000次重復)檢驗。
1.2.3 菌株對多菌靈降解的最佳條件
降解試驗基本條件為:在100 mL基礎培養基的三角瓶中,以100 mg·L-1多菌靈為唯一碳源,接種量 OD600nm=0.2、20 ℃、pH 值 7.0、200 r·min-1;最佳條件降解試驗:通過分別改變降解基本條件中的初始 pH 值(5.0、6.0、7.0、8.0、9.0 和 10.0)、溫度(5、10、15、20、25、30 和 35 ℃)、多菌靈添加量(50、100、150、200 和 250 mg·L-1),在其他條件保持不變的情況下,培養12 d,進行單因素條件試驗。各單因素設計以不接種和滅活菌為對照,每個處理設3次重復,測定菌株對多菌靈農藥的降解量。
1.2.4 最優條件下菌株生長量和多菌靈降解曲線的測定
將菌株置于100 mL含100 mg·L-1多菌靈的無機鹽培養基中,于 20 ℃、pH 值 7.0、200 r·min-1搖床培養,分別在 2、4、6、8、10、12 d 測定菌株對多菌靈農藥的降解量,同時測定菌株OD600nm生長量,分析菌株生長量與降解量之間的關系。
1.2.5 多菌靈的HPLC檢測方法
三波長校正法[11]:配置5 g·L-1(有效成分)的多菌靈標準溶液,按需稀釋成相應質量濃度。稱取100 μL樣品,用稀鹽酸(1+11)定容至 10 mL,分別測定其在278、280和290 nm波長處的吸光度,由ΔA=A280-(A278+A290)/2計算出校正吸光度ΔA,并根據標準曲線對樣品中的多菌靈含量進行定量分析。
100 mL培養液中加入250 mL三氯甲烷震蕩萃取30 min倒入分液漏斗中,再用250 mL三氯甲烷清洗培養瓶后全部倒入分液漏斗中震蕩萃取,在10 mL的比色管中加入2 mL萃取液,于60℃恒溫水浴中至三氯甲烷完全揮發,用10 mL甲醇定容,待測。色譜柱:C18 柱,25 cm×4.16 mm;柱溫為30 ℃;流動相為V(甲醇)∶V(水)=70∶30;流速為0.8 mL·min-1;檢測波長為280 nm;進樣體積為20 μL。
2 結果與分析
2.1 多菌靈降解菌的篩選和鑒定
以多菌靈為唯一碳源,經過50 d的富集篩選,得到1株多菌靈高效降解菌D5。該菌短桿狀,革蘭氏染色陰性、無芽胞;純培養菌落為乳黃色且略透明;其能利用葡萄糖產氣,V.P.反應、甲基紅反應、吲哚實驗、氧化酶、產H2S實驗、苯丙氨酸脫氫酶、精氨酸雙水解酶及明膠液化反應陰性。應用細菌16 S rDNA通用引物27 f和1492 r有效擴增出1265 bp的片段,將測序結果在GenBank中利用Blast軟件進行同源性序列比對,以大腸桿菌為外源構建系統發育樹,如圖1所示。

圖1 根據16 S rRNA部分基因序列構建的菌株D5與相關種屬的系統發育樹
菌株D5與已報道的Enterobacter屬細菌親緣關系最近,與Blast結果一致。因此,菌株D5在分類學地位上初步確定是歸屬于腸桿菌屬Enterobacter。
目前,國內外關于多菌靈降解菌的報道很少,分離到的多菌靈降解菌有紅平紅球菌Rhodococcus erythropolis[12-13]和 Rhodococcus qingshengii sp.nov.[14]、羅爾斯通氏菌屬 Ralstonia sp.[15]、短小芽孢桿菌 Bacillus pumilus[16]、假單胞菌屬 Pseudomonas sp.[17]、木霉 Trichonderma sp.[18]、諾卡氏菌 Nocardioides sp.SG-4G[19]、巴西固氮螺菌 Azospirillum brasilense[20],尚未見關于 Enterobacter菌屬降解多菌靈菌株的報道。
<1),且各件產品是否為不合格品相互獨立.
2.2 純培養條件下菌株的降解特性
2.2.1 初始pH值變化對降解能力的影響
為考察培養基的初始pH值對菌株D5降解作用的影響,將菌株D5接種于含100 mg·L-1多菌靈的不同pH緩沖液中,在20℃、200 r·min-1條件下培養12 d。菌株D5在不同pH值條件下的多菌靈的降解率如圖2所示。由圖2可知,無機鹽培養基初始pH值對菌株D5降解多菌靈有較大影響,強酸(pH值5.0)和強堿(pH值10.0)均不利于菌株D5的生長和對多菌靈的降解;菌株D5在pH值6.0~9.0均能生長,而最適生長 pH 值為 6.0~7.0,8 d后的降解率分別為100%和82.34%。
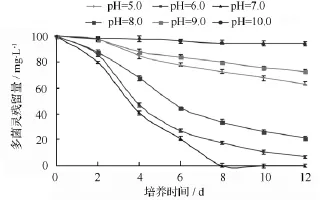
圖2 不同初始pH值對多菌靈降解的影響
2.2.2 溫度變化對降解能力的影響
溫度是影響微生物降解農藥等有機污染物的主要環境因素之一。本研究對菌株D5在不同溫度下(5、10、15、20、25、30、35 ℃)多菌靈的降解特性進行研究,結果如圖3所示。圖3結果表明,在5~30℃,菌株D5對多菌靈均具有降解能力;在溫度為15和20℃時,菌株D5對多菌靈降解效果好,分別在培養12和8 d時降解率達到100%。菌株D5在溫度為5和30℃時,仍具有一定降解效果,培養12 d后降解率分別為24.26%和47.42%;溫度為 25℃時,菌株D5對多菌靈的降解效果明顯不如20℃,降解率僅為74.38%;當溫度超過20℃時,隨著溫度的升高,降解率逐漸降低。由此可見,菌株D5在10~25℃的低溫條件下具有較強的降解活性。
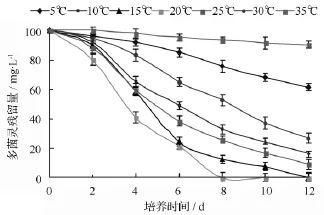
圖3 不同溫度對多菌靈降解的影響
目前,已經分離的多菌靈降解菌多屬于中溫菌,最佳降解溫度均在25~35℃[12-20],菌株D5在10~20℃的條件下對多菌靈的降解效果明顯優于25℃以上的溫度,按照Morita的定義屬于耐冷菌。因此,菌株D5對北方多菌靈污染土壤的低溫生物修復與其它菌株相比具有很大的優勢。
2.2.3 菌株D5對不同質量濃度多菌靈降解效果
由圖4可見,在pH值7.0、20℃條件下培養時,菌株D5對多菌靈的耐受質量濃度高于250 mg·L-1,完全降解初始質量濃度為 50、100、150、200 mg·L-1的多菌靈所需的時間分別為4、8、10、12 d。由此可見,多菌靈的初始質量濃度對菌株D5的降解率有較大的影響,在12 d內多菌靈的初始質量濃度越高,降解率越低。
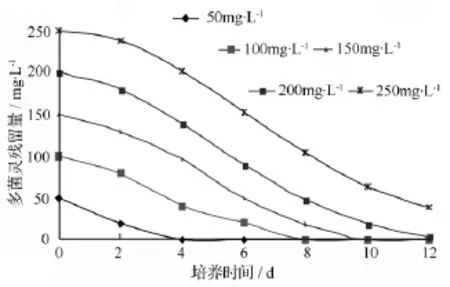
圖4 菌株D5對不同質量濃度多菌靈的降解效果
2.2.4 營養基質對菌株降解多菌靈的影響
在處理液中加入外源氮素營養基質可以顯著提高菌株對多菌靈的降解效果,見圖5。隨著外源氮素基質的加入,菌株D5對多菌靈的降解量明顯增加,以加入蛋白胨時菌株D5對多菌靈的降解量最大,在6 d后達到100%,菌體生長量的增加可能是在外源氮素基質存在條件下多菌靈的降解速率加快的原因,并且外源氮素基質的加入沒有抑制多菌靈的降解。從圖5結果對比來看,有機氮源的加入促降解作用明顯優于有機碳源,且菌株D5在利用外源碳源營養基質的同時不能利用多菌靈作為碳源,菌體的量的增加較以多菌靈為唯一碳源的多,隨著外源碳源基質的消耗,多菌靈的降解量逐漸增多。
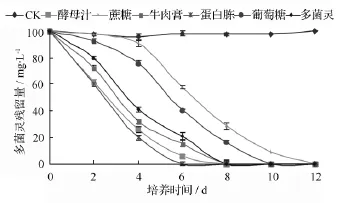
圖5 不同營養基質對菌株D5降解率的影響
這表明,在使用菌株D5進行多菌靈污染土壤修復時,外加有機氮源可以促進多菌靈的生物降解,這與朱鳳曉等[21]添加少量氮源可以促進復合菌對多菌靈的降解的研究結果是一致的,但與張麗珍等[16]關于尿素會抑制短小芽胞桿菌NY97-1降解多菌靈能力的研究結果相反。
2.2.5 菌株生長與降解多菌靈的關系
如圖6所示,菌株D5在20℃,pH值7.0的最適生長條件下,能以多菌靈為唯一碳源生長,菌株D5的生長曲線和多菌靈的降解曲線相吻合。該圖也表明,菌株生長沒有明顯的滯后期,培養2 d后進入對數生長期,隨著細菌細胞數量的增多,多菌靈的降解量也逐漸增大,當培養8 d時多菌靈的降解率達到100%,說明該菌株在20℃、pH值7.0的生長條件下,能較快適應環境并利用多菌靈作為生長基質。
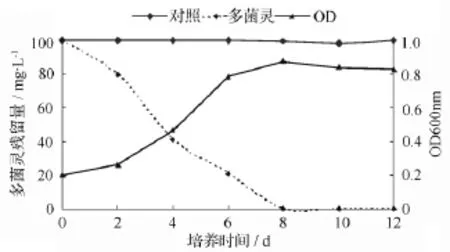
圖6 最優條件下菌株D5生長和多菌靈降解情況
3 結論
綜上所述,從長期施用多菌靈土壤中分離得到1株耐低溫的多菌靈高效降解菌Enterobacter sp.D5具有較好的多菌靈降解能力,菌株D5能以多菌靈為唯一碳源生長,在15℃、pH值7.0的最適生長條件下12 d可完全降解100 mg·L-1多菌靈,外加氮源可以有效促進多菌靈的生物降解,這為該菌株用于多菌靈污染土壤的低溫生物修復提供了良好的材料和理論依據。
致謝:多菌靈標樣由吉林農業大學逯忠斌教授提供;馬秀蘭副教授和撫松市環境監測站對樣品采集給予的幫助,在此表示感謝。
[1]馬承鑄,顧真榮.環境激素類化學農藥污染及其控制[J].上海農業學報,2003,19(4):98-103.
[2]Chen Yu,Zhou Mingguo.Characterization of fusarium graminearum isolates resistant to both carbendazim and a new fungicide JS399-19[J].Phytopathology,2009,99(4):441-446.
[3]Cuppen J G M,P J Van Den Brink,E Camps,et al.Impact of the fungicide carbendazim in freshwater microcosms water quality,breakdown of particulate organic matter and responses of macroinvertebrates[J].Aquat Toxicol,2000,48(2/3):233-250.
[4]Arora S,Mukherjee I,T P Trivedi.Determination of pesticid residue in soil,water and grain from IPM and non-IPM field trials of rice[J].Bull Environ Contam Tocicol,2003,81(4):373-376.
[5]Bergl?f T,T Van Dung,H Kylin,et al.Carbendazim sorption-desorption in vietnames soils[J].Chemosphere,2002,48(3):267-273.
[6]Carbo L,Martins E L,Dores E F,et al.Acetamiprid,carbendazim,diuron and thiamethoxam sorption in two Brazilian tropical soils[J].J Environ Sci Health B,2007,42(5):499-507.
[7]Holmes M,Kennedy M C,Riccio R,et al.Assessing the risk to U.K.children from carbendazim residues in apple products[J].J Occup Environ Health,2008,14:86-93.
[8]Moffit J S,Bryant B H,Hall S J,et al.Dosedependent effects of sertoli cell toxicants 2,5-hexanedione,carbendazim,and mono-(2-ethylhexyl)phthalate in adult rat testis[J].Toxicol Pathol,2007,35(5):719-727.
[9]Yu Gongchang,Guo Qiming,Xie Lin,et al.Effects of subchronic exposure to carbendazim on spermatogenesis and fertility in male rats[J].Toxicol Ind Health,2009,25(1):41-47.
[10]李明石,王玉軍,徐徐,等.多菌靈在黑土中的吸附及解吸行為[J].東北林業大學學報,2011,39(5):131-132.
[11]于彥彬,苗在京,萬述偉,等.三波長校正光度法測定水果蔬菜中多菌靈殘留量[J].理化檢驗:化學分冊,2005,41(5):353-357.
[12]Holtman M A,Kobayashi D Y.Identification of rhodococcus erythropolis isolates capable of degrading the fungicide carbendazim[J].Applied Microbiology and Biotechnology,1997,47(5):578-582.
[13]黃玉杰,張新建,任艷,等.多菌靈降解菌的分離、鑒定及其降解特性研究[J].山東科學,2011,24(2):28-34.
[14]Xu Jingliang,He Jian,Wang Zhichun,et al.Rhodococcus qingshengii sp.nov.,a carbendazim-degrading bacterium[J].International Journal of Systematic Evolutionary Microbiology,2007,57(12):2754-2757.
[15]Zhang Guishan,Jia Xiaoming,Cheng Tianfan,et al.Isolation and characterization of a new carbendazim-degrading Ralstonia sp.strain[J].World Journal of Microbiology and Biotechnology,2005,21(3):265-269.
[16]張麗珍,喬雄梧,馬利平,等.多菌靈降解菌NY97-1的鑒定及降解條件[J].環境科學學報,2006,26(9):1440-1444.
[17]Fang Hua,Wang Yiqi,Gao Chunming,et al.Isolation and characterization of pseudomonas sp.CBW capable of degrading carbendazim[J].Biodegradation,2010,21:939-946.
[18]田連生,陳菲.木霉對多菌靈的生物降解特性研究[J].土壤學報,2009,46(6):1127-1131.
[19]Gunjan Pandey,Susan J Dorrian,Robyn J Russell,et al.Cloning and biochemical characterization of a novel carbendazim(Methyl-1 H-Benzimidazol-2-ylcarbamate)-hydrolyzing esterase from the newly isolated nocardioides sp.strain SG-4G and its potential for use in enzymatic bioremediation[J].Applied Environmental Microbiology,2010,76(9):2940-2945.
[20]Xu Gangming,Zheng Wei,Li Yingying,et al.Biodegradation of chlorpyrifos and 3,5,6-trichloro-2-pyridinol by a newly isolated paracoccus sp.strain TRP[J].International Biodetetioration and Biodegradation,2008,62:51-56.
[21]朱鳳曉,孔潔,由焦化,等.高效復合菌對多菌靈的生物降解[J].環境科學學報,2011,31(5):1045-1050.

