那格列奈分散片的人體生物等效性研究
程 志,于 洋,胡玉欽,侯艷寧
(白求恩國際和平醫(yī)院藥劑科,河北 石家莊 050082)
那格列奈(nateglinide)是一種新型非磺酰脲類促胰島素分泌的降糖新藥,為 D-苯丙氨酸衍生物,通過與胰腺β細(xì)胞膜上的ATP敏感性鉀通道(KATP)偶聯(lián)受體相互作用,刺激胰島素分泌,臨床用于治療2型糖尿病,具有起效快、作用時間短、耐受性好、心血管不良反應(yīng)和低血糖發(fā)生率低等特點(diǎn)[1-3]。本試驗(yàn)中以合資公司生產(chǎn)的那格列奈片為參比制劑,研究了國產(chǎn)那格列奈分散片的人體生物等效性,旨在為藥品注冊和臨床合理用藥提供依據(jù)。
1 儀器與試藥
Agilent 1100高效液相色譜系統(tǒng),含在線脫氣機(jī)、四元梯度泵、自動進(jìn)樣器、柱溫箱(美國安捷倫公司);API 4000型三重四級桿質(zhì)譜儀,Analyst 1.4軟件(美國ABI公司);DAS藥物代謝動力學(xué)專用程序。受試制劑那格列奈分散片(石藥集團(tuán)中諾藥業(yè)<石家莊>有限公司,批號為041101,規(guī)格為每片30 mg);參比制劑那格列奈片(商品名為唐力?,北京諾華制藥有限公司,批號為04008,規(guī)格為每片120 mg);那格列奈對照品(河北省藥品檢驗(yàn)所,批號為040801,含量為99.5%);地西泮對照品(內(nèi)標(biāo),中國藥品生物制品檢定所,批號為171225-9601);甲醇、乙腈(色譜純),甲酸、乙醚(分析純),試驗(yàn)用水為市售娃哈哈純凈水。
2 方法與結(jié)果
2.1 研究對象選擇
選擇健康志愿者20名,男,無煙酒嗜好,年齡(22±1)歲,體重(63±6)kg,身高(172±5)cm。試驗(yàn)前經(jīng)病史詢問和體格檢查,心電圖、胸部X線透視、血常規(guī)、尿常規(guī)、肝功能、腎功能等均正常。試驗(yàn)前2周及試驗(yàn)期間未服用其他藥物。試驗(yàn)前受試者均簽署知情同意書。
2.2 給藥方案和樣品采集
采用兩制劑兩周期交叉試驗(yàn)設(shè)計(jì)。將20名受試者隨機(jī)分為2組,交叉服用參比制劑或受試制劑。受試者于試驗(yàn)前進(jìn)食清淡晚餐后禁食10 h過夜,試驗(yàn)當(dāng)日早晨空腹口服參比制劑或受試制劑,劑量均為120 mg,用溫開水250 mL送服。服藥2 h后方可飲水,4 h和10 h后統(tǒng)一進(jìn)餐。試驗(yàn)期間保持日常輕微活動,避免劇烈活動。清洗期為1周。受試者于服藥前及服藥后0.33,0.67,1,1.5,2,2.5,3,4,6,8,10 h 分別從肘靜脈取血 2 mL,置肝素抗凝管中,離心分離血漿,-20℃冷凍保存至用。試驗(yàn)方案經(jīng)白求恩國際和平醫(yī)院倫理委員會批準(zhǔn)實(shí)施。
2.3 血漿樣品分析方法
2.3.1 色(質(zhì))譜條件與系統(tǒng)適用性試驗(yàn)
色譜柱為 Symmetry Shield RP18柱(20 mm × 3.9 mm,3.5 μm);流動相為甲醇-0.5%甲酸水溶液(80∶20,V/V);流速0.5mL/min;柱溫20℃;進(jìn)樣量5 μL。質(zhì)譜分析采用電噴霧離子化(ESI)源;負(fù)離子多離子反應(yīng)監(jiān)測(MRM)模式檢測;噴霧電壓為-4.5 kV;霧化溫度為450℃;霧化氣流速為35 L/min;簾氣流速為25 L/min;碰撞氣流速為4 L/min;輔助氣流速為35 L/min。用于定量分析的離子反應(yīng)分別為 m/z 318→m/z 166(那格列奈,[M-H]-),m/z 258→ m/z 193(內(nèi)標(biāo),地西泮,[M -H]-),碰撞誘導(dǎo)解離(CID)電壓分別為20 V(那格列奈)和40 V(內(nèi)標(biāo),地西泮);駐留時間均為200 ms。上述色(質(zhì))譜條件下,血漿中內(nèi)源性物質(zhì)不干擾那格列奈及內(nèi)標(biāo)物的測定,那格列奈和內(nèi)標(biāo)物的保留時間分別為 0.95 min 和 0.65 min,色譜圖見圖 1。
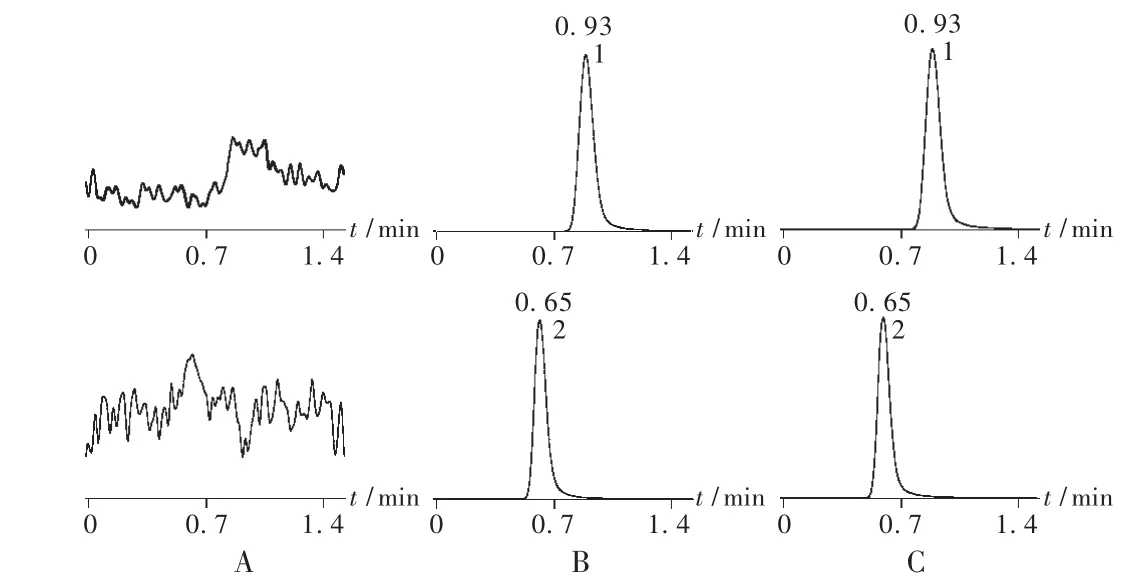
圖1 測定血漿中那格列奈的典型色譜圖
2.3.2 血漿樣品處理
取血漿樣品 100 μL,依次加入內(nèi)標(biāo)工作液(1.0 μg/mL 地西泮水溶液)100 μL,水 0.5 mL,0.1 mol/L 的 HCl溶液 200 μL,再加入乙醚3 mL,渦流混合 1.0 min,1800×g離心10 min后,取上層有機(jī)相至另一干燥試管中,40℃水浴揮干,殘留物用1.0 mL流相動溶解,進(jìn)樣5 μL用于 LC-MS/MS分析。
2.3.3 方法學(xué)考察
標(biāo)準(zhǔn)曲線制備:取空白血漿,分別加入不同質(zhì)量濃度的那格列奈對照品溶液,制備成 10.00,3.00,1.00,0.30,0.10 和 0.05 mg/L的血漿樣品,按2.3.2項(xiàng)下方法操作后進(jìn)樣分析,以血漿樣品中那格列奈質(zhì)量濃度(C,mg/L)為橫坐標(biāo)、那格列奈與內(nèi)標(biāo)的峰面積比(Y)為縱坐標(biāo),采用加權(quán)(1/C2)最小二乘法進(jìn)行線性回歸[4-5]。回歸方程為 Y=1.724 C+1.522 × 10-2,r=0.9994(n=6),血漿中那格列奈的質(zhì)量濃度在0.05~10 mg/L范圍內(nèi)與內(nèi)標(biāo)物的峰面積呈良好線性關(guān)系,最低定量限為0.05 mg/L。
回收率和精密度試驗(yàn):取低、中、高(0.1,1,8 mg/L)3 個質(zhì)量濃度的含那格列奈血漿樣品,按照標(biāo)準(zhǔn)曲線制備項(xiàng)下方法操作,于1 d內(nèi)和連續(xù)4 d處理并測定,每日各6份,計(jì)算日內(nèi)、日間變異(RSD)及相對回收率。另分別配制上述3個質(zhì)量濃度的那格列奈對照品溶液,按血漿處理方法不經(jīng)萃取直接進(jìn)樣,記錄色譜圖和峰面積,與相應(yīng)質(zhì)量濃度的血漿樣品測得的峰面積進(jìn)行比較得絕對回收率。結(jié)果見表1。
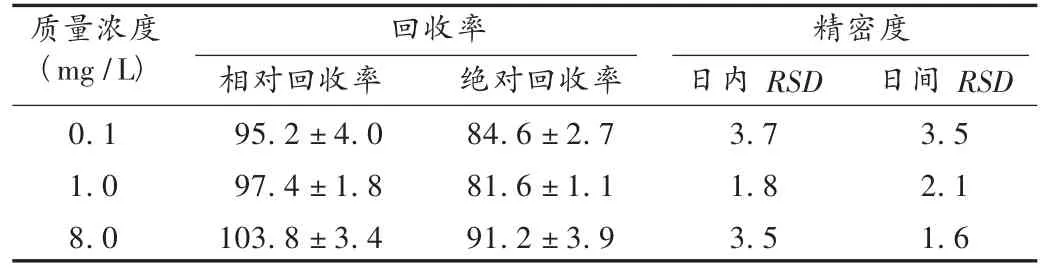
表1 回收率和精密度試驗(yàn)結(jié)果(n=6,%)
穩(wěn)定性試驗(yàn):取低、中、高(0.1,1,8 mg/L)3 個質(zhì)量濃度的含那格列奈血漿樣品,每個質(zhì)量濃度各2份,分別考察上述樣本在室溫放置24 h,經(jīng)3次凍融循環(huán)及-20℃冷凍保存2周的穩(wěn)定性。結(jié)果那格列奈血漿樣品室溫放置24 h,經(jīng)3次凍融循環(huán)及-20℃冷凍保存2周相對偏差均小于10%,表明在上述條件保存穩(wěn)定。
2.4 血藥濃度和主要藥物代謝動力學(xué)參數(shù)
20名健康受試者口服單劑量參比制劑和受試制劑120 mg后的平均血藥濃度-時間曲線見圖2,主要藥物代謝動力學(xué)參數(shù)和相對生物利用度見表2。
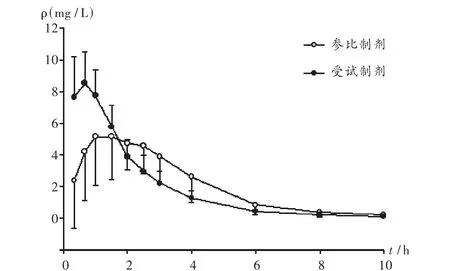
圖2 平均血藥濃度-時間曲線
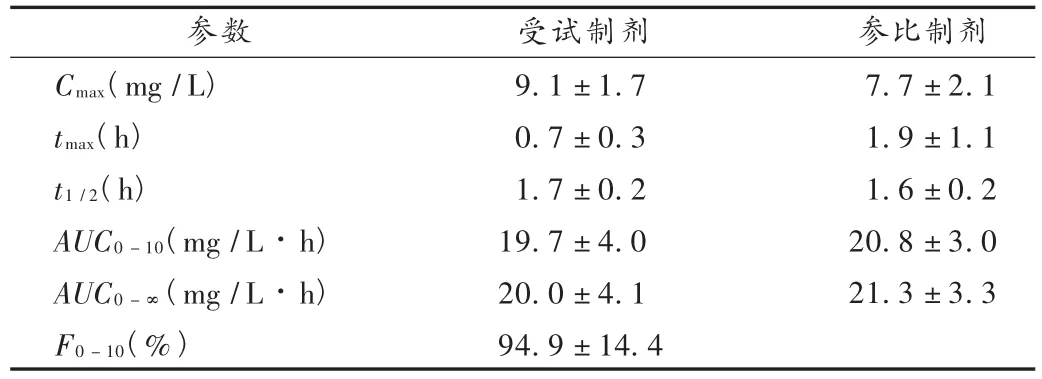
表2 主要藥物代謝動力學(xué)參數(shù)(n=20)
2.5 生物等效性檢驗(yàn)
非參數(shù)秩和檢驗(yàn)結(jié)果表明受試制劑的達(dá)峰時間(tmax)與參比制劑存在顯著性差異,口服受試制劑后達(dá)峰較快;峰濃度(Cmax)、0~10 h藥時曲線下面積(AUC0-10)、0~∞藥量曲線下面積(AUC0-∞)經(jīng)對數(shù)轉(zhuǎn)換后進(jìn)行方差分析,2種制劑lnAUC0-10h差異無統(tǒng)計(jì)學(xué)意義,而lnAUC0-∞和lnCmax的差異均有統(tǒng)計(jì)學(xué)意義,口服受試制劑后 Cmax值較高、AUC0-∞值較低。雙單側(cè) t檢驗(yàn)結(jié)果表明,受試制劑與參比制劑具有生物等效性,其lnCmax的90%置信區(qū)間為104.6% ~130.3%(落在參比制劑的75% ~133%之間);lnAUC0-10h和 lnAUC0-∞的 90% 置信區(qū)間分別為 88.7% ~ 99.5%和88.2% ~99.4%(均落在參比制劑的80% ~125%之間)。
3 討論
本試驗(yàn)采用專屬、靈敏、準(zhǔn)確的高效液相色譜-質(zhì)譜/質(zhì)譜法測定健康人口服那格列奈后的血藥濃度。當(dāng)口服劑量為120 mg時,平均最大血藥濃度值約為10 mg/L,每個樣品測定時間不足2 min,樣品處理采用以乙醚為提取溶劑的液液提取法,操作簡單、快捷,適用于人體藥物代謝動力學(xué)研究。
試驗(yàn)結(jié)果顯示,那格列奈片口服給藥吸收迅速,血藥濃度較低,半衰期短,消除迅速。單劑量口服參比制劑和受試制劑后在健康人體內(nèi)的過程略有差異,受試制劑為分散片,口服后達(dá)峰較快、最大血藥濃度(Cmax)值較高,而藥物在體內(nèi)吸收的程度相當(dāng)(AUC0-10,P >0.05)或略低(AUC0-∞,P < 0.05)。
雙單側(cè) t檢驗(yàn)結(jié)果表明,兩種制劑具有生物等效性,受試制劑的相對生物利用度為(94.9±14.4)%,表明受試制劑在臨床使用可望取得與參比制劑相同的療效。部分受試者服藥后出現(xiàn)一過性頭暈、乏力、出虛(冷)汗等癥狀,但均可耐受,無人因不良反應(yīng)而終止試驗(yàn)。
[1]Tentolouris N,Voulgari C,Katsilambros N.A review of nateglinide in the management of patients with type 2 diabetes[J].Vasc Health Risk Manag,2007,3(6):797-807.
[2]黃曉程,賢曉麗.新型降糖藥那格列奈的藥理作用和臨床應(yīng)用[J].中國新藥與臨床雜志,2005,24(2):148-150.
[3]楊惠娣,徐 彬.2型糖尿病治療新藥那格列奈[J].世界臨床藥物,2004,25(9):564 -567.
[4]鐘大放.以加權(quán)最小二乘法建立生物分析標(biāo)準(zhǔn)曲線的若干問題[J].藥物分析雜志,1996,16(5):343 -346.
[5]于 洋,劉建芳,薛洪源,等.液相色譜-電噴霧質(zhì)譜聯(lián)用法測定人血漿中托吡酯[J].藥物分析雜志,2004,24(4):358-361.

