CHO細胞初始接種密度對細胞毒性試驗結果的影響
管 瑩,夭建華,高 茜,曾婉俐,黃海濤,李雪梅,繆明明
(云南煙草科學研究院,云南 昆明 650106)
體外細胞毒性試驗作為一類重要的體外試驗,在新藥研發(fā)以及化學物質毒性評價方面均發(fā)揮著重要的作用。中性紅比色法和噻唑藍(MTT)比色法是目前應用較多的兩種毒理學檢測細胞毒性的方法,具有簡便、快捷、靈敏等特點,廣泛應用于評定食品、藥品、化妝品對細胞的毒性作用[1~7]。
據(jù)報道[6~10],由于使用的細胞種類不同,細胞毒性試驗中適合的細胞初始接種密度存在較大差異。本實驗室實際檢測工作中發(fā)現(xiàn),細胞毒性試驗定量測定結果的變異較大,可比性較差,而細胞初始接種密度可能是影響定量測定結果的重要因素,但未見文獻報道。鑒于此,為了提高中性紅比色法和MTT比色法體外細胞毒性試驗結果的半定量或定量檢測的可靠性和可比性,作者就CHO細胞初始接種密度對中性紅比色法和MTT比色法體外細胞毒性試驗的影響進行了比較,旨在為運用中性紅比色法和MTT比色法對化學品、食品等受試物的毒理學檢測提供參考。
1 實驗
1.1 材料、試劑和儀器
中國倉鼠卵巢細胞(CHO細胞),中國科學院昆明動物研究所。
DMEM/F12(Solarbo公司),胎牛血清(美國Klark),PBS,胰酶,中性紅(Sigma公司),二甲基亞砜(DMSO)。
96孔及24孔細胞培養(yǎng)板(Corning公司),二氧化碳培養(yǎng)箱(Forma公司),酶標儀(Bio-Rod公司),Borgwaldt RM20/CS型半自動轉盤式吸煙機。
1.2 受試物的制備
按國標方法[11],利用半自動轉盤式吸煙機抽吸40支標準測試用美國肯塔基卷煙3R4F,用直徑92 mm的劍橋濾片捕集燃吸后產(chǎn)生的煙氣總粒相物(TPM);將劍橋濾片放入三角瓶中,加入適量DMSO,使TPM在DMSO中的濃度為10 mg·mL-1;超聲20 min;過濾收集TPM提取液;儲存于-80 ℃,備用。
1.3 細胞的傳代培養(yǎng)
將CHO細胞按常規(guī)方法傳代培養(yǎng):DMEM/F12完全培養(yǎng)液(含10%胎牛血清),37 ℃,5%CO2。
1.4 細胞倍增時間的測定
取CHO對數(shù)生長期的細胞,用胰酶進行消化,吹打均勻,細胞計數(shù)后分別以細胞密度(×104個·mL-1)為2、4、6、8、10接種于24孔板中,每孔0.5 mL,分別于24 h、48 h各取3孔,棄去培養(yǎng)液及未貼壁細胞,加入1 mL PBS洗2次后去上清,用胰酶消化貼壁細胞后進行細胞計數(shù)。按式(1)計算細胞倍增時間(tD)[8]:
(1)
式中:tD為t1~t2時間范圍內細胞的倍增時間;n1為t1時刻的細胞數(shù);n2為t2時刻的細胞數(shù)[13]。
1.5 中性紅比色法測定受試物對細胞的抑制率
取CHO對數(shù)生長期的細胞,用胰酶進行消化,吹打均勻,細胞計數(shù)后分別以細胞密度(×104個·mL-1)為2、4、6、8、10接種于96孔板中,每孔200 μL,置于37 ℃、5% CO2培養(yǎng)箱中培養(yǎng)24 h;加入受試物,受試物終濃度(μg·mL-1)分別為50、100、120、140、160、200、300,每個濃度6個復孔,置于37 ℃、5% CO2培養(yǎng)箱中培養(yǎng)24 h;加入濃度為100 μg·mL-1的中性紅DMEM無血清培養(yǎng)液,每孔200 μL,置于37 ℃、5% CO2培養(yǎng)箱中培養(yǎng)3 h;去除中性紅溶液,加入1%的甲醛溶液200 μL,固定1 min;去除固定液,每孔加入200 μL中性紅萃取液(現(xiàn)配,水∶乙醇∶乙酸=49∶50∶1),置于微量振蕩器上振蕩10 min,用酶標儀測量540 nm處吸光度值。按式(2)計算細胞抑制率(X):
(2)
式中:ODn為樣品多孔平均OD值;OD0為空白多孔平均OD值;ODc為對照多孔平均OD值[14]。
1.6 MTT比色法測定受試物對細胞的抑制率
取CHO對數(shù)生長期的細胞,用胰酶進行消化,吹打均勻,細胞計數(shù)后分別以細胞密度(×104個·mL-1)為2、4、6、8、10接種于96孔板中,每孔200 μL,置于37 ℃、5% CO2培養(yǎng)箱中培養(yǎng)24 h;加入受試物,受試物終濃度(μg·mL-1)分別為50、100、120、140、160、200、300,每個濃度6個復孔,置于37 ℃、5% CO2培養(yǎng)箱中培養(yǎng)24 h;加入濃度為5 mg·mL-1的MTT溶液,每孔20 μL,置于37 ℃、5% CO2培養(yǎng)箱中培養(yǎng)3 h;去除溶液,加入DMSO溶液,每孔200 μL,置于微量振蕩器上振蕩10 min,用酶標儀測量490 nm處吸光度值。計算細胞抑制率。
1.7 統(tǒng)計學方法
采用SPSS 16.0軟件的one-way ANOVA功能進行方差分析。
2 結果與討論
2.1 CHO細胞初始接種密度對細胞倍增時間的影響(圖1)
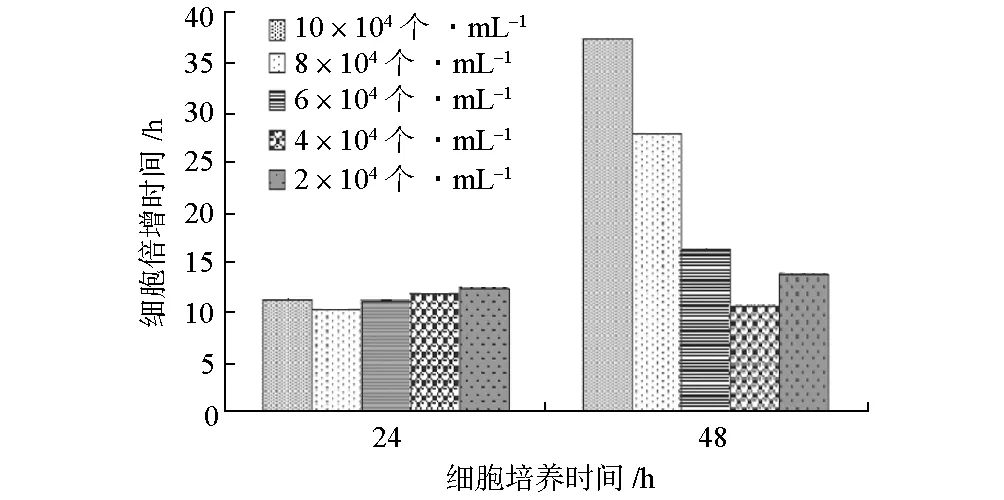
圖1 CHO細胞初始接種密度對細胞倍增時間的影響
由圖1可知,各濃度組在24 h內細胞倍增時間無明顯差異(P>0.05),大約10~15 h增殖一代。而細胞培養(yǎng)第48 h時,8×104個·mL-1與10×104個·mL-1實驗組細胞生長速度明顯減慢,分別為28 h和37 h左右增殖一代;2×104個·mL-1、4×104個·mL-1、6×104個·mL-1實驗組細胞生長速度與培養(yǎng)24 h相近,仍然為10~15 h增殖一代。因此,以初始密度2×104~6×104個·mL-1接種細胞,CHO在連續(xù)48 h的培養(yǎng)時間內細胞增殖速度較為穩(wěn)定。
2.2 CHO細胞初始接種密度對中性紅比色法測定受試物的細胞抑制率的影響(圖2)
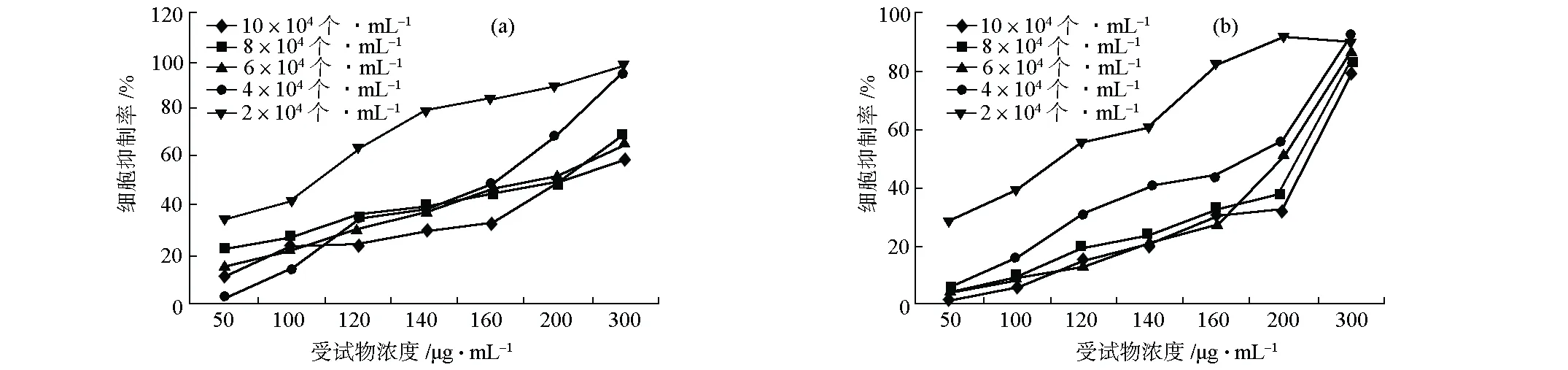
圖2 CuSO4(a)和TPM(b)對不同初始接種密度CHO細胞的抑制率
由圖2可知,隨著細胞初始接種密度的降低,兩種受試物對CHO細胞的抑制率均呈升高趨勢。
利用SPSS 16.0軟件中的LSD多重比對法,對CuSO4及TPM兩種受試物在劑量(μg·mL-1)為50、100、120、140、160、200、300時對CHO細胞初始接種密度(×104個·mL-1)為10、8、6、4、2的細胞抑制率進行方差分析,結果見表1。
表1CuSO4和TPM對不同初始接種密度CHO細胞的抑制率的方差分析
Tab.1Varianceanalysis(Pvalue)ofinhibitionrateofCHOcellswithdifferentinitialseedingdensitiestreatedbyCuSO4andTPM
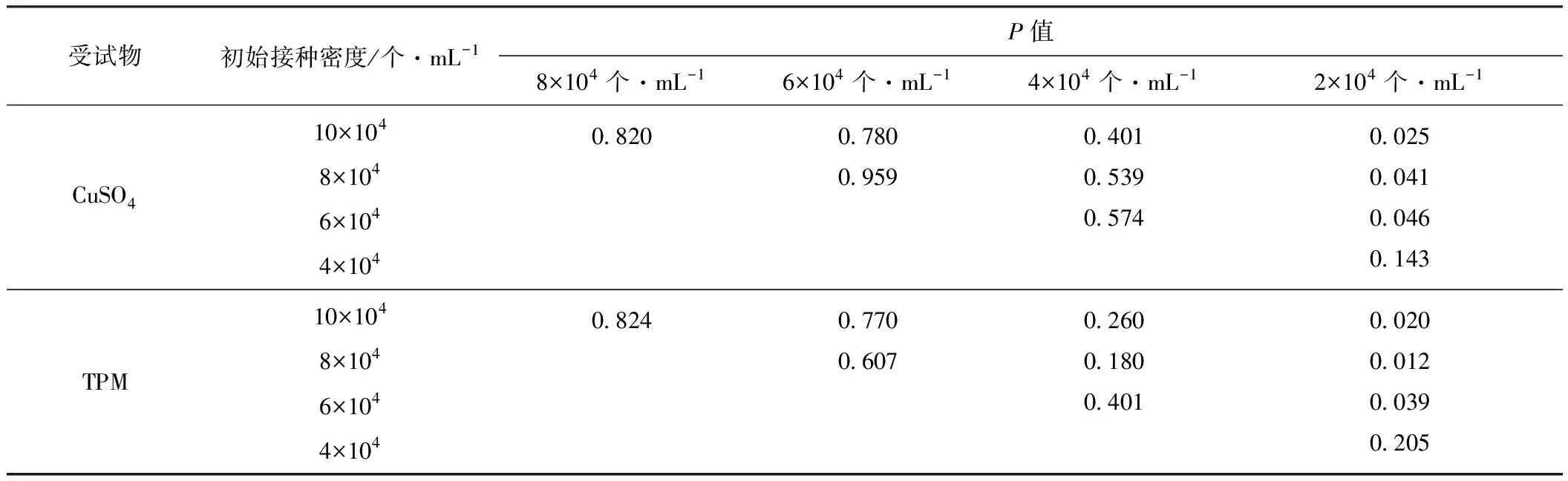
受試物初始接種密度/個·mL-1P值8×104個·mL-16×104個·mL-14×104個·mL-12×104個·mL-1CuSO410×1048×1046×1044×1040.8200.7800.9590.4010.5390.5740.0250.0410.0460.143TPM10×1048×1046×1044×1040.8240.7700.6070.2600.1800.4010.0200.0120.0390.205
由表1可知,受試物為CuSO4或TPM時,2×104個·mL-1實驗組與10×104個·mL-1、8×104個·mL-1、6×104個·mL-13個實驗組的細胞抑制率間存在顯著差異(P<0.05);10×104個·mL-1、8×104個·mL-1、6×104個·mL-1、4×104個·mL-14個實驗組間細胞抑制率均無顯著差異(P>0.05)。
上述結果表明,兩種受試物對CHO細胞的抑制率隨細胞初始接種密度的降低均呈升高的趨勢,當CHO細胞的初始接種密度為4×104~10×104個·mL-1時用中性紅比色法測定的同一受試物對細胞的抑制率相對穩(wěn)定,在統(tǒng)計學上無顯著差異(P>0.05)。
2.3 CHO細胞初始接種密度對MTT比色法測定受試物的細胞抑制率的影響(圖3)
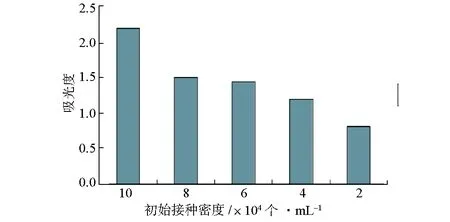
圖3 MTT比色法測定不同初始接種密度CHO細胞的吸光度
通常情況下用MTT比色法進行檢測時,為了保證實驗結果的線性,MTT在490 nm處的吸光度值最好在0~1.2范圍內。由圖3可知,除2×104個·mL-1、4×104個·mL-1實驗組MTT吸光度值低于1.2外,其余3組的吸光度值均超出了線性范圍。
2.4 討論
(1)細胞毒性試驗通常采用處于對數(shù)生長期的細胞,這是由于對數(shù)生長期的細胞代謝旺盛、生長迅速、代時穩(wěn)定,個體形態(tài)、化學組成和生理特性等均較一致,利用對數(shù)生長期的細胞進行試驗有利于比較試驗結果。無論是中性紅比色法還是MTT比色法,細胞毒性試驗的周期均為48 h,而受試物是在細胞完全貼壁后加入,即細胞接種后24 h,因此,培養(yǎng)48 h細胞的穩(wěn)定增殖對試驗結果的可重復性的影響尤為重要。本研究利用細胞倍增試驗對CHO細胞不同初始接種密度下48 h內的細胞倍增時間進行了測定,結果顯示以2×104~6×104個·mL-1的初始接種密度接種細胞,細胞在連續(xù)48 h的培養(yǎng)時間內生長速度較為穩(wěn)定。而以較高初始密度(8×104~10×104個·mL-1)接種細胞,由于生長空間有限,當細胞達到飽和密度后,細胞間的接觸抑制作用導致細胞增殖減慢,細胞停止生長,進入平臺期,這不利于試驗結果的比較。
(2)隨細胞初始接種密度的降低,CuSO4和TPM兩種受試物對CHO細胞的抑制率均呈升高趨勢。這可能是由于,細胞初始接種密度不同,同一濃度的受試物對于實際受試細胞個體來說所需要承受的相對劑量是不同的。細胞越少,同樣濃度的受試物相對每個受試細胞來說所需要承受的劑量越高。不同的細胞毒性試驗其最適細胞初始接種密度有所不同。中性紅比色法的最適細胞初始接種密度比MTT比色法高,這可能是由于中性紅比色法細胞毒性試驗過程中比MTT比色法多了清洗和固定等步驟,對細胞有一定損耗,因此細胞初始接種密度應適當提高。
(3)目前關于化學物質細胞毒性的研究報道中,由于各研究目標樣品的靶器官不同,所選擇的細胞也有所差異。例如王明衡等[9]選取HL-7702肝細胞對食品添加劑亞硫酸鈉的細胞毒性進行檢測,細胞初始接種密度為2.5×105個·mL-1;而蘇建青等[7]選擇雞胚成纖維細胞(CEF)對人參皂角促細胞增殖作用進行了檢測,細胞初始接種密度為1×106個·mL-1。由此可見,細胞毒性試驗由于使用的細胞種類不同,具體選用的細胞初始接種密度也有所差異,且范圍較大[6~10]。目前,對于不同比色法所適用的細胞初始接種密度,尚未見相關文獻進行嚴格限定。而本研究結果也證明細胞初始接種密度確實是影響細胞毒性試驗結果的重要因素之一,且不同的細胞毒性試驗其最適初始接種密度有所不同,并通過試驗得到了CHO細胞進行中性紅比色法和MTT比色法細胞毒性試驗的最適細胞初始接種密度的范圍,在具體試驗操作中應根據(jù)試驗需求選取最適濃度,以提高試驗結果的可重復性及可比性。
3 結論
綜合CHO細胞倍增試驗與CHO細胞不同初始接種密度對中性紅比色法和MTT比色法兩個細胞毒性試驗影響的結果,發(fā)現(xiàn):以2×104~6×104個·mL-1為初始接種密度,細胞在48 h內生長速度較為穩(wěn)定;以4×104~6×104個·mL-1的初始密度接種細胞,中性紅比色法細胞毒性試驗結果較為穩(wěn)定,可重復性較好;而以2×104~4×104個·mL-1的初始密度接種細胞,MTT比色法細胞毒性試驗結果較穩(wěn)定。
參考文獻:
[1] 林祥梅,王建峰,梅琳,等.用人角質細胞評價4種化妝品的細胞毒性[J].毒理學雜志,2008,22(1):75-76.
[2] 夭建華,陳輝敏,方力,等.國內外卷煙危害性評價方法現(xiàn)狀和發(fā)展趨勢[J].煙草科技,2007,(1):50-53.
[3] 盧斌斌,Ryan M,Lynne W,等.3種不同焦油卷煙煙氣的細胞毒性比較[J].煙草科技,2007,(12):38-41.
[4] 馬亞萍,白劍英.MTT法探討N-乙酰半胱氨酸對Na2SO3小鼠脾淋巴細胞毒性的影響[J].山西醫(yī)科大學學報,2006,37(10):1020-1021.
[5] 熊習昆,楊穎,譚小華,等.3T3中性紅試驗在化妝品光毒性檢測中的應用[J].中國公共衛(wèi)生,2006,22(10):1207-1209.
[6] 劉銳克,周軍蘭,梁建輝.中性紅比色法檢測大鼠小腦神經(jīng)瘤活細胞[J].中國藥理學與毒理學雜志,2003,17(1):74-78.
[7] 蘇建青,褚秀玲,李俊霞,等.中性紅染色法檢測人參皂苷及其衍生物對CEF增殖的影響[J].安徽農業(yè)科學,2009,37(35):17523-17525.
[8] 夭建華,繆明明,米其利,等.卷煙主流煙氣細胞毒性在5種細胞系中的反應差異[J].中國煙草學報,2011,17(3):67-70.
[9] 王明衡,白劍英,原福勝.食品添加劑亞硫酸鈉對HL-7702肝細胞的毒性作用[J].山西醫(yī)科大學學報,2008,39(1):21-23.
[10] 司曉輝,劉正.人牙周膜成纖維細胞的體外培養(yǎng)及其生物學性狀[J].陜西醫(yī)學雜志,2001,30(4):195-197.
[11] GB/T 19609-2004,卷煙用常規(guī)分析用吸煙機測定總粒相物和焦油[S].
[12] 鞠桂芝,付士波,劉建香,等.X-射線照射對EL-4淋巴瘤細胞周期進程及細胞倍增時間的影響[J].輻射研究與輻射工藝學報,1998,16(3):157-160.
[13] 嚴泉劍,郭金龍,劉恩靖,等.繪制細胞生長曲線及細胞群體倍增時間的簡化計算[J].前衛(wèi)醫(yī)藥雜志,2000,17(4):228-229.
[14] 唐萍,米其利,倪紅梅,等.CHO細胞中性紅試驗參數(shù)研究[J].云南大學學報(自然科學版),2010,32(S1):127-129.

