蟾酥注射液對HL60/ADM細胞多藥耐藥的逆轉作用研究
熊新,周遠大(1.重慶醫科大學附屬第一醫院實驗研究中心,重慶400016;2.重慶醫科大學附屬第一醫院藥劑科,重慶 400016)
白血病細胞的多藥耐藥(Multidrug resistance,MDR)是指白血病細胞同時對多種結構和不同作用機制的抗腫瘤藥物產生耐受,從而使化療失敗或復發[1,2]。因此,尋求一種能逆轉其MDR的藥物對提高化療效果,延長病人生存期是十分關鍵的。目前已發現多種藥物具有逆轉MDR的作用,但大多數逆轉藥物當達到其逆轉濃度時,其毒副作用明顯[3,4],從而大大限制了這些逆轉藥物的臨床應用,近年來研究者們試圖從傳統中醫藥的角度尋找逆轉白血病MDR的新藥[5,6]。
蟾酥是我國傳統的中藥材,有改善全身狀況、提高機體免疫功能和提升白細胞等作用,同時還具有一定的抗腫瘤的功效,主要是通過誘導腫瘤細胞凋亡而發揮其療效。李貴新等[7]研究發現,蟾酥注射液能夠抑制白血病HL60細胞的增殖并誘導其凋亡,但其作用機制尚不明確。本研究旨在探討蟾酥注射液逆轉耐阿霉素(ADM)的急性髓性白血病細胞(HL60/ADM)MDR的作用及其機制,以期為治療白血病提供新的輔助藥物。
1 儀器與材料
1.1 儀器
CO2培養箱(美國Shel Lab公司);全自動酶標讀數儀(美國Biorad公司);96孔培養板(美國Corning公司);高效液相色譜(HPLC)儀(美國PerkinElmer公司)。
1.2 試藥
蟾酥注射液(江蘇安格藥業,批號:0001208,濃度:1.65 μg·L-1);ADM標準品(浙江海正藥業,批號:H33021980,濃度:100 μg·mL-1);RPMI-1640培養基(美國Gibco公司);MTT(美國Sigma公司);新生胎牛血清(FBS,杭州四季青生物工程材料有限公司);甲醇(色譜純,德國Merck公司);乙腈(分析純,上海陸都化學試劑廠)。
1.3 細胞株
ADM誘導的人急性髓性白血病耐藥細胞株HL60/ADM由中國醫學科學院血液學研究所提供。
2 方法
2.1 細胞培養
HL60/ADM細胞株置于含10%胎牛血清的RPMI-1640培養液中培養。培養條件為37℃、5%CO2、飽和濕度,每2~3 d傳代1次,培養基中加入ADM,使其最終濃度為0.2 μg·mL-1,以維持細胞的耐藥性,使用前1周停加ADM。取對數生長期細胞進行試驗。
2.2 MTT法檢測蟾酥注射液對HL60/ADM細胞增殖能力的影響
制備HL60/ADM細胞懸液(5×104個/mL),并接種于96孔板中,每孔200 μL。分別加入不同濃度蟾酥注射液20 μL(終濃度分別為0.015、0.030、0.060、0.120、0.150 μg·mL-1),每個濃度設3個平行孔,并設空白對照。在CO2孵箱中培養72 h后,每孔加入 5 mg·mL-1MTT溶液20 μL,繼續孵育4 h,棄上清液,加入150 μL DMSO,震蕩10 min使其充分溶解,然后用自動酶標儀測定各孔吸光度(A),試驗重復3次,取平均值。按下式計算細胞存活率(fu):fu=處理組平均A值/對照組平均A值。
2.3 MTT法檢測蟾酥注射液對HL60/ADM細胞MDR的逆轉作用
試驗分為對照組和處理組,對照組加空白培養液,處理組一次性加逆轉濃度的蟾酥注射液誘導培養3 d,并停藥培養7 d,每3 d換液1次。將對照組和處理組細胞分別制成濃度為5×104個/mL的細胞懸液,接種于96孔板中,每孔200 μL。依次加入含不同濃度ADM,每孔20 μL,使ADM的終濃度分別為2.49、4.99、9.96、18.95、39.90 μg·mL-1,每個濃度設3個平行孔,并設空白對照組加入等體積培養液。在CO2孵箱中培養72 h后,同“2.2”項下方法測定各孔A值,試驗重復3次,取平均值。并計算細胞抑制率(fa,fa=1-fu)和半數抑制量(IC50)。
2.4 HPLC法測定細胞內、外ADM的濃度
2.4.1 色譜條件 色譜柱:ZORBAX SB-C18(250 mm×4.6 mm,5 μm);流動相:5 mmol·L-1;流動相:磷酸-甲醇-異丙醇-乙晴(8∶7∶3∶2);流速:1 mL·min-1;柱溫:30 ℃;熒光檢測激發波長:480 nm,發射波長:560 nm。
在選定的色譜條件下,測得ADM標準品、培養液和細胞內液中的ADM色譜,被測物與其他雜質分離完全,峰形良好,保留時間約為5.8 min。色譜見圖1。
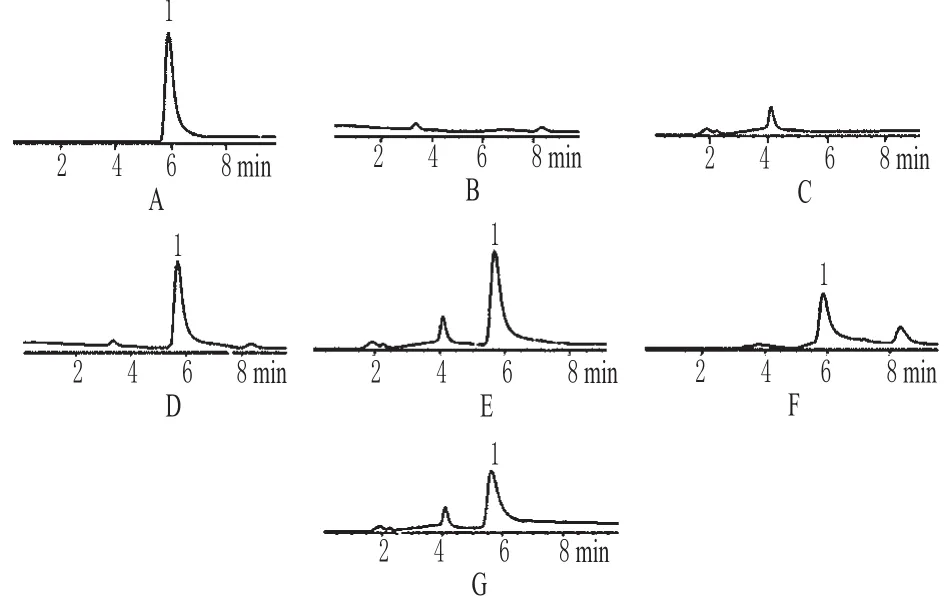
圖1 高效液相色譜圖A.ADM標準品;B.空白培養液;C.空白細胞內液;D.培養液中ADM標準品;E.細胞內液中ADM標準品;F.培養液中ADM樣品;G.細胞內液中ADM樣品;1.阿霉素Fig 1 HPLC chromatogramsA.ADM control;B.blank culture medium;C.blank intracelluar fluid;D.ADM control in culture media;E.ADM control in intracelluar fluid;F.ADM in culture media;G.ADM in intracelluar fluid;1.ADM
2.4.2 細胞樣品處理 試驗分為對照組和處理組,對照組加空白培養液,處理組一次性加逆轉濃度的蟾酥注射液誘導培養3 d,并停藥培養7 d,每3 d換液1次。將對照組和處理組細胞分別制成濃度為106個/mL的細胞懸液,接種到6孔板中,加入ADM使最終濃度為345 μmol·mL-1。在加藥后1、3、6 h分別收集培養上清液和細胞內液,每組3份。取培養上清液或細胞內液0.5 mL,置于1.5 mL離心管中,加入乙腈0.5 mL,快速混勻1 min,超聲振蕩10 min,12 000 r·min-1離心15 min,取上清液10 μL注入液相色譜儀進行分析,記錄峰面積。
2.5 方法學驗證
2.5.1 培養液-ADM標準曲線的制備 取0.5 mL空白培養液數份,在ADM標準品粉末中加入不同量蒸餾水,制備濃度為160、80、40、20、10、5 μg·mL-1的ADM培養液樣品各5份,按“2.4.2”項下“取培養上清液”開始操作,進行HPLC分析。以培養液中ADM檢測濃度(X)為橫坐標,峰面積積分值(Y)為縱坐標,進行線性回歸,得回歸方程為Y=39.649X+3.432 8(r=0.999 8)。結果表明,培養液中ADM檢測濃度在5~160 μg·mL-1范圍內與其峰面積積分值呈良好線性關系,檢測限為0.1 μg·mL-1(S/N=5)。培養液-ADM標準曲線見圖2。
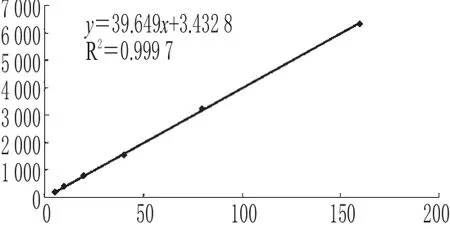
圖2 培養液-ADM標準曲線Fig 2 The calibration curves of adriamycin in cell culture media
2.5.2 HL60/ADM細胞內液-ADM標準曲線的制備 取0.5 mL空白細胞液數份,在ADM標準品粉末中加入不同量蒸餾水,制備濃度為160、80、40、20、10、5 μg·mL-1的ADM細胞樣品各5份,按“2.4.2”項下“取培養上清液”開始操作,進行HPLC分析。以HL60/ADM細胞內液中ADM檢測濃度(X)為橫坐標,峰面積積分值(Y)為縱坐標,進行線性回歸,得回歸方程為Y=41.465X-40.751(r=0.999 8)。結果表明,HL60/ADM細胞內液中ADM檢測濃度在5~160 μg·mL-1范圍內與其峰面積積分值呈良好線性關系,檢測限為0.1 μg·mL-1(S/N=3)。HL60/ADM細胞內液-ADM標準曲線見圖3。

圖3 HL60/ADM細胞內液-ADM標準曲線Fig 3 The calibration curve of adriamycin in HL60/ADM intracellular fluid
2.5.3 精密度與回收率試驗 制備濃度為160、40、5 μg·mL-1的ADM標準品溶液各5份,按“2.4.2”項下“取培養上清液”開始操作,同日內測定5次,連續測定5 d,進樣10 μL進行分析,考察方法的精密度與回收率。結果,平均回收率在98.20%~97.25%范圍內,RSD≤1.73%;日內、日間RSD均≤2.81%。
2.6 樣品采集
收集HL60/ADM細胞和處理組細胞,調整細胞密度為106個/mL,接種10 mL細胞懸液至100 mL培養瓶內,2種細胞分別接種3瓶,加入ADM使最終濃度為200 μg·mL-1。于加藥后1、3、6 h分別收集分離的細胞和上清液,細胞用生理鹽水清洗3次,計數,然后根據每瓶不同的活細胞數量,加入適量的生理鹽水,調整細胞濃度為107個/mL。按反復凍溶法裂解細胞,即將細胞在-20℃以下凍存,室溫溶解,反復3次,直至細胞凍溶液中無完整細胞,離心,取上清液作為細胞內液。取培養上清液或細胞內液0.5 mL,參照“2.4.2”項下“取培養上清液”開始操作,進樣測定其ADM濃度。
2.7 統計學方法
試驗數據采用±s表示,采用Origin 7.5軟件(OriginLab data analysis and graphing software)進行統計學分析,組間差異比較采用t檢驗。P<0.05表示有統計學差異。
3 結果
3.1 蟾酥注射液對HL60/ADM細胞生長的影響
HL60/ADM細胞經5個濃度梯度的蟾酥注射液處理后,細胞生長均受到不同程度抑制,且隨著藥物濃度的增加,抑制作用越明顯。選取HL60/ADM細胞存活率在0.9以上的最大濃度作為蟾酥注射液的逆轉劑量,即0.03 μg·mL-1。不同濃度蟾酥注射液對HL60/ADM細胞fu的影響見表1。
表1 不同濃度蟾酥注射液對HL60/ADM細胞fu的影響(±s,n=3)Tab 1 Effects of different concentations of Chansu injection on fu of HL60/ADM cell(±s,n=3)
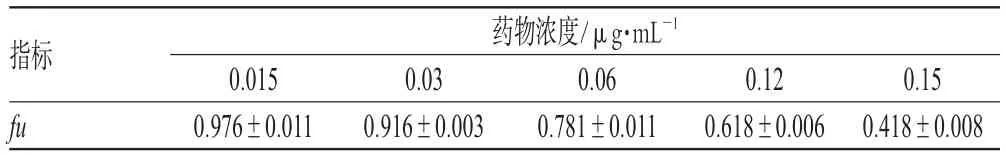
表1 不同濃度蟾酥注射液對HL60/ADM細胞fu的影響(±s,n=3)Tab 1 Effects of different concentations of Chansu injection on fu of HL60/ADM cell(±s,n=3)
指標fu藥物濃度/μg·mL-1 0.015 0.976±0.011 0.03 0.916±0.003 0.06 0.781±0.011 0.12 0.618±0.006 0.15 0.418±0.008
3.2 蟾酥注射液逆轉作用測定
對照組和處理組的fa均隨著ADM濃度增大而增加。根據Logit法計算出對照組IC50為19.83 μg·mL-1,處理組的IC50為9.86 μg·L-1,對照組IC50為處理組IC50的1.960 9倍。不同濃度ADM對HL60/ADM細胞fa的影響見表2。
表2 不同濃度ADM對HL60/ADM細胞fa的影響(±s,n=3)Tab 2 Effects of adriamycin with different concentrations on fa of HL60/ADM cell(±s,n=3)

表2 不同濃度ADM對HL60/ADM細胞fa的影響(±s,n=3)Tab 2 Effects of adriamycin with different concentrations on fa of HL60/ADM cell(±s,n=3)
與對照組比較:*P<0.01vs.control group:*P<0.01
組別對照組處理組藥物濃度/μg·mL-1 39.90 69.75±0.97 90.17±1.05*2.49 6.31±1.04 6.45±1.12 4.99 12.25±0.88 33.40±5.76*9.96 35.16±1.01 54.62±0.39*18.95 49.66±8.54 70.27±2.67*
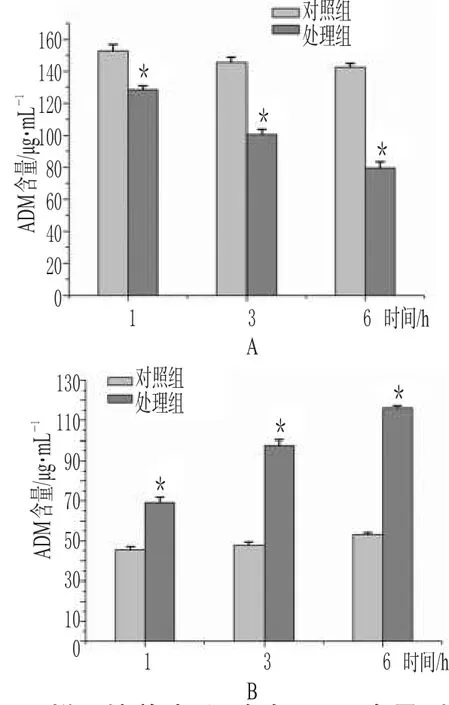
圖4 樣品培養液、細胞中ADM含量測定結果A.樣品培養液;B.細胞內液與對照組比較:*P<0.01Fig 4 Content determination of sample medium and intracelluar adriamycinA.sample culture medium;B.intracelluar fluid vs.control group:*P<0.01
3.3 HPLC法測定細胞內、外ADM的濃度
分別取對照組和處理組在不同時間點(1、3、6 h)的樣品溶液各0.2 mL,每組3份,按“2.4.2”項下“取培養上清液”開始操作,進樣50 μL做HPLC分析,比較各組細胞內、外ADM的含量。隨著時間的延長,處理組中進入HL60/ADM細胞內的ADM逐漸增加,而HL60/ADM培養液中ADM藥物濃度逐漸減少,表明蟾酥注射液能夠增強耐藥細胞攝取ADM的能力,與對照組細胞內ADM濃度比較有顯著性差異(P<0.01)。樣品培養液、細胞中ADM含量測定結果見圖4。
4 討論
化療是白血病治療的主要手段,即使是各種異基因和自體造血干細胞移植,其療效前提仍要求腫瘤細胞對放療、化療敏感,而MDR的產生卻嚴重影響了白血病化療的療效,是造成白血病復發和難治的主要原因。MDR產生的原因十分復雜,是多因素共同作用的結果,目前研究得較多的是生化耐藥和凋亡耐藥。生化耐藥指腫瘤細胞的遺傳性及生化特性發生變化,致使細胞通過不同途徑對藥物產生耐藥性,以腫瘤細胞內藥物濃度降低為特征;凋亡耐藥是指腫瘤細胞抗凋亡能力增強,對藥物的敏感性降低。尋求一種有效的MDR逆轉藥物對提高白血病化療效果十分關鍵。
本研究通過細胞毒性試驗發現,蟾酥注射液能明顯抑制HL60/ADM細胞的生長,且存在劑量依賴性,隨著蟾酥注射液濃度的升高,HL60/ADM細胞fu逐漸減少,這說明蟾酥注射液是一種有效的腫瘤抑制藥物。筆者選取fu>0.9的最大濃度即非細胞毒性劑量濃度(0.03 μg·mL-1)作為誘導細胞的逆轉劑量。進行體外試驗發現,與對照組比較,ADM對HL60/ADM細胞增殖的抑制作用明顯增強(P<0.05),蟾酥注射液能部分逆轉HL60/ADM細胞對ADM的耐藥性,其逆轉倍數為1.960 9倍。這些研究結果初步表明,蟾酥注射液可能既是一種有效的抗腫瘤藥物,又是一種耐藥逆轉藥物。因此,當與化療藥物聯合進行白血病化療時,一方面可以通過自身的抗腫瘤作用抑制白血病細胞的生長;另一方面還可以通過逆轉白血病細胞的耐藥性,提高其對化療藥物的敏感性,從而減小化療藥物的劑量,降低對機體的毒副作用。
MDR的逆轉機制是十分復雜的,其中一個主要途徑可能是通過下調細胞膜糖蛋白P170的表達,使其將化療藥物泵出細胞外的功能受到抑制,從而使化療藥物在白血病細胞內達到有效濃度,從而抑制白血病細胞的生長[8,9]。本研究采用HPLC法測定HL60/ADM細胞內、外的ADM濃度,結果顯示在1、3、6 h經蟾酥注射液處理的HL60/ADM細胞內ADM含量,均較未經處理的細胞內ADM含量高,且隨時間延長濃度增加更明顯,而培養液中ADM含量則相反。提示蟾酥注射液可通過增加細胞內藥物濃度來逆轉HL60/ADM對ADM的耐藥作用,機制可能與細胞藥物轉運泵有關,但具體的作用機制還有待進一步的研究。
[1]薛 芳,成志勇,楊 琳,等.白血病耐藥細胞系U937/ADR的建立及其生物學性狀[J].中國生物工程雜志,2009,29(7):17.
[2]馬武開.中醫藥逆轉白血病多藥耐藥的機制探微[J].世界中西醫結合雜志,2008,3(4):229.
[3]Norgaard JM,Olesen LH,Hokland P.Changing picture of cellular drug resistance in human leukemia[J].Crit Rev Oncol Hematol,2004,50(1):39.
[4]Hill S,Rein DT,Riffelmann M,et al.Anticancer drugs induce mdr l gene expression in recurrent ovarian cancer[J].Anticancer Drugs,2006,17(9):1 041.
[5]彭向前,張文會,李 軍,等.氧化苦參堿逆轉多藥耐藥細胞系K562PAO2耐藥性的研究[J].中國腫瘤臨床,2008,35(19):1 127.
[6]葉愛芳,尹麗慧,熊術道,等.苦瓜蛋白逆轉K562PAO2細胞多藥耐藥性的研究[J].中國臨床藥理學與治療學,2009,14(7):766.
[7]李貴新,徐功立,姜夕鋒,等.蟾酥注射液抑制白血病HL-60細胞增殖及誘導其凋亡實驗研究[J].山東中醫雜志,2002,21(7):424.
[8]Mahadevan D,List AF.Targeting the multidrug resistance-1 transporter in AML:molecular regulation and therapeutic strategies[J].Blood,2004,104(5):1 940.
[9]朱寶英,黃 靜,王永林,等.P-糖蛋白及腫瘤多藥耐藥的逆轉[J].中國藥房,2011,22(6):550.

