我國上市藥品規格的標準化表達方法研究Δ
王妍,胡澤利,黃平(.重慶藥品交易所,重慶40000;.四川美康醫藥軟件研究開發有限公司,成都6004)
目前已上市藥品的規格存在格式不統一、用詞模糊、表達方式多樣的問題,給藥品的生產、流通、臨床使用和監督管理都造成很大的困難。藥品規格是藥品制劑的重要屬性之一,2010年版《中國藥典》(二部)凡例第二十條對化學藥制劑規格解釋為:“系指每一支、片或其他每一個單位制劑中含有主藥的重量(或效價)或含量(%)或裝量。注射液項下,如為‘1m l∶10mg’,系指1m l中含有主藥10mg;對于列有處方或標有濃度的制劑,也可同時規定裝量規格”[1]。
藥品規格不僅涉及制劑的生產和藥品的檢驗等,更重要的是涉及醫師、藥師、護理人員、患者正確使用藥品的問題;特別是隨著非處方藥(OTC)政策的實施,許多藥品由患者直接購用,因此,藥品規格的標準化顯得尤為重要[2]。
1 藥品規格現狀及其危害
目前,在國家食品藥品監督管理局(SFDA)網站上公布的藥品信息以及各種來源的藥品說明書中,其對于規格的描述均存在格式不統一、表述方式多樣等缺陷,藥品規格的不規范表現形式主要有以下幾種:(1)對藥品規格無準確的定義。如生產企業為了吸引消費者,將藥品總量標注為藥品規格的現象普遍存在。(2)在進行表述時用詞模糊,難以理解。如藥品規格與包裝規格混為一談,“基片重”、“片芯重”、“素片重”等的含義不明確。(3)大量復方制劑(尤其是中成藥)無明確的規格描述[3]。(4)對同一種規格存在多種表述方式。甚至有少數廠家,在藥品規格上做文章,以小規格冒充大規格,從而誤導消費者。如某種維生素E制劑,在包裝盒正面醒目處標示:100mg×30粒;而在包裝盒反面規格處標示:每丸(重)100mg含維生素E 5mg。
藥品規格的不規范表述,還會帶來不規范的藥品生產程序,可能導致對生產出來的成品無法進行檢驗;可能存在的藥品個體裝量或重量不符合規定,又會導致藥品在臨床使用過程中出現療效不穩定、毒副反應增大等隱患[4]。為了維護醫藥市場的正常秩序,保護消費者合法權益,打擊藥品銷售活動中的欺詐行為,對藥品規格進行標準化表達十分必要。對此,筆者提出以下建議。
2 藥品規格標準化規則
2.1 基本原則
規格標準化表達的基本原則示例見表1。
在進行標準化處理前,刪除原文在規格項中出現的非規格文字,如:“復方”、“致密粉”、“原料藥(口服)”、“無”。標準化處理的基本原則包括以下幾個方面:1)規格的表述應盡量簡潔,去掉不必要的文字;2)所有的括號、數字和連接線等,都統一采用半角輸入,如表1的①;3)原文中為2條及以上的規格的,需要人工拆分成1條記錄對應1個規格;4)對于解釋性的文字,都放到含藥量的后面,如表1的④;5)規格單位盡量用符號表示,而不是用中文,如表1的⑤;6)規格中的數字應盡量避免小數點之前僅為0,使用單位換算來解決該類問題,如表1的⑥;7)原規格是表示每瓶、每粒時,只要不會產生歧義,就需要刪除,如表1的⑦;8)括號的使用規則為:最內小括號,次之中括號,再次之大括號;9)規格中帶分子式或者有效成分的,需要轉換成中文,如表1的⑧;10)原規格中對同一種規格有多種表述方式且其中一種表述方式可通過規格其他部分換算時,僅保留其他部分而不需要保留可換算出的部分,如表1的⑨,其原規格中的質量體積百分比20%為換算出的部分,可刪除。
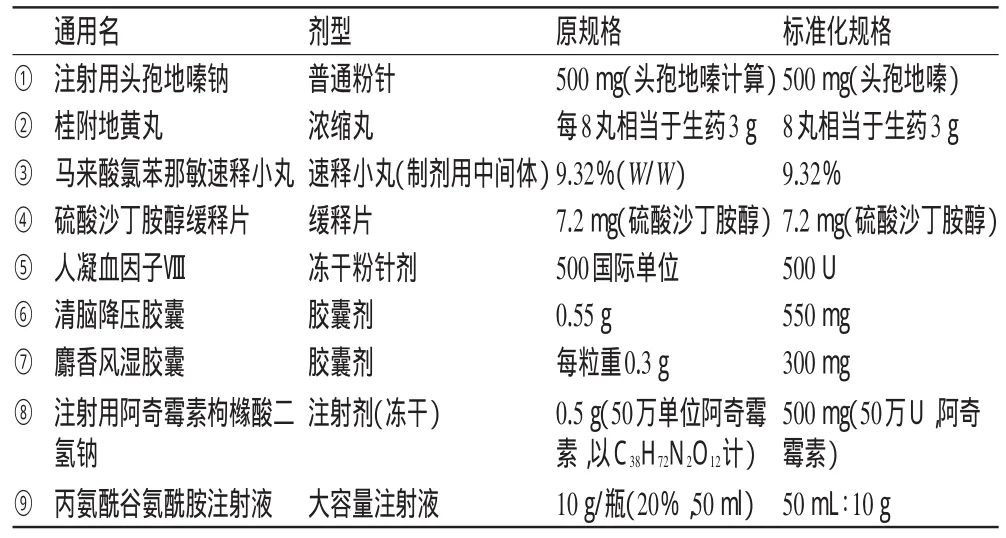
表1 規格標準化表達的基本原則(示例)Tab 1 Basic princip les of specifications standardization(examp les)
2.2 化學藥品
2.2.1 單成分化學藥品。單成分藥品規格的標準化表達規則示例見表2。
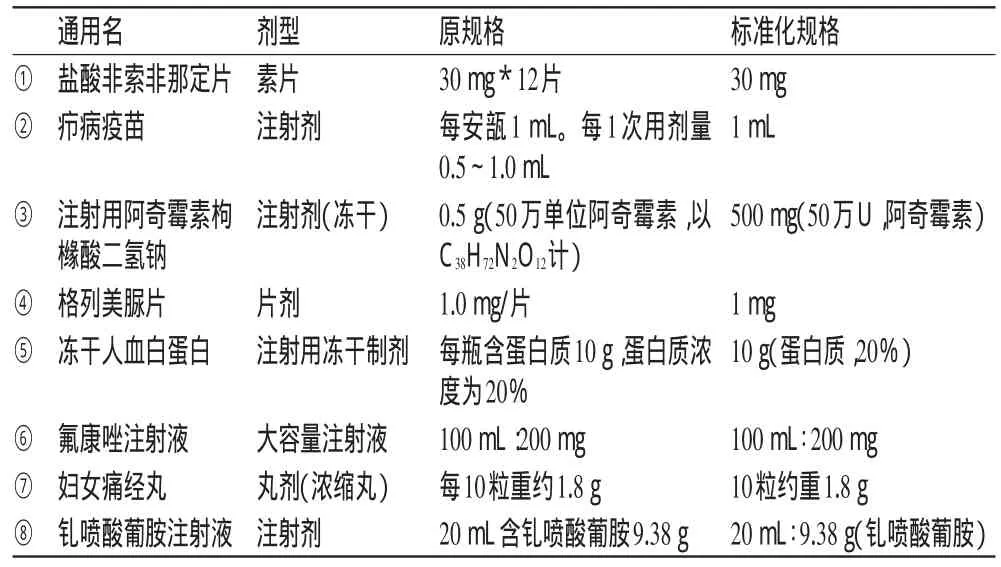
表2 單成分化學藥品的規格標準化表達(示例)Tab 2 Specifications standardization of single composition chemicals(examp les)
標準化遵循的原則為:Ⅰ.單劑量最小包裝,不寫出包裝名稱,只寫出規格含量即可,如表2的①;Ⅱ.如果藥品為散裝化學品或是一種單純的化學物質,一般只在當其含量不是100%時才標出其規格;Ⅲ.1條記錄只有1個規格,但1個規格有不同表示方式時不可拆分,而需全部寫出,并且將較常見的規格表示方式放到前面,將相對不常見的放到括號里,如表2的③;Ⅳ.規格中的“約”、具體的成分名或者分子式等,不可省略,如表2的⑦;Ⅴ.表示藥品規格時,不將藥品規格和包裝規格合并在一起表示,如表2的①;Ⅵ.如寫出每個單劑量包裝中一部分體積或容量的具體含藥量,則對應的體積(容量、含量)不可省略,需要用比號間隔,比號左邊是體積(容量、含量),右邊是具體的含藥量,如表2的⑧。
2.2.2 復方制劑。復方制劑是指含2種或2種以上藥物成分的制劑,其規格標準化示例見表3。

表3 復方制劑化學藥品的規格標準化表達(示例)Tab 3 Specifications standardization of chemicals compound preparation(examp les)
如果該復方制劑的規格是總量,沒有分別列出各成分的含量,其表示法與單成分藥品相同。如果復方制劑的各成分規格均有詳細說明,其標準化需要遵循以下原則:Ⅰ.多成分藥品各個成分的規格及規格單位分別用半角橫杠“-”連接,順序與通用藥物中各成分的順序一致,如表3中的①;Ⅱ.如果1個復方藥品含有3種以上成分(不包括3種),各組成成分不變但各成分含量比例未明確標明時,用藥品總規格表示此復方藥品的規格,但不顯示各成分規格,如表3中的⑤;Ⅲ.如果同時寫出全部的含藥量和各成分各自的含藥量,則總量放到比號前面,具體含藥量放到比號后面,且各成分含藥量之間用半角括號和半角“-”來連接,如表3中的④;Ⅳ.多個成分按其含量的數字從小到大排序,不按原文寫出的成分先后進行排序,如表3的③。
2.3 生物制品
生物制品規格的表示方式與化學藥品大體相同,其規格標準化示例見表4。

表4 生物制品的規格標準化表達(示例)Tab 4 Specifications standardization of biological products(examp les)
需要特別說明的是:1)若原規格字段中除了規格內容外,還包括用量或復溶后的量,則在進行標準化時僅提取規格,其他內容均不保留,如表4的②;2)原規格中有“細菌”、“活菌”等內容時,需要保留,如表4的④;3)部分生物制品的最小裝量即為一次使用劑量,在規格表述時并沒有標明其具體的含量、重量或體積等,僅闡述了其使用的量,在進行標準化時,保留該部分數據,如表4的①。
2.4 中成藥
由于中成藥的成分較復雜,其規格的表示方式較多,標準化的原則較復雜,具體規則見表5。
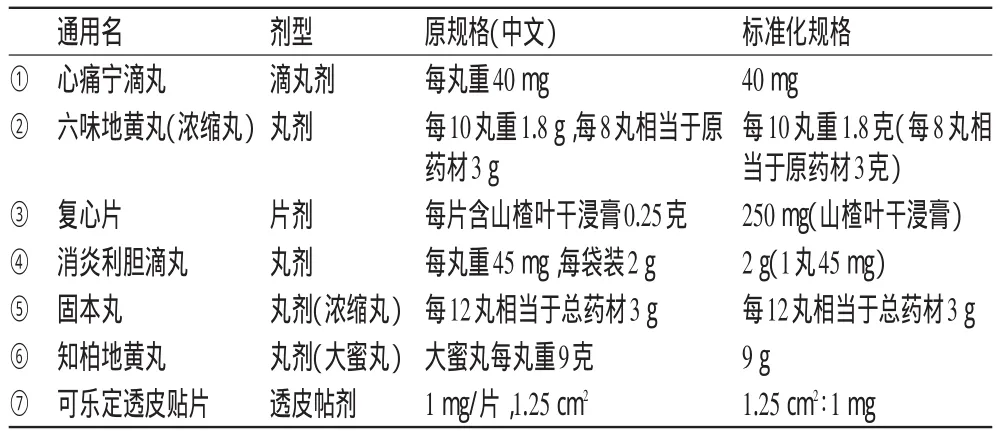
表5 中成藥的規格標準化表達(示例)Tab 5 Specifications standardization of Chinese patentmedicine(exam p les)
1)如果寫出最小包裝的單劑量,則直接寫出劑量即可,如表5的①;2)如果寫明的重量不是最小產品分割單位的,則保留原文,如:“每4丸重0.8克”,則標準化為“4丸重0.8 g”,一般來說這種情況下1次服也是服4丸,所以不需要人工計算成1丸的重量;3)如果在規格原文中寫出了劑型,且該劑型比劑型一列的劑型更詳細,則就更新劑型的內容,而不是將劑型寫到規格中,如表5的⑥;4)貼劑除用重量或含藥量作為規格外,還有可能用面積作規格,如果是后者,不用將面積的邊長單位進行換算,但邊長盡量寫成整數,而不寫成小數;此外,為了表述的一致性,數字的排列順序應由小到大,如表5的⑦;5)中成藥中會出現該劑量的中成藥相當于多少量的中藥材原藥的情況,這種情況下需要保留,如表5的⑤;6)如果標出的重量有特殊說明,這種特殊說明也要保留,如表5的④;7)如果規格用2句話表達2個含義,但其實是同一個規格時,需要合并起來表述,如表5的②。
2.5 特殊制劑規格
某些特殊制劑(如噴霧劑、滴劑、涂藥器制劑等)可用“滴”、“匙”、“噴”、“涂”、“吸”、“劑”來作為規格單位。如每支20噴,可表示為20噴;每支30滴,可表示為30滴等。如果藥品對每噴、每匙、每涂含多少藥物都表示得很清楚時,應用“mg/噴”、“mg/涂”、“m L/匙”等表示方法。這種情況下不可省略“/”后的內容。但要注意,將格式改成用比號表示的方式,如“1撳∶125μg”。
用于便攜式靜脈輸液給藥的溶液藥品,是以在總液體容量中含總藥物量來表示規格的。這樣,這些藥品的規格可以與在醫院或家庭護理中所用的常規格式一致。如某便攜式輸液60 mg/60 m L,同樣使用比號,標準化結果為“60 mg∶60 m L”。
某些藥品可能是將幾種藥物放在1個盒子(KIT)里作為1個商品來出售,此時可以將其作為一個復方藥來對待,規格及規格單位的表示方法同一般復方藥物。
某些特殊的藥品包裝中可能既有皮試液又有注射液,因此規格中會有2項,不能進行拆分。如天花粉蛋白注射液,規格就是“注射液1m l∶1.2mg,皮試1m l∶50μg”,應標準化為“1 m L∶1.2mg(注射液)-1m L∶50μg(皮試液)”。注意,注射液放前面,皮試液放后面,2項規格中用半角連字符分隔。
3 規格分組原則及標準
為了區分繁多的規格,滿足藥品規格在交易、統計分析等方面的需求,對規格進行2個層面的分組。
首先,根據規格的計量單位進行劃分,分類包括但不限于質量、體積、濃度、面積、體積∶質量、體積∶體積、質量-體積等,如表6所示。
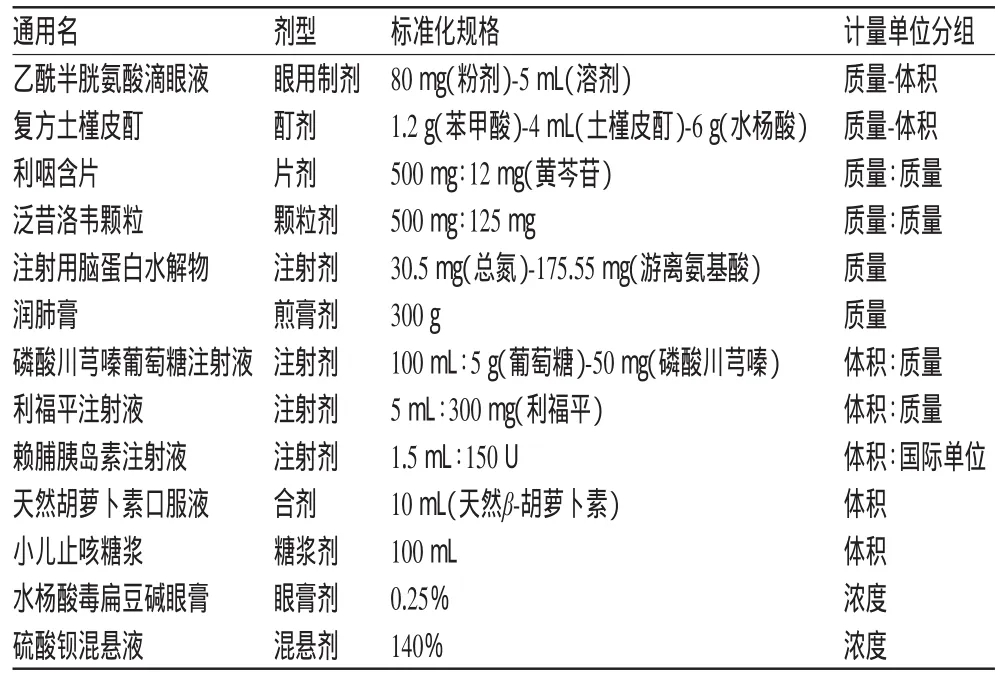
表6 規格中計量單位分組標準化表達(示例)Tab 6 Standardized expression ofmeasurementsunitgrouping of specifications(examp les)
其次,大部分規格與其劑型有一定的聯系,如片劑和丸劑的規格一般都為質量。因此將規格與劑型分組建立了一定的對應關系,如表7所示。
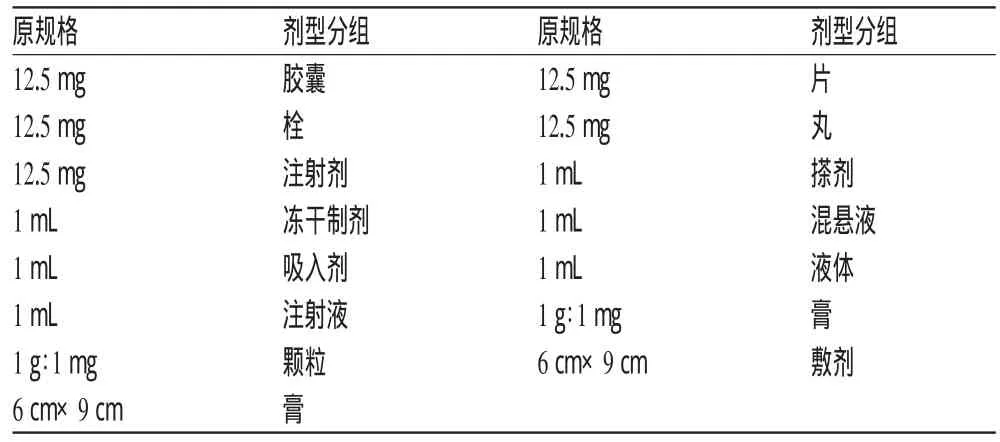
表7 規格中劑型分組的標準化表達(示例)Tab 7 Standardized expression of dosage form grouping of specifications(examp les)
4 藥品規格標準化及分組的意義
數據標準化處理的優點體現在以下幾個方面:(1)由于沒有冗余和被忽視的數據,因此能夠保證數據的完整性、簡潔性和直觀易懂;(2)由于標準后的數據可生成快速而有效的鏈接,因此可優化各種查詢和統計分析方法;(3)由于經標準化處理后,規格的標準項中數據較少且格式統一,可更高效地創建索引和排序;(4)標準化處理后的表與原始數據表相比,索引更少,能夠更快地更新相關數據。
規格標準化處理的意義主要體現在以下幾個方面:(1)藥品監管部門可更高效地對藥品的規格進行監督和管理,避免生產企業在進行新藥申請、新增規格補充申請等方面由于規格表述不一致造成相關部門工作量的增加[5,6];同時,使相關部門對于規格相關的數據的統計分析更加準確和方便。(2)在藥品生產方面,有利于生產企業對同種或同類藥品的規格進行比較和分析,從而優化生產過程,在某種程度上使我國的藥品質量得到提高。(3)在藥品交易方面,有利于買方評價不同生產企業的同種藥品的性價比,通過市場機制優勝劣汰,使我國藥品逐步走向合理化和公平化[6]。(4)在藥品使用方面,有利于醫藥學工作者和患者自身對藥品的選擇及對藥品用量進行評估,確保用藥安全、可靠,減少患者的經濟負擔,避免差錯事故的發生[6]。(5)為其他醫藥學數據的規范化和標準化處理提供了經驗。通過藥品已知不良反應的處理工作,歸納總結經驗,針對基礎數據的收集、整理、應用和升級維護,形成較為完善的技術操作規則和工作流程,為今后醫藥學數據的處理建立了一個可持續發展的、日常性的工作機制。
綜上所述,藥品規格的正確表達,不僅在臨床用藥時計算準確的給藥量、保證用藥的安全有效方面有著至關重要的意義,同時在藥品流通經營過程中,標準化的藥品規格結合包裝單位,為正確表示藥品數量、價格奠定了基礎。
[1]國家藥典委員會.中華人民共和國藥典(二部)[S].2010年版.北京:中國醫藥科技出版社,2010:15.
[2]吳朝旭.藥品說明書和標簽中的規格需規范[J].醫藥與保健,2009,17(8):162.
[3]劉業飛.當前“藥品規格”中存在的突出問題[C].天津:2010年中國藥學大會暨第十屆中國藥師周論文集,2010:2 509.
[4]翟培良,錢春梅.藥品規格與安全性和經濟性探討[J].西北藥學雜志,1998,13(3):136.
[5]張國民.增加藥品規格和包裝規格要合理[DB/OL].http://dlib.cnki.net/kns50/detail.aspx?dbname=ccnd2004&filename=YIYA200408142216.2004-08-14.2011-12-31.
[6]鄧蘇平.基本藥物品規亟需規范[J].中國藥房,2010,21(44):4 129.

