鴨瘟病毒YZH株的分離鑒定及其TK基因的序列分析
余愛花,楊 陽,張寶來,谷長勤,張萬坡,程國富,胡薛英*
(1.華中農業大學動物醫學院,湖北武漢430070;2.天津市津南區動物疾病預防控制中心,天津300350)
鴨瘟是鴨、鵝及多種雁形目動物的一種急性、高致死率的傳染病[1],又稱鴨病毒性腸炎。在我國廣大養鴨地區該病多見于成年種鴨和蛋鴨,主要表現感染鴨軟弱、下痢、流淚和部分病鴨出現頭頸部腫脹;食道黏膜出血或潰瘍,泄殖腔黏膜出血與壞死,肝出血或有壞死灶[2]。目前該病的診斷主要依賴流行病學、臨床癥狀和剖檢變化及病毒的分離、鑒定。該病的病原為鴨瘟病毒(Duck plague virus),屬皰疹病毒科α皰疹病毒亞科,核酸為線狀雙股DNA[3]。國內外學者對鴨瘟病毒引起的病理變化和鴨瘟病毒的抗原定位有較多的研究,如Francisco J等[4]較為詳細地研究了鴨瘟病毒感染水禽引起的各組織病理變化;Plummer P J等[5]根據UL6段保守區序列并設計引物,進行PCR擴增,得到相應片段;胡薛英等[6]應用單克隆抗體的免疫組織化學法研究雛鴨體內鴨瘟病毒的分布;謝芝勛等[7-8]對鴨瘟病毒核酸進行PCR檢測,結果良好。
目前對鴨瘟病毒基因結構及功能的研究比較少,僅報導了部分毒株的UL6,UL7基因,TK基因,聚合酶基因的克隆和測序[9-12]。胸苷激酶(thymidine kinase,TK)基因是皰疹病毒的主要毒力基因和病毒增殖的非必需基因[13],其編碼產物胸苷激酶是嘧啶生物合成補救途徑中所必需的酶。它可使胸腺嘧啶磷酸化為dTMP,然后繼續磷酸化成為dTTP,參于病毒DNA的合成,在神經組織感染及潛伏性感染中具有重要作用[14-15]。研究TK基因的結構及其編碼蛋白為進一步研究鴨瘟病毒的致病機理奠定基礎。
1 材料與方法
1.1 材料
試驗用動物櫻桃谷鴨2周齡,購自武漢市畜牧獸醫科學研究所,未進行任何免疫接種及藥物治療;DNA病毒基因組提取試劑盒為北京索萊寶科技有限公司產品;PCR反應PremixTaqDNA聚合酶,DNA Marker D L 2 000均為寶生物工程(大連)有限公司產品。
1.2 方法
1.2.1 病料采集和處理 病料采自湖北省武漢市某養鴨場送檢20日齡商品代櫻桃谷肉鴨,病死率90%。采集送檢病鴨的肝組織病料剪碎,按1∶5的比例加入滅菌PBS(0.2mol/L,pH 7.2)勻漿,6 000 r/min離心20min,取上清液,220nm微孔濾膜過濾,用滅菌的PBS稀釋20倍后作為接種材料。
1.2.2 鴨瘟病毒TK基因的序列分析
1.2.2.1 病毒DNA的提取 分別取送檢死亡鴨的肝臟和空白組剖殺鴨的肝臟,加滅菌PBS于研磨器中研磨,后置于1.5mL中反復凍融3次,6 000 r/min離心15min,取上清液備用。嚴格按照DNA病毒基因組提取試劑盒說明書操作。
1.2.2.2 引物設計與合成 根據GenBank上發表的DPV序列,使用Primer5.0設計引物,由上海英駿生物技術有限公司合成了如下引物。上游引物:5′-TCACTGCGCGACTCTTGCGAACG-3′;下 游引 物: 5′-ATTAATTGTCATCTCGGTATTGTATT-3′。目的片段為1 077bp,使用前將引物稀釋、分裝、置-20℃保存備用。
1.2.2.3 PCR擴增 對影響PCR的主要條件進行優化,包括退火溫度(50℃~60℃)和引物濃度(0.1μmol/L~0.6μmol/L)。最佳PCR擴增反應體系采用25μL反應量:2×PremixTaqDNA聚合酶12.5μL;上游引物(10mmol/L)1.0μL;下游引物(10mmol/L)1.0μL;模板2.0μL;滅菌超純水8.5μL;總體積25.0μL。根據梯度PCR擴增結果,目的片段的最適退火溫度為50℃,擴增條件為:95℃5min;94℃1min,50℃1min,72℃1min,33個循環;72℃7min;10℃60min。產物于1.0 g/L瓊脂糖凝膠中電泳,檢測擴增情況。
1.2.2.4 測序與序列分析 純化回收PCR產物,將回收產物送上海英駿生物技術有限公司測序,使用DNA Star軟件將YZH-TK序列與GenBank上已發表的鴨瘟病毒TK基因序列進行比對分析。
1.2.3 動物回歸試驗 12羽健康雛鴨分為2組,攻毒組6只,每只接種0.2mL病毒稀釋液。對照組6只,每只接種0.2mL滅菌的PBS。隔離飼養,觀察。待雛鴨死亡時,剖檢并記錄病變,采取組織病料用100mL/L福爾馬林溶液固定,常規石蠟包埋、切片,蘇木素-伊紅(HE)染色,顯微鏡觀察。取胸腺,2.5mL/L戊二醛溶液固定,備做透射電鏡觀察。
2 結果
2.1 DEV的PCR鑒定
用設計合成的鴨瘟病毒TK基因核苷酸序列擴增引物,對DPV基因組進行PCR擴增后,電泳顯示在1 000bp附近有一條帶出現,與預計片段大小(1 077bp)相符(圖1)。

圖1 鴨瘟病毒TK基因PCR擴增產物Fig.1 PCR products of duck plague virus TK gene
2.7 鴨瘟病毒TK基因序列的測定分析
所鑒定的病毒與GenBank發表的序列AY963569進行比較,同源性可達到99.16%。與GenBank上已發表的鴨瘟病毒TK基因序列AY911509、EF173464、AY963569、DQ640611 和EF053033鴨瘟病毒UL23序列、人皰疹病毒TK基因序列EU541367、鶉雞皰疹病毒1型TK基因序列AY741134、獼猴皰疹I型病毒TK基因序列EF426678做遺傳進化樹分析,結果表明,此次分離到的病毒與已發表的幾株鴨瘟病毒TK基因在同一分枝,且同源性均可達到99%,其推導的氨基酸序列同源性均可達96%以上(圖2和圖3)。
2.1 動物回歸試驗
2.1.1 臨床癥狀和剖檢病變 接種后3d,攻毒組鴨表現流淚,整群雛鴨表現精神沉郁,匍匐,不愿站立。接種后4d到第8天,攻毒組共死亡4羽。剖檢死亡鴨可見肝腫大,質脆,表面有彌散性大小不一的出血點和灰白色壞死灶(圖4);脾臟極度腫脹,胰腺有白色壞死點;腸道漿膜面可見紅色環狀出血帶,亦可見針尖大小的紅色斑點(圖5)。法氏囊有出血點。而對照組無異常。

圖2 皰疹病毒中TK基因序列編碼氨基酸的遺傳進化樹分析Fig.2 The Phylogenetic tree analysis of deduced amino acid sequenees of TK gene in Alphaherpesvirinae

圖3 皰疹病毒中TK基因推導氨基酸的同源性比較Fig.3 Homology comparison of deduced amino acid sequences of TK gene in Alphaherpesvirinae
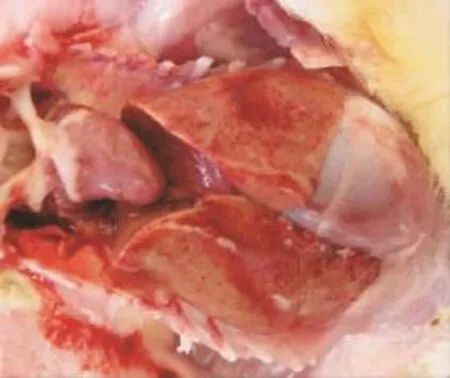
圖4 感染雛鴨的肝臟Fig.4 The liver of infected ducklings

圖5 感染雛鴨的腸道Fig.5 The intestine of infected ducklings
2.1.2 組織切片觀察 肝臟:感染后肝細胞發生水泡變性、脂肪變性,中央靜脈周圍有炎性細胞的浸潤。壞死灶分布廣泛,呈均質紅染無結構狀,壞死灶中出現異嗜性粒細胞的浸潤,并有少量吞噬了異物的巨噬細胞,有出血病變。
十二指腸:黏膜上皮細胞壞死脫落,固有層至肌層可見淋巴濾泡增生,濾泡中的淋巴細胞有排空現象,并出現壞死;黏膜下層表現出血病變(圖6)。
食道:黏膜上皮細胞變性、壞死,固有層、黏膜下 層組織有出血和水腫(圖7)。
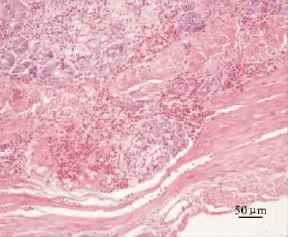
圖6 感染雛鴨的腸道(HE)Fig.6 The intestine of infected ducklings

圖7 感染雛鴨的食道(HE)Fig.7 The oesophageal of infected ducklings
法氏囊:感染后黏膜上皮細胞脫落,固有層水腫,淋巴濾泡髓質發生凝固性壞死;皮質中淋巴細胞數量急劇減少,網狀細胞增多,出現巨噬細胞;固有層發生水腫、出血;嚴重時,髓質區淋巴濾泡失去固有結構,只剩下一些網狀結構和少量淋巴細胞。
2.1.3 電鏡觀察 接種病毒后7d,可見胸腺中有的細胞內線粒體腫脹,胸腺中有多個壞死細胞,在壞死崩解的細胞中觀察到直徑100nm~180nm,有囊膜圓形的病毒粒子(圖8)。

圖8 胸腺中可見病毒粒子Fig.8 The viral particles in thymus
3 討論
鴨瘟病毒感染造成的病死率和病變有較大的差異。家養鴨感染的總病死率為5%~100%不等。臨床臨床以急性敗血癥過程為特征,表現為精神沉郁,兩腿麻痹,下痢,流淚和部分病鴨頭頸腫大[16]。該病為一種廣泛嗜全身性感染的傳染病。本試驗人工感染病例表現肝臟的腫大、壞死和出血;胸腺,法氏囊,食道黏膜出血等病理變化,與報道的鴨瘟的臨床癥狀,病理變化等相一致[5];在胸腺透射電鏡結果中可觀察到球形,直徑100nm~180nm,有囊膜,圓形的病毒粒子,與報道的鴨瘟病毒粒子的形態相符[17]。因此確診此次送檢的病例為鴨瘟病毒感染。在易感動物體內,病毒在法氏囊、胸腺、脾臟和肝臟的上皮細胞和巨噬細胞內進行增殖[1],因此本研究采樣胸腺作為電鏡檢測病毒的材料。
DPV自然易感宿主僅限于鴨、鵝和天鵝,7日齡到成年種鴨均可感染[1],因此本研究中感染動物主要為雛鴨,雛鴨感染的病理變化呈現出典型的鴨瘟病毒感染的特征[1]。
本試驗根據已發表鴨瘟病毒TK基因片段的序列,設計合成引物,利用PCR特異地擴增出1 077 bp片段。將該基因片段的序列與已報道序列比較發現,二者的同源性為99.16%。與GenBank上已發表的鴨瘟病毒TK基因序列AY911509、EF173464、AY963569、DQ640611和 EF053033鴨瘟病毒UL23序列、人皰疹病毒TK基因序列EU541367、鶉雞皰疹病毒1型TK基因序列AY741134、獼猴皰疹I型病毒TK基因序列EF426678做遺傳進化樹分析,發現其與AY911509、EF173464、AY963569、DQ640611序列同源性均大99%,氨基酸同源性分別為97.2%、97.6%、97.6%、97.7%。
TK蛋白有2個活性中心,分別是位于N端的ATP結合結構域DGPYGTGK和核苷酸結合結構域DRH。ATP結合結構域代表皰疹病毒TK蛋白的核心序列,它形成了一個疏水的袋狀構象,以便與ATP腺嘌呤環結合。而在DPVTK基因的兩個活性中心分別位于31位~39位和133位~135位,其中的3個氨基酸殘基(G)中的1個發生突變,則會影響TK蛋白的構象及其與APT的結合,導致TK蛋白功能喪失而致弱[18-19]。本研究中根據TK基因序列推導出的核苷酸序列中兩個活動中心序列ATP結合結構域和核苷酸結合結構域未發生改變,而其第6位氨基酸由S(Ser)變為F(Phe),從第12開始到22氨基酸序列都發生了改變,這種改變是否會對病毒蛋白翻譯和毒力產生影響還有待于進一步研究。
[1] Sandhu T S,Shawky S A.Duck virus enteritis(duck plague)[M]//Saif Y M ,Barnes H J,Glisson J R,et al.Diseases of Poultry.11thed.Ames:Iowa State U-niversity Press,2003:354-363.
[2] 甘孟侯.中國禽病學[M].北京:中國農業出版社,1999.107-119.
[3] 郭玉璞,蔣金書.鴨病[M].北京:北京農業大學出版社,1988:21-28.
[4] Francisco J.Histopathological and ultrastructural changes associated with herpesvirus infection in waterfowl[J].Avian Pathol,2000,31:133-140.
[5] Plummer P J.Detection of duck enteritis virus by polymerase chain reaction[J].Avian Dis,1998,42:554-564.
[6] 胡薛英,谷長勤,程國富,等.應用單克隆抗體的免疫組織化學法研究雛鴨體內鴨瘟病毒的分布[J].中國預防獸醫學報,2006,28(3):320-322.
[7] 謝芝勛,謝志勤,劉加波,等.用聚合酶鏈反應檢測鴨瘟病毒的研究[J].中國獸藥雜志,2000,34(4):10-12.
[8] 郭宵峰,廖 明,嚴英華,等.利用PCR檢測鴨瘟病毒[J].中國獸醫科技,2002,32(4):13-16.
[9] 李昌主,韓先杰,鄒 玲,等.鴨瘟病毒AV1221株TK基因的克隆與序列分析[J].青島農業大學學報:自然科學版,2007,24(3):162-164.
[10] 馬秀麗,宋敏訓,李玉峰,等.PCR用于鴨瘟病毒診斷的研究[J].中國預防獸醫學報,2005,27(5):408-411.
[11] 郭霄峰,廖 明,辛朝安,等.鴨瘟病毒北京株UL6和UL7基因的克隆及序列測定[J].畜牧獸醫學報,2002,33(6):615-618.
[12] 王紅海,胡薛英,蘇敬良,等.商品肉鴨鴨瘟病毒的分離與鑒定[J].中國預防獸醫學報,2006,28(1):105-108.
[13] 王 琳,楊潤德,陳麗君,等.偽狂犬病病毒冀A株TK基因的克隆及序列分析[J].動物醫學進展,2007,28(4):29-33.
[14] 張桂紅,童光志,王 柳,等.傳染性鼻氣管炎病毒TK基因缺失株的構建[J].中國預防獸醫學報,1999,21(4):275-277.
[15] 吳德銘,羅滿林,黃毓茂,等.偽狂犬病毒粵A毒株TK基因的擴增/克隆與序列測定[J].華南農業大學學報,2002,23(3):71-73.
[16] 許媛媛.鴨瘟的動態病理學研究和鴨CD4的克隆[D].湖北武漢:華中農業大學碩士學位論文,2010.
[17] 郭宇飛,程安春,汪銘書,等.鴨瘟病毒的純化及電鏡負染形態觀察[J].中國獸醫科學,2008,38(5):393-396.
[18] 劉文波,周 斌,黃 兵,等.傳染性喉氣管炎病毒煙臺株TK基因序列測定及TK蛋白功能初步分析[J].西農林科技大學學報:自然科學版,2005,33(10):75-79.
[19] 宋得華,潘華奇,黎應勝,等.鴨瘟病毒TK基因及其編碼蛋白的生物信息學分析[J].安徽農業科學,2007,35(31):9935-9936.

