卵黃高磷蛋白的純化及其對RAW264.7生長形態的影響
呂瑜峰,王亮,張佳慧,帖航,孫佩佩,吳子健
(天津商業大學生物技術與食品科學學院,天津市食品生物技術重點實驗室,天津 300134)
卵黃高磷蛋白(phosvitin,PVS)是蛋黃中主要的磷蛋白,約占蛋黃蛋白質的 7%[1],有 α-PVS(37、42 、45 Ku)和 β-PVS(45 Ku)兩種,其中 β-PVS 含量較 α-PVS多[2]。PVS具有獨特的物化特性,其分子中磷的含量約10%,是已知蛋白質中磷酸化程度最高的,主要原因在于其分子中約50%的氨基酸殘基是絲氨酸殘基,且90%絲氨酸殘基被磷酸化[3]。正是由于其高度磷酸化性質,使其具有很強的乳化性、抗氧化性、殺菌性以及金屬離子螯合力(蛋黃中所含的約95%的鐵離子與其結合)[4]。
目前PVS的分離純化大致可分為兩步,先是從蛋黃中分離出PVS粗品,然后采用層析技術進一步純化。然而,現有的方法常使用非食品級的有機溶劑來實現PVS與脂質的分離,會改變PVS結構,且不適合在食品工業上的應用[1-7]。Castellani等采用 Mg2+來沉淀 PVS,雖然未用有機溶劑,但提取過程過于繁瑣且耗時[8]。近來,Ko等[9]利用乙醇和鈉鹽建立了一種可以大規模提取PVS的方法,其回收率可達到97%,但所得產品純度不高。本文旨在采用陰離子交換層析提高PVS產品的純度并進一步研究其對RAW264.7細胞生長的影響。
1 材料與方法
1.1 材料及試劑
雞蛋:市售;1-氨基-2萘酚-4-磺酸:沃凱;Coomassie R250:sigma;SDS-PAGE標準品:Fermentas;Q SepharoseTMFastFlow強陰離子交換樹脂:GEHealthcare;小鼠巨噬細胞RAW264.7:中科院上海細胞庫;胎牛血清:GBICO;DMEM培養基:Hyclone;其它試劑為國產分析純。
1.2 主要儀器與設備
UDK-159全自動凱氏定氮儀:意大利VELP公司;WFZ800-D3B紫外可見光分光光度計:北京瑞利;CXG-1電腦恒溫層析柜:上海滬西;PowerPacTMUniversal電泳儀電源:美國BIO-RAD;3-18K離心機:德國sigma;NIKON eclipse TS100—F倒置成像顯微鏡:日本;Heraeus HERAcell 240i二氧化碳培養箱:美國。
1.3 方法
1.3.1 PVS的分離
PVS制備采用Ko的方法[9],略改進,具體如下:鮮蛋黃100 g加2倍體積水于4℃下攪拌30 min,然后離心30 min(4 000 g、4℃);所得沉淀加入4倍體積85%的乙醇后均質2 min(3 000 r/min),再離心10 min(4 000 g、4℃),重復此脫脂過程3次;所得脫脂沉淀用9倍體積10%的NaCl溶液浸提,并調pH至4.0,于 4 ℃下攪拌 30 min后離心30 min(4 000 g、4℃),上清再經透析、凍干即得PVS粗品(PVi)。
1.3.2 PVS的純化
Q Sepharose FF(QSFF)離子交換層析(φ1.0 cm×10 cm,填充高度8 cm)純化PVS。平衡緩沖液為NaAc/HAc(20 mmol/L、pH 5.0、0.3 mol/L NaCl),樣品溶于平衡緩沖液中,上樣體積3 mL(10 mg/mL),采用0.4 mol/L~0.6 mol/L NaCl的濃度梯度進行分步洗脫,流速1 mL/min。
1.3.3 氮、磷含量的測定
凱氏定氮法測定氮含量和蛋白質含量;磷含量測定采用鉬藍法[10-11]。
1.3.4 SDS-PAGE電泳[9]
1.3.5 PVS回收率和純度測定
按Ko的方法測定PVS的回收率[9],純度采用N/P摩爾比來衡量,其值越小表明純度越高[12]。
1.3.6 PVS對RAW246.7細胞的影響
RAW264.7按ATCC方法培養[13]。取對數期細胞接種于96孔培養板,加入終濃度為10、100、800 μg/mL的PVS,對照組為卵清白蛋白(OVA)或牛血清白蛋白(BSA)。培養24 h,于倒置顯微鏡下觀察細胞形態(200×)。
2 結果與分析
2.1 純化PVS的結果
QSFF離子交換層析分離純化PVi,其中用0.3、0.5、0.6 mol/L NaCl溶液洗脫時分別得到3個組分(即A、B和C組分),層析圖譜為圖1,而0.4 mol/L NaCl洗脫時,流出液無紫外吸收變化(數據未顯示)。A組分為穿透峰,其蛋白質N/P摩爾比8.2(表1),經電泳檢測(圖2)該組分含分子量較高的HDL和分子量較低的蛋白,且低分子量蛋白組分中含有α1-PVS;圖1還顯示B組分為主要的蛋白組分;組分C相對含量很少;合并組分B和C并經電泳檢測(圖2)表明其含有β-PVS、α1-PVS 和 α2-PVS 3 種 PVS,幾乎沒有雜蛋白,即得到純化的 PVS(PVp)。
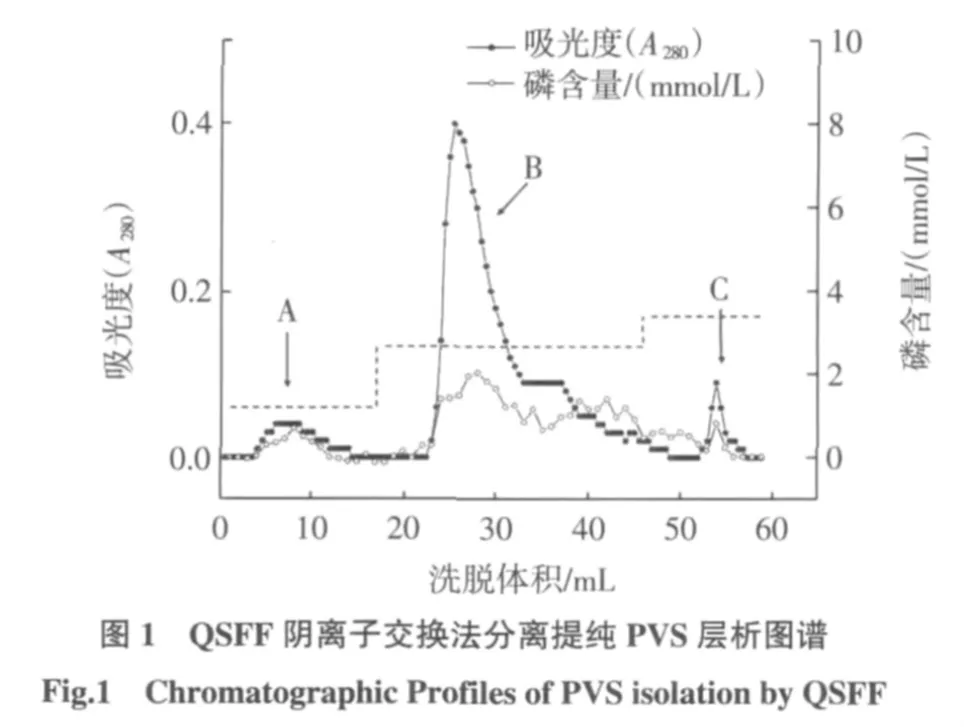
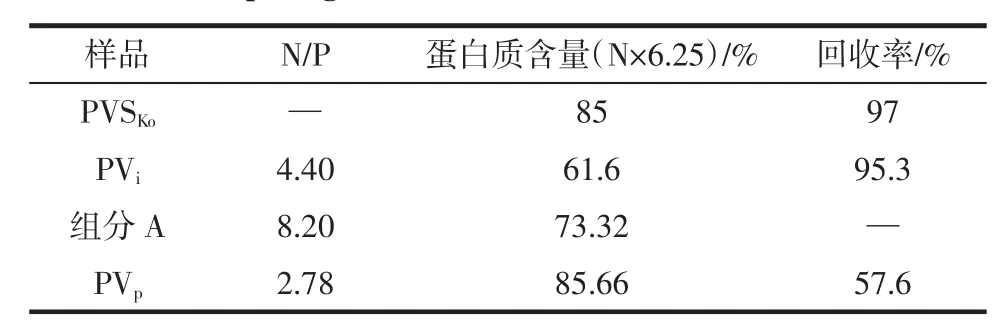
表1 PVS蛋白質檢測結果比較Table1 ComparingmeasurementresultsofobtainedPVStoKo′s
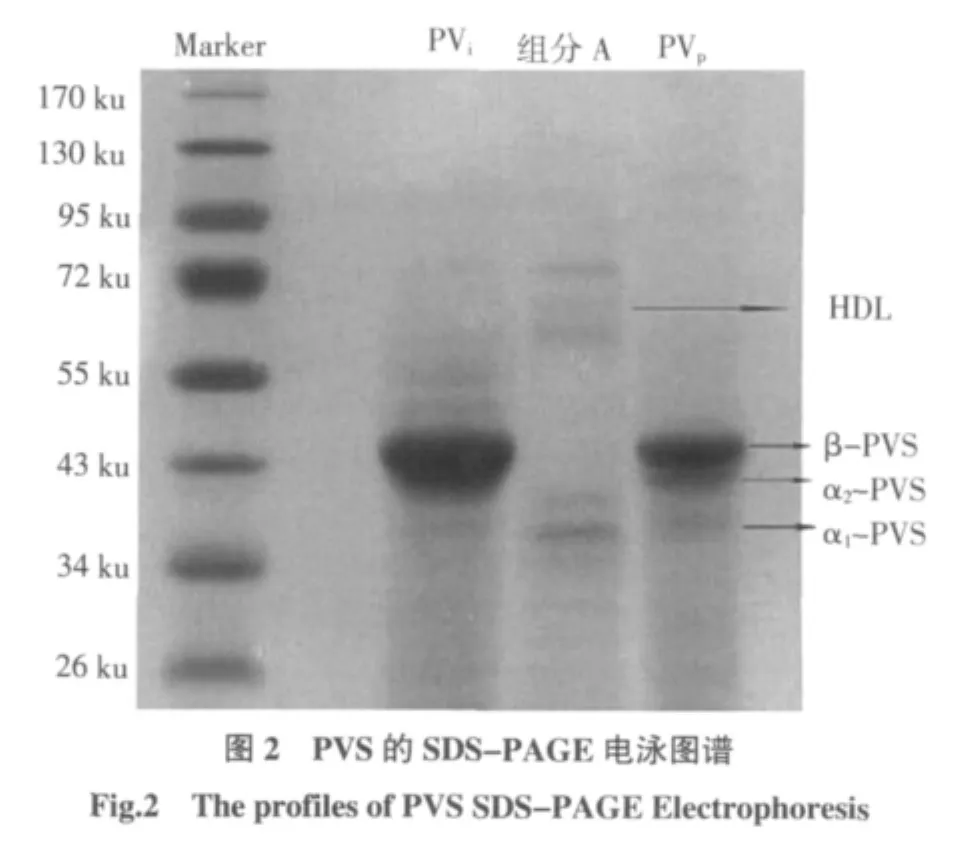
檢測得到的PVS的蛋白質含量及其N/P比以及本工藝的蛋白回收率,并與Ko等的方法得到的結果(PVSKo)進行比較。比較結果由表1可知,PVi產品回收率與PVSKo相近,但蛋白質含量卻遠低于PVSKo。PVi其N/P摩爾比為4.40,約為sigma標準品N/P(2.49)的1.8倍;但經純化后,PVp的N/P摩爾比為2.78,回收率57.60%,蛋白質含量也大幅提高(85.66%)。再同其他國內外學者的分離提取該蛋白的結果相比較:張小偉[14]等采用PEG來提取PVS后經QSFF純化,回收率僅為47%;而Castellani采用DEAE離子交換柱僅回收了42.5%的PVS,盡管純度很高(98%);Bo Lei等將蛋黃做簡單處理后直接利用離子交換層析提取PVS,其產物的N/P摩爾比為2.44,但回收率僅為35.4%[15]。因此本工藝兼顧了PVS的純度和回收率(表1)。
2.2 PVS對RAW246.7細胞的影響
單核/巨噬細胞遍布于機體并在第一時間識別外源性物質,即能發揮先天免疫作用,也是連接先天免疫防御和獲得性免疫應答的重要樞紐[16]。RAW264.7是源于小鼠的巨噬細胞系,在無抗原刺激的靜息狀態下呈體積較小的類圓形;但當受到外源刺激時,其體積會變大,伸出大量偽足,伴有炎癥反應,見圖3。
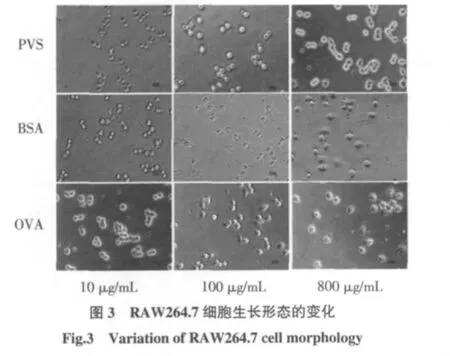
圖3表明,隨著BSA和OVA濃度的增加,RAW264.7細胞的形態發生劇烈變化,幾乎所有的細胞被活化;但是,PVS組即便是在800 μg/mL的高濃度下,絕大多數細胞的形態仍處于靜息狀態。形學觀察表明,PVS可維持RAW264.7細胞處于靜息狀態,不會引起細胞向炎癥巨噬細胞形態的轉變。
3 結論
1)QSFF陰離子交換層析純化PVS的條件:平衡緩沖液為 NaAc/HAc(20 mmol/L、pH 5.0 、0.3 mol/L NaCl)、0.3 mol/L~0.6 mol/L NaCl不連續分步洗脫;終產品(PVp)N/P摩爾比為 2.78,回收率 57.6%,蛋白質含量85.66%。
2)在考察劑量范圍內,PVS未引起RAW264.7細胞的細胞培養形態向炎癥巨噬細胞形態的轉變。
:
[1]Mecham D K,H S Olcott Phosvitin.The principal phosphoprotein[J].Am Chem Soc,1949,71(11):3670-3679
[2]Abe Y,T Itoh,S Adachi.Fractionation and characterization of hen′s egg yolk phosvitin[J].Food Sci,1982,47(6):1903-1907
[3]Clark R C.The primary structure of avian phosvitins.Contributions through the Edman degradation of methylmercaptovitins prepared from the constituent phosphoproteins[J].The international journal of biochemistry,1985,17(9):983-988
[4]Grogan J,Taborsky G.Iron binding by phosvitin:variation of rate of iron release as a function of the degree of saturation of iron binding sites[J].Journal of inorganic biochemistry,1986,26(4):237-246
[5]Wallace R A,Morgan J P.Chromatographic resolution of chicken phosvitin,Multiple macromolecular species in a classic vitellogeninderived phosphoprotein[J].The biochemicaljournal,1986,240(3):871-878
[6]Losso J N,Bogumil R,Nakai S.Comparative studies of phosvitin from chicken and salmon egg yolk[J].Comparative biochemistry and physiology B,Comparative biochemistry,1993,106(4):919-923
[7]Choi I,Jung C.Effectiveness of phosvitin peptides on enhancing bioavailability of calcium and its accumulation in bones[J].Food chemistry,2005,93(4):577-583
[8]Castellani O,Martinet V,David-Briand E,et al.Egg yolk phosvitin:preparation of metal-free purified protein by fast protein liquid chromatography using aqueous solvents[J].Journal of chromatography B,Analytical technologies in the biomedical and life sciences,2003,791(1/2):273-284
[9]Ko K Y,Nam K C,Jo C,et al.A simple and efficient method for preparing partially purified phosvitin from egg yolk using ethanol and salts[J].Poultry science,2011,90(5):1096-1104
[10]陳慶森,龐廣昌,吳子健.實用生物化學實驗技術指導[M].天津:天津科學技術出版社,2006:83-85
[11]Bartlett G L.Phosphorus assay in column chromatography[J].Biol Chem,1959,234:466-468
[12]R W Burley,W H Cook.Isolation and composition of avian egg yolk granules and their constituent α- and β-lipovitellins[J].Canadian journal of biochemistry and physiology,1961,39(8):1295-1307
[13]ATCC.Product Details[S/OL].http://www.atcc.org/ATCCA dvanced CatalogSearch/ProductDetails/tabid/452/Default.aspx?ATCCNum=TIB-71&Template=cellBiolog
[14]Zhang X,Qiu N,Geng F.Simply and effectively preparing high-purity phosvitin using polyethylene glycol and anion- exchange chromatography[J].Journalofseparationscience,2011,34(22):3295-3301[15]Lei B,Wu J.Purification of egg yolk phosvitin by anion exchange chromatography[J].Journal ofchromatographya,2012,1223(0):41-46
[16]HumeDA.Themononuclearphagocytesystem[J].CurrOpin Immunol,2006,18(1):49-53

