木質纖維稀酸水解物微生物代謝抑制物的生物降解*
吳黎明,周玉恒,陳海珊,張厚瑞
1(中國科學院廣西植物研究所,廣西 桂林,541006) 2(廣西師范大學生命科學學院,廣西桂林,541004)
木質纖維稀酸水解物微生物代謝抑制物的生物降解*
吳黎明1,2,周玉恒1,陳海珊1,張厚瑞1
1(中國科學院廣西植物研究所,廣西 桂林,541006) 2(廣西師范大學生命科學學院,廣西桂林,541004)
稀酸是木質纖維素水解生成可發酵性糖的重要催化劑,但會伴隨產生大量的微生物代謝抑制物,嚴重影響水解物的可發酵性。文中介紹了發酵抑制物的種類、形成機理、代謝毒理,以及不同抑制物的生物降解途徑與生物脫毒方法的研究進展,在此基礎上對其發展方向作了進一步分析。
木質纖維素水解物,代謝抑制物,生物降解
木質纖維素是地球上最豐富的可再生資源,將木質纖維素水解為可發酵性單糖,并進一步用于發酵生產包括燃料乙醇在內的各類化工產品,被認為是人類社會應對未來石化資源短缺問題的重要途徑[1]。
稀酸是木質纖維素水解的重要催化劑。不僅是經典的稀酸水解工藝必須使用酸,即便被認為是最為環保的原料預處理——酶法水解工藝中,稀酸水解仍然被認為是改善木質纖維素酶水解性能最有效的預處理措施。然而,木質纖維素稀酸水解過程會伴隨生成一系列非糖小分子化合物,這些化合物對微生物代謝有明顯的抑制作用,要改善木質纖維水解物的發酵性能,除去這些代謝抑制物是必不可少的。雖然某些物理、化學方法如離子交換、活性炭、吸附樹脂、石灰沉淀等處理措施可在一定程度上去除抑制物[2],但均存在脫毒不徹底,成本高,甚至產生新的污染物等問題。
研究發現,某些類型的微生物對此類代謝抑制物有良好的降解活性,因此,篩選具有降解抑制物活性的微生物,或者構建具有降解抑制物活性的代謝工程菌株,被認為是解決木質纖維素水解物中發酵抑制物問題的有效途徑。木質纖維素水解物的生物脫毒方法正受到越來越多的關注。本課題在了解微生物代謝抑制物的種類、形成機理、代謝毒理的基礎上,重點研究不同抑制物的生物降解途徑,以及生物脫毒方法的研究進展,并分析其發展方向。
1 代謝抑制物的來源
木質纖維素稀酸水解過程生成了一系列復雜的微生物代謝抑制物,已經鑒定的抑制物成分超過35種。根據其化學性質可將其歸為3大類,即脂肪酸、呋喃和芳香類化合物[3]。
脂肪酸,主要包括甲酸、乙酸和丙酸,它們主要來自于半纖維素的脫乙酰基反應,或由糖類降解生成。呋喃類,主要包括糠醛、5-羥甲基糠醛,是糖類在酸性條件下受熱脫水的產物,它們進一步降解也生成脂肪酸(圖1)。芳香類,主要是單環芳香族類化合物,如愈創木酚、香草醛、阿魏酸等,是木質素的降解產物。
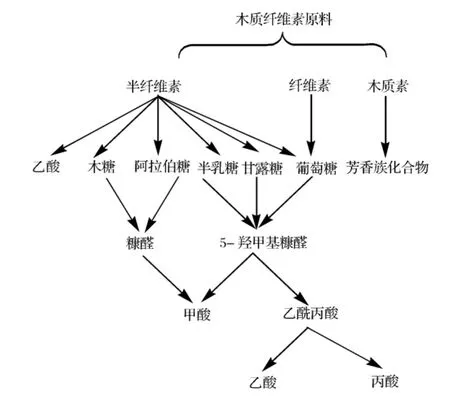
圖1 木質纖維素水解過程的反應[3]
根據抑制物的生成途徑可見,一些抑制物是由水解得到的可溶性單糖進一步分解而成。很明顯,比較溫和的水解條件可減輕糖類物質受熱分解,也同時減少木質素的降解,減少抑制物生成的總量。
2 代謝抑制物的毒理
2.1 脂肪酸
脂肪酸主要抑制細胞的生長及抑制DNA等大分子的合成,它們可通過被動運輸和主動運輸兩種方式轉運入細胞;被動運輸包括自由擴散和協助擴散,不帶電荷或未被解離的有機酸主要通過這種方式轉運;而主動運輸則包括截然不同的兩個體系:泵和透性酶。泵體系主要與應激反應過程有關,可將積累于細胞質內的酸根陰離子排出胞外;透性酶主要與代謝,尤其是非發酵性碳源利用過程有關[4]。
脂肪酸一旦進入細胞,由于胞內中性環境,促使其不斷地解離,從而破壞了胞內外的濃度梯度,導致膜電位降低。為了維持膜電位恒定,細胞必須通過泵將胞內積累多余的離子排出胞外,從而導致ATP大量消耗而又不能及時得到補充,使得細胞內用于正常代謝的ATP供應不足,從而引起一些必需的酶、輔酶及一些營養物質的缺乏,使得細胞代謝緩慢,最終引起細胞死亡[5-6]。
根據這樣的機理,脂肪酸對微生物生長的抑制作用顯然與環境pH相關,如果提高發酵液的pH,則意味著分子態脂肪酸濃度相應降低,那么微生物對代謝的抑制強度應當減弱。事實也的確如此。Zaldivar等[7]在研究纖維素水解產物中各種有機酸對菌體生長及發酵的抑制作用時發現,各種脂肪酸對于Escherichia coli LY01(大腸桿菌)的抑制強度隨pH的升高而減弱。
經艷等[8]發現,甘蔗葉汽爆液中的12種揮發性發酵抑制物,在自然pH條件下均對釀酒酵母(Saccharomyces cerevisiae)細胞生長產生明顯的抑制作用,但可通過提高pH值能有效降低四碳以下脂肪酸對酵母細胞生長的毒害作用。劉勝男等[9]報道,將發酵體系pH升高,盔形畢赤酵母(Pichia galeiforms B-10)即可連續氧化代謝水解物中的脂肪酸。方祥年等[10]研究發現將半纖維素水解液中的起始pH值提高,可有效降低乙酸對假絲酵母發酵生產木糖醇的抑制作用,且木糖醇的得率及生產速率也有顯著提高。
2.2 呋喃類
糠醛和5-羥甲基糠醛(HMF)是水解物中2種主要呋喃類代謝抑制物,以主動運輸的方式進入細胞內,它對微生物的主要抑制機制有:(1)具有強的疏水性,因而能夠破壞細胞膜,進入細胞內的糠醛能抑制一些與糖代謝有關的酶,比如乙醇脫氫酶、乙醛脫氫酶和丙酮酸脫氫酶的活性,從而抑制發酵[11]。(2)酵母可利用NAD(P)H將糠醛還原成糠醇,但轉化過程導致了輔酶的大量消耗,造成與木糖代謝競爭利用輔酶的不平衡;而且一些抗氧化蛋白也因可利用的輔酶減少而失活,使得酵母細胞易受氧化性破壞[12]。
此外,呋喃類化合物還是一種誘變劑,可使正常DNA的一條單鏈在A和T堿基處易發生斷裂,從而影響RNA和蛋白質的合成[13]。
2.3 芳香類
芳香類物質由木質素降解生成,主要包括芳香酸、芳香醛、芳香醇3大類。它們的結構穩定且不易分解,對于同樣的官能團,在芳香類化合物中產生的毒性比在脂肪酸和呋喃類中產生的毒性大。因此芳香類物質的抑制作用比較強,且低分子量的毒性更大[3]。研究發現,芳香類物質的毒性主要與其疏水性有直接的聯系,即疏水性越大的物質,其對細胞膜的破壞也大,則毒性也就越強[14]。
香草醛作為芳香醛類的代表,它能破壞細胞膜的完整性,從而影響發酵微生物E.coli MC1022的正常生長。研究發現,在培養E.coli MC1022的培養基中添加50 mmol/L的香草醛,能在1 h內,可使29%正常的E.coli MC1022細胞膜破壞。這主要是香草醛是一種細胞膜的活性物質,從而導致細胞膜對K+、H+、Na+、Ca2+等離子的通透性增加。由于化學滲透平衡遭到破壞,使得細胞質內外pH值的穩定性破壞、膨脹壓失衡、與呼吸鏈有關酶的活性降低,最終導致細胞產ATP受到不利的影響而抑制發酵微生物的正常生長[15]。
3 降解途徑
制定正確的生物脫毒技術策略,以及制定新型生物脫毒活性菌株的構建技術方案,都需要弄清脫毒活性微生物對抑制物的代謝途徑。
3.1 脂肪酸類
甲酸,乙酸,丙酸作為短鏈脂肪酸的代表性化合物,它們在一些微生物中的代謝途徑都已闡明。
甲酸:以自由擴散的不解離形式運入細胞內,然后在胞內外pH濃度梯度和甲酸脫氫酶的作用下,在胞內解離成HCOO-和H+,最終并入三羧酸循環,生成CO2,而H+則在ATP提供的能量下被泵出細胞外,以維持胞內外的pH濃度平衡[16]。
乙酸:在葡萄糖存在的情況下,拜耳接合酵母Zygosaccharomyces bailii ISA 1307分2個階段代謝乙酸:第一階段,在乙酰輔酶A和蘋果酸脫氫酶的作用下同時消耗葡萄糖和乙酸;當葡萄糖被消耗完后,進入到第二個階段,即Z.bailii ISA 1307在異檸檬酸裂解酶、磷酸烯醇式丙酮酸羧化酶和第一階段兩個酶的聯合作用下繼續同化剩余的乙酸[17]。
丙酸:釀酒酵母(S.cerevisiae)可以同時代謝葡萄糖與丙酸,但單獨用丙酸培養卻不能成功。2-甲基檸檬酸途徑是釀酒酵母丙酸代謝的主要途徑。進入胞內的丙酸首先與輔酶A結合,生成丙酰輔酶A(Propionyl-CoA),然后生成2-甲基檸檬酸,最后并入三羧酸循環。2-甲基檸檬酸合成酶是釀酒酵母丙酸代謝途徑中的關鍵酶[18]。
3.2 呋喃類
大量的研究證明,糠醛在微生物體內的第一步反應主要是還原為毒性較低的糠醇。糠醛的培養物中大量積累糠醇即是最好的證明。不過,如果用糠醇培養微生物,則發現有糠酸生成。由此可見,糠醛→糠醇→糠酸是大多數微生物的降解途徑。糠酸積累之后,一般降解速率就很低了。顯然,糠酸是糠醛降解的限速步驟。
不同微生物具有不同的代謝方向,一些微生物只能轉化成糠醇或糠酸,一些則同時具有兩個方向的代謝系統[19]。目前研究的比較清楚的是Pseudomonas putida Fu-1(惡臭假單胞菌Fu-1)的糠醛代謝途徑,該菌株可以將糠醛代謝為糠酸和糠醇,其中糠酸的進一步走向是:首先在糠酰CoA合成酶作用下形成2-糠酰-CoA,然后在脫氫酶催化下生成5-羥基-2-糠酰-CoA,最終進入到三羧酸循環[20](如圖2)。

圖2 P.putida Fu-1代謝糠醇的生物氧化途徑[20]
5-羥甲基糠醛(HMF)是另一種重要的呋喃類抑制物。據報道,釀酒酵母(S.cerevisiae)和樹干畢赤氏酵母(Pichia stipitis)在脫氫酶的作用下,都可將HMF大部分還原成毒性較低的2,5-二羥甲基糠醇,而2,5-二羥甲基糠醇的連續積累并不影響細胞的增長和乙醇的產量[21]。
3.3 芳香類
白腐菌是降解芳香類化合物的重要微生物,藜蘆醇被作為白腐菌降解木質素生成的芳香類化合物的模型進行研究。白腐菌降解木質素與其產生的漆酶(Lac)、木質素過氧化物酶(LiP)和錳過氧化物酶(MnP)3種胞外酶有著直接的聯系。
白腐菌黃孢原毛平革菌(Phanerochaete chrysosporium)可以有效降解藜蘆醇,70%~90%的藜蘆醇主要被LiP催化氧化生成藜蘆醛,此外開環產物約占20%,醌/氫醌約占10%[22]。
藜蘆醇(VA)降解的開環產物可以經過2種途徑形成,這主要與其催化酶的種類有關,其中涉及MnP等催化氧化過程。在碳限制時,開環產物可被快速完全地降解為CO2,而在氮限制時,VA降解緩慢且不完全,開環產物則以內酯的形式積累。
LiP、Lac催化藜蘆醇時甲氧基被取代可產生醌及氫醌結構,醌可由醌還原酶還原成氫醌,然后再經兒茶酚途徑開環,最終被代謝為CO2。其降解途徑如圖3所示。
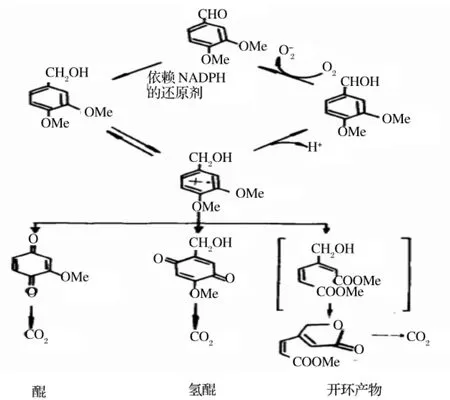
圖3 P.chrysosporium代謝藜蘆醇的途徑[22]
4 脫毒活性微生物
實現纖維水解物生物脫毒的關鍵是篩選,或者構建出高活性的脫毒菌株。這是纖維水解物生物脫毒技術的關鍵。
4.1 自然活性微生物脫毒
雖然,工業發酵所用的微生物菌株可能對某種抑制物有一定的耐受性或降解能力,但只有那些能夠在不經特殊脫毒處理的水解物環境中正常生長,對3大類毒物均具有降解活性,并且不會顯著消耗水解物中的糖類,有效改善水解物的發酵性能的菌株才能稱脫毒活性微生物。
某些微生物對纖維水解物具有脫毒活性的現象已經由不同的實驗室證實。真菌木生錐毛殼的Coniochaeta ligniaria NRRL30616能夠利用糠醛、5-羥甲基糠醛、芳香脂肪酸、芳香醛作唯一碳源生長,在葡萄糖存在的條件下優先利用糠醛和5-羥甲基糠醛,因而對纖維水解物有良好的脫毒效果[23]。東方伊薩酵母Issatchenkia orienalis CCTCC M 2006098對糠醛、乙酸、愈創木酚均具有突出的降解活性,但不利用半纖維水解液中的木糖。經東方伊薩酵母處理過的半纖維素水解物用于木糖醇發酵,產物生成速率比對照提高1.97倍[2]。真空濃縮過的蔗渣水解物用西方伊薩酵母Issatchenkia occidentalis CCTCC M 206097脫毒發酵24 h,抑制物香草醛,阿魏酸,糠醛,5-羥甲基糠醛分別減少66.67%,73.33%,62%,85%[24]。貪銅菌屬的細菌Cupriavidus basilensis HMF14能以5-羥甲基糠醛為唯一碳源,并且能夠將麥秸稈水解液中的其他抑制物糠醛、乙酸、甲酸及芳香類毒物降解代謝,且幾乎完全不利用水解液中的阿拉伯糖、木糖、葡萄糖[25]。軟腐菌具有降解乙酸、糠醛和芳香酸類化合物的能力,經過蒸汽預處理過的柳樹半纖維素水解液,然后利用絲狀軟腐菌Trichoderma reesei發酵木糖生產乙醇的效率能提高3倍[26]。
而林蘭英[27]等從甘蔗渣汽爆水解物中篩選的庫德畢赤酵母(Pichia kudriavzevii D-6)、西方畢赤酵母(Pichia occidentalis C-4)及P.galeiformis B-10,各自對水解物中已經鑒定出的12種毒物均有降解活性,這3個脫毒菌株以不同組合接入水解物進行混合脫毒,其脫毒效果有明顯提高,其中B-10+C-4,及3菌株組合的脫毒方式,處理后的水解物的發酵性能可以達到純木糖的發酵水平,比未經脫毒處理的水解液的木糖醇生成速率提高了近6倍。
4.2 代謝工程菌
近年來,研究者們開始著眼于人工構建具有脫毒活性,同時具備良好發酵性能的代謝工程菌,來解決發酵木質纖維素水解液過程的毒代謝抑制物問題。
S.cerevisiae NRRL Y-50049是一株基于親本S.cerevisiae NRRL Y-12632酵母菌改造的新型產乙醇重組代謝工程菌,它能耐受較高濃度的糠醛及5-羥甲基糠醛,并在輔酶NAD(P)H的介導下將它們還原為其相應的醇類化合物[28]。
將樹干畢赤酵母(P.stipitis)的兩個甲酸脫氫酶基因,FDH1和FDH2導入釀酒酵母(S.cerevisiae),所構建的重組菌同時兼具高甲酸耐受性和發酵木糖高產乙醇的優良特性[29]。
E.coli LY01,是運動發酵單胞菌(Zymomonas moblis)編碼丙酮酸脫酸酶的基因(pdc)和乙醇脫氫酶Ⅱ的基因(adhB)整合到E.coli B上的代謝工程菌,對多種抑制物有一定耐受性,包括來自木質素降解的阿魏酸、4-羥基苯甲酸和香草酸等芳香酸,還包括甲酸、乙酸、乙酰丙酸、己酸等小分子脂肪酸及糠醇、愈創木酚、香草醇等7種醇類抑制物[7],最終達到同時發酵木糖和葡萄糖并高產酒精的效果[30]。
5 討論
纖維水解物的生物脫毒已經證實是有效的。雖然酶法脫毒、微生物的耐毒性馴化也有一定效果,但顯示出生物脫毒優越性的,仍然是微生物處理法。微生物具有活性全面、易操作等優勢,盡管已經發現許多具有脫毒活性的微生物,但從現有的資料來看,最有希望的微生物是伊薩酵母(Issatchenkia)及貪銅菌屬的細菌(C.basilensis),它們能夠同時降解3大類代表性抑制物的特性,前者幾乎完全不利用水解液中的木糖、阿拉伯糖,后者連葡萄糖也不能代謝,是優良脫毒微生物。具有如此特性的脫毒微生物更應該作為寶貴的脫毒菌種資源值得我們研究利用,以此來獲得更豐富,更加優秀的基因組資源。
盡管,獲得一個同時對多種毒物具有很高的降解活性的微生物菌株可能是困難的,但利用不同脫毒菌株活性互補的特點即可解決這一難題。而混合菌脫毒的缺點是微生物群落結構不穩定,某一菌株對某一毒物有優良的降解活性,但可能因另外一個毒物的存在而不能充分發揮。構建整合不同的毒物代謝途徑的工程菌,是解決混菌脫毒缺點的可行手段。
自然脫毒微生物的缺點是脫毒與發酵分別進行,增加了成本。構建本身具有脫毒活性的工業發酵代謝工程菌,是解決水解物毒物抑制問題的理想手段。不過,由于毒物多樣、化學性質各異、代謝途徑復雜,目前對毒物代謝的基因背景,或其代謝網絡遠未充分明了,這些因素使基因工程等定向育種手段的作用受到了限制。當前,以原生質體整合為基礎的基因組改組技術,可能是構建具有脫毒活性的工業發酵代謝工程菌最有力的工具。因為基因組改組技術,不需要了解基因組序列,或其代謝網絡資料,而是通過建立高通量篩選策略,巧妙地將代謝工程設計轉變為融合子篩選。這是生物脫毒菌種育種最可能取得突破的方向。
[1]Almeida J R,Modig T,Petersson A,et al.Increased tolerance and conversion of inhibitors in lignocellulosic hydrolysates by Saccharomyces cerevisiae[J].Journal of Chemical Technology and Biotechnology,2007,82(4):340-349.
[2]Zhang Hou-Rui,Qin Xiang-xiang,Silva S S,et al.Novel isolates for biological detoxification of lignocellulosic hydrolysate[J].Appl Biochem Biotechnol,2009,152(2):199-212.
[3]Palmqvist E,Hahn-Hgerdal B.Fermentation of lignocellulosic hydrolysates.I:inhibition and detoxification[J].Bioresource Technology,2000,74(1):17-24.
[4]Casal M,Paiva S,Silva I S,et al.Transport of carboxylic acids in yeasts[J].FEMS Microbiol Rev,2008,32(6):974-994.
[5]Roe AJ,Mclaggan D,Davidson I,et al.Perturbation of anion balance during inhibition of growth of Escherichia coli by weak acids[J].Journal of Bacteriology 1998,180(4):767-772.
[6]Cherrington C A,Hinton M,Chopra I.Effect of shortchain organic acids on macromolecular synthesis in Escherichia coli[J].Journal Applied Microbiology,1990,68(1):69-74.
[7]Zaldivar J,Ingram L O.Effect of organic acids on the growth and fermentation of ethanologenic Escherichia coli LY01[J].Biotechnology and Bioengineering,1999,66(4):203-210.
[8]經艷,張厚瑞,周玉恒,等.甘蔗葉汽爆液中揮發性微生物生長抑制物的鑒定[J].食品與發酵工業,2008,34(11):29-32.
[9]劉勝男,張厚瑞,覃香香,等.生物氧化產堿去除半纖維素水解物中的有機酸[J].微生物學通報,2010,37(10):1421-1426.
[10]方祥年,黃煒,夏黎明.半纖維素水解液中抑制物對發酵生產木糖醇的影響[J].浙江大學學報:工學版,2005,39(4):547-551.
[11]Modig T,Lidén G,Taherzadeh M J.Inhibition effects of furfural on alcohol dehydrogenase,aldehyde dehydrogenase and pyruvate dehydrogenase[J].Biochem J,2002,363(3):769-776.
[12]Almeida J R,Modig T,Petersson A,et al.Increased tolerance and conversion of inhibitors in lignocellulosic hydrolysates by Saccharomyces cerevisiae[J].Journal of Chemical Technology and Biotechnology,2007,82(4):340-349.
[13]Rehman S A,Hadi S M.Reaction of furfural and methylfurfural with DNA:use of single-strand-specific nucleases[J].Food and Chemical Toxicology,1991,29(10):719-721.
[14]Zaldivar J,Martinez A,Ingram L O.Effect of selected aldehydes on the growth and fermentation of ethanologenic Escherichia coli[J].Biotechnology and Bioengineering,1999,65(1):24-33.
[15]Fitzgerald D J,Stratford M,Gasson M J,et al.Narbad A:Mode of antimicrobial action of vanillin against Escherichia coli,Lactobacillus plantarum and Listeria innocua[J].Journal of Applied Microbiology,2004,97(1):104-113.
[16]Casal M,Cardoso H,Leǎo C.Mechanisms regulating the transport of acetic acid in Saccharomyces cerevisiae[J].Microbiology,1996,142:1385-1390.
[17]Sousa M S,Rodrigues F,Leǎo C,et al.Mechanisms underlying the transport and intracellular metabolism of acetic acid in the presence of glucose in the yeast Zygosaccharomyces bailii[J].Microbiology,1998,144:665-670.
[18]Pronk J T,Linden-Beuman A van der,Verduyn C,et al.Propionate metabolism in Saccharomyces cerevisiae:implications for the rnetabolon hypothesis[J].Microbiology,1994,140:717-722.
[19]Gutiérrez T,Ingram L O,Preston J F.Purification and characterization of a furfural reductase(FFR)from Escherichia coli strain LYO1—An enzyme important in the detoxification of furfural during ethanol production[J].Journal of Biotechnology,2006,121:154-164.
[20]Koenig K,Andreesen J R.Xanthine dehydrogenase and 2-furoyl-coenzyme a dehydrogenase from Pseudomonas putida Fu-l:two molybdenum-containing dehydrogenases of novel structural composition[J].Journal of Bacteriology,1990,172(10):5999-6009.
[21]Liu Z L,Slininger P J,Dien B S,et al.Adaptive response of yeasts to furfural and 5-hydroxymethylfurfural and new chemical evidence for HMF conversion to 2,5-bis-hydroxymethylfuran[J].Journal of Industrial Microbiol Biotechnol,2004,31:345-352.
[22]盧雪梅,劉紫鵑,高培基.木質素生物降解的化學反應機制[J].林產化學與工業,1996,16(2):75-82.
[23]Nichols N N,Sharma L N,Mowery R A,et al.Fungal metabolism of fermentation inhibitors present in corn stover dilute acid hydrolysate[J].Enzyme and Microbial Technology,2008,42:624-630.
[24]Silva S S,Moutta R O,Zhang Hou-Rui,et al.Biological detoxification of different hemicellulosic hydrolysates using Issatchenkia occidentalis CCTCC M 206097 yeast[J].J Ind Microbiol Biotechnol,2011,38:199-207.
[25]Wierckx N,Koopman F,Bandounas L.et al.Isolation and characterization of Cupriavidus basilensis HMF14 for biological removal of inhibitors from lignocellulosic hydrolysate[J].Microbial Biotechnology,2010,3(3),336-343.
[26]Palmqvist E,Hgerdal B,Szengyel Z,et al.Simultaneous detoxification and enzyme production of hemicellulose hydrolysates obtained after steam pretreatment[J].Enzyme and Microbial Technology,1997,20(4):286-293.
[27]林蘭英.木質纖維氣爆水解物脫毒菌株的篩選及其脫毒機理研究[D].桂林:廣西師范大學,2009.
[28]Liu Z L,Ma M,Song M Z.Evolutionarily engineered ethanologenic yeast detoxifies lignocellulosic biomass conversion inhibitors by reprogrammed pathways[J].Molecular Genetics and Genomics,2009,282(3):233-244.
[29]Tomohisa H,Kyung-mo S,Tomoya S,et al.Efficient fermentation of xylose to ethanol at high formic acid concentrations by metabolically engineered Saccharomyces cerevisiae[J].Applied Genetics and Molecular Biotechnology,2011,90:997-1004.
[30]Ohta K,Beall D S,Mejia J P,et al.Genetic improvement of Escherichia coli for ethanol production:chromosomal integration of Zymomonas moblis genes encoding pyruvate decarboxylase and alcohol dehydrogenaseⅡ[J].Applied and Environmental Microbiology,1991,57(4):893-900.
ABSTRACTDilute acid is an important catalyst for generating fermentable sugar through lignocellulose hydrolysis.But this process will be accompanied by production of a large number of microbial metabolic inhibitors,which seriously affects the fermentation of hydrolysates.In this paper,we described the types of fermentative inhibitors,the mechanism of their formation and the metabolism of their toxicology,as well as the research advances on techniques for biological detoxification and the biological degradation pathways of different inhibitors.Furthermore,we analyzed its development based on previous researches.
Key wordslignocellulose hydrolysate,metabolic inhibitors,biodegradation
Biodegradation of the Microbial Metabolic Inhibitors of Iignocellulose Hydrolyzed by Dilute Acid
Wu Li-ming1,2,Zhou Yu-heng1,Chen Hai-shan1,Zhang Hou-rui1
1(Guangxi Institute of Botany,Chinese Academy of Science,Guilin 541006,China)
2(Life Science College,Guangxi Normal University,Guilin 541004,China)
碩士研究生(張厚瑞研究員為通訊作者)。
*廣西自然科學基金項目(No.2010GXNSFA013060);廣西植物功能物質研究與利用重點實驗室項目
2012-02-08,改回日期:2012-04-06

