反復性力竭運動后大鼠心臟傳導系統ADAMTS-1的變化及其在運動性心律失常發生中的作用
楊紅霞,常 蕓
反復性力竭運動后大鼠心臟傳導系統ADAMTS-1的變化及其在運動性心律失常發生中的作用
楊紅霞,常 蕓
目的:探討反復力竭運動后不同時相心臟竇房結、房室結和浦肯野氏纖維細胞炎性因子金屬蛋白酶-1基因和蛋白水平的表達特點,為運動性心律失常發生機制的闡明提供實驗依據。方法:100只健康成年雄性SD大鼠隨機分為反復力竭組及相應的其對照組,每組10只。分別于
力竭運動后0、4 h、12 h及24 h取材,進行心電圖、免疫熒光組化及實時熒光定量PCR分析。應用激光顯微切割技術定位并收集房室結和浦肯野氏纖維細胞研究細胞炎性因子ADAMTS-1的mRNA和蛋白表達的變化。結果:反復力竭運動后即刻心臟傳導系統ADAMTS-1 mRNA和蛋白表達均出現不同程度升高,隨后在4 h、12 h、24 h心臟傳導系統竇房結、房室結、浦肯野氏纖維ADAMTS-1基因mRNA和蛋白表達下降(P<0.05,P<0.01),乃至恢復。心臟傳導系統不同部位在反復力竭游泳運動后ADAMTS-1 mRNA和蛋白表達存有差異,其中,運動后即刻,浦肯野氏纖維ADAMTS-1蛋白表達顯著低于竇房結和房室結(P<0.01)。4 h,竇房結顯著高于浦肯野氏纖維(P<0.01)。24 h,竇房結顯著低于房室結和浦肯野氏纖維(P<0.01)。結論:反復力竭運動后即刻心臟傳導系統ADAMTS-1 mRNA和蛋白表達均出現不同程度升高,作為炎性因子的大量表達,易引起傳導系統炎性細胞浸潤,細胞間質增
殖乃至纖維化,是運動性心律失常的誘發因素之一。
力竭運動;金屬蛋白酶-1;心臟傳導系統
運動性心律失常一直是運動醫學領域十分關注的醫學問題。而運動性心律失常的發生機制是一個極其復雜的過程,涉及眾多因子。運動醫學界對此進行了廣泛的臨床觀察與調研[1]。常蕓等針對運動性心律失常的發生機制進行了大量實驗性研究[2-4]。目前運動性心律失常發生的可能原因仍未完全闡明,以往實驗性研究方法,大多數集中心肌組織,很難概括心律失常發生的病理機制。心臟傳導系統作為心電活動的控制中心和沖動傳導的重要部位,其特殊的組織結構和細胞類型決定其具有不同于普通心肌的心電起搏和傳導功能,與各種類型心律失常的發生和發展具有密切的關系。
金屬蛋白酶(ADAMTS)是新近發現的具有蛋白質水解功能的金屬蛋白酶家族,I型血小板結合蛋白基序(TSP)的解聚蛋白樣金屬蛋白酶(ADAMTS-1)是ADAMTS家族成員,屬于分泌型蛋白,可由巨噬細胞、血管內皮細胞、平滑肌細胞、成纖維細胞等多種細胞合成和分泌[5]有研究表明[6]ADAMTS-1可能通過調節膠原代謝參與心肌纖維化的發生發展過程,可能與運動性心律失常的病理過程有關。而在運動條件下心臟傳導系統中ADAMTS-1的變化還未見報道。
為此,本研究將對反復力竭運動后心臟傳導系統的ADAMTS-1在基因和蛋白表達變化進行研究,試圖為運動性心律失常發生機制的闡釋提供理論與實驗依據。
1 材料與方法
1.1 實驗對象
健康雄性成年SD大鼠100只,8周齡,體重(22.0±8)g。國家標準嚙齒動物飼料喂養,自由飲食。飼養環境為室溫(20±2)℃,光照時間12 h,相對濕度40%~55%。
1.2 運動負荷
將100只實驗大鼠隨機分為10組,每組10只。其中一次力竭和2周反復力竭游泳運動[7]各4組,相應安靜對照2組。安靜對照組不運動,力竭運動各組大鼠尾部負重為體重的3%,每周運動6天,每天1次。力竭標準參照Thomas的報道[8]即:“經過10 s后動物仍不能返回水面,并且撈出后置于平面不能完成翻正反射。”
1.3 取材
最后一次力竭運動后即刻、4 h、12 h及24 h等不同時相取材,迅速取出心臟,沿心臟矢狀面的方向將整個心臟用OCT包埋,液氮驟冷,作全心連續冰凍切片,光鏡定位心臟傳導系統,運用激光顯微切割儀切割分別收集竇房結細胞或細胞團[9]。
1.4 實時熒光定量PCR檢測
采用Trizol法提取總RNA,并逆轉錄cDNA,存于-20℃備用。通過互聯網搜索Genbank查找目標因子結蛋白和內參照β-actin的引物基因序列,應用Primer 5軟件進行引物設計,引物擴增目標基因片斷長度均小于150 bp,其PCR產物用2%瓊脂糖凝膠電泳檢測驗證引物可用后,再進行熒光定量 PCR,取定量PCR用 96孔板,加入cDNA和引物配置25μ L反應體系。實時定量RT-PCR主要過程:預變性95℃ 30 s,PCR反應95℃ 10 s,60℃ 30 s,40個循環。檢測CT值(見表1)。設計的引物由上海生工生物技術有限公司合成。
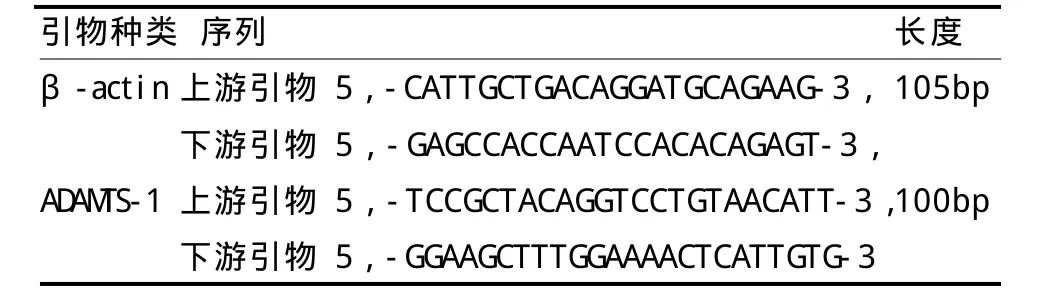
表1 PCR引物序列TableⅠ PCR Primer Sequence
1.5 免疫熒光檢測
心臟傳導系統冰凍切片進行免疫熒光組織化學染色,采用Leica AD MDW活細胞多維圖成像工作站和Leica Qwin圖像分析系統對目標因子蛋白熒光強度進行定量,熒光強度用積分灰度表示(IOD),參考陰性對照標本中熒光強度,灰度值在40~130之間為蛋白陽性表達。
1.6 統計學分析
利用SDS2.2軟件對實時定量PCR數據進行分析處理,并導出文件及圖像。利用管家基因對目的基因的表達進行校正,得到相對定量結果(相對數值)。結果用平均數±標準差表示,組間比較采用多因素方差分析,顯著性水平為P<0.05。
2 結果
2.1 心臟傳導系統一般指標
經過反復力竭運動后大鼠有不同程度出現心律失常,心臟肉眼觀察有不同程度的充血,且反復力竭游泳運動后各時相組心臟重量指數均顯著高于對照組心臟重量指數(P<0.05),具體數據結果參見[10]。
2.2 心臟傳導系統ADAMTS-1mRNA表達結果
如表2所示,反復力竭游泳運動后即刻心臟傳導系統竇房結、房室結ADAMTS-1基因mRNA表有所增高,隨后在4 h、12 h、24 h心臟傳導系統竇房結、房室結、浦肯野氏纖維ADAMTS-1基因mRNA表達均顯著低于對照組(P<0.05),4 h又顯著低于12 h(P<0.05);其中,反復力竭游泳運動后4 h、12 h房室結ADAMTS-1mRNA表達顯著低于即刻和24 h(P<0.05);反復力竭游泳運動后4 h、12 h浦肯野氏纖維ADAMTS-1mRNA表達顯著低于即刻(P<0.05)。
總體來看,反復力竭運動后大鼠傳導系統各部位ADAMTS-1基因mRNA表達呈時相性規律,反復力竭運動后即刻大鼠竇房結、房室結、浦肯野氏纖維ADAMTS-1基因mRNA表達上升,之后迅速下降,到力竭后4 h接近低谷,一直持續到24 h,其中,竇房結和房室結的改變更為明顯(見圖1)。
2.3 心臟傳導系統ADAMTS-1蛋白表達結果
如表3所示,經反復力竭游泳運動后,心臟傳導系統竇房結ADAMTS-1蛋白表達即刻顯著高于對照組(P<0.01),4 h、12 h、24 h又均顯著低于對照組和即刻(P<0.01)。
房室結、浦肯野氏纖維ADAMTS-1蛋白表達4 h、12 h、24 h均顯著低于對照組和即刻(P<0.01),4 h又顯著低于12 h(p<0.05)和24 h(P<0.01)。其中,房室結ADAMTS-1蛋白表達即刻顯著高于對照組(P<0.01),浦肯野氏纖維ADAMTS-1蛋白表達24 h顯著高于12 h(P<0.01)。
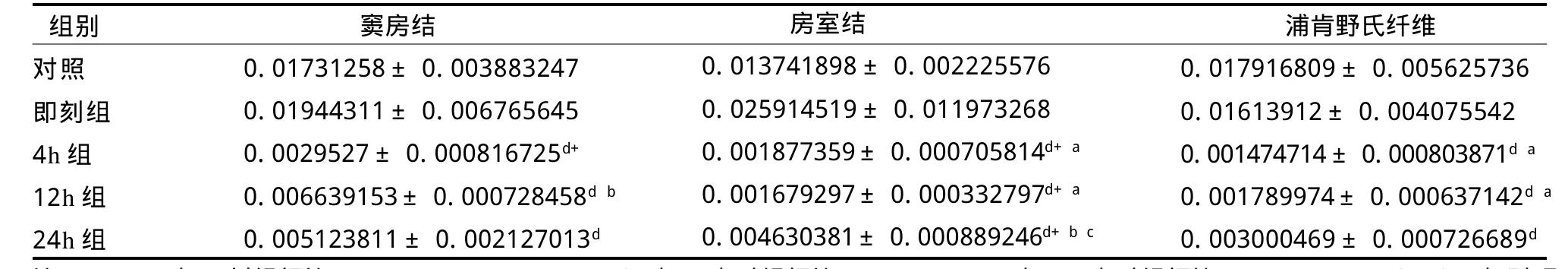
表2 反復力竭運動后大鼠ADAMTS-1mRNA相對表達量TableⅡ Relative Expression Quantity of Rat ADAMTS-1mRNA after Repeated Exhaustive Exercise
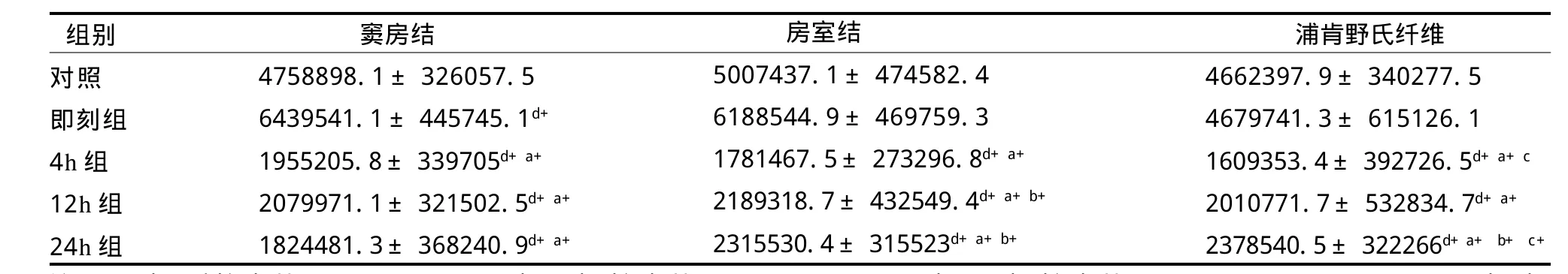
表3 反復力竭運動后大鼠ADAMT S-1蛋白表達總灰度值變化情況TableⅢ Changes of Total Gray Value of Rat ADAMTS-1 Protein Expression after Repeated Exhaustive Exercise
心臟傳導系統不同部位在反復力竭游泳運動后存有差異。其中即刻,浦肯野氏纖維ADAMTS-1蛋白表達顯著低于竇房結和房室結(P<0.01)。4 h,竇房結顯著高于浦肯野氏纖維(P<0.01)。24 h,竇房結顯著低于房室結和浦肯野氏纖維(P<0.01)。
總體來看,反復力竭運動后大鼠傳導系統各部位ADAMTS-1基因蛋白表達呈時相性規律,運動后即刻大鼠竇房結、房室結、浦肯野氏纖維ADAMTS-1基因蛋白表達上升,之后迅速下降,到力竭后4 h接近低谷,一直持續到24 h,其中,竇房結和房室結的改變更為明顯(見圖2)。
3 討論
ADAMTS是新近發現的具有蛋白質水解功能的金屬蛋白酶家族,I型血小板結合蛋白基序(TSP)的解聚蛋白樣金屬蛋白酶(ADAMTS-1)是ADAMTS家族成員,屬于分泌型蛋白,可由巨噬細胞、血管內皮細胞、平滑肌細胞、成纖維細胞等多種細胞合成和分泌[5],分泌后大多通過C末端3個TSP重復序列和間隔區錨定在細胞外基質(ECM)中,并與之結合從而參與ECM蛋白的調節[6、11]。有研究表明,ADAMTS-1參與動脈粥樣硬化的病理過程與ECM重構關系密切,具有降解I型膠原的作用[12]。申鍔,陳瑞珍等[13]研究表明ADAMTS-1可能通過調節膠原代謝而參與心肌纖維化的發生發展過程。也有學者觀察柯薩奇病毒B組病毒感染小鼠引起急、慢性病毒心肌炎心肌ADAMTS-1表達發現,ADAMTS-1與CVB3感染所致病毒性心臟病心肌纖維化關系密切[14]。在運動條件下房室結和浦肯野纖維細胞中ADAMTS-1的變化還未見報道。
馮小蘭、馮震博[15]利用結扎后造成心肌梗死模型,研究大鼠急性心肌梗死(AMI)ADAMTS-1的表達發現,結扎后6 h,ADAMTS-1 mRNA的表達到高峰,在ADAMTS-1表達高的區域出現心肌壞死,提示ADAMTS-1表達高的區域,心肌損害程度越嚴重。本研究發現,反復力竭運動后大鼠傳導系統各部位ADAMTS-1基因mRNA表達呈時相性規律,反復力竭運動后即刻大鼠竇房結、房室結、浦肯野氏纖維ADAMTS-1基因mRNA表達上升,之后迅速下降,到力竭后4 h接近低谷,一直持續到24 h,其中,竇房結和房室結的改變更為明顯。ADAMTS-1具有降解細胞外基質的功能,能破壞細胞結構,使酶活性喪失,糖蛋白分解,細胞功能的損壞,導致心肌細胞的凋亡或壞死。分析認為,反復運動后心肌缺血再灌注損傷加重。由于對反復力竭刺激產生適應,在運動后24 h的ADAMTS-1表達有所恢復。
研究發現[16],TNF-a可以誘導內皮細胞表達ADAMTS-1,從而分泌到細胞外基質并與之結合,參與細胞外基質蛋白的調節,降解蛋白多糖,聚集蛋白聚糖、多能聚糖以及膠原蛋白[17],引起心肌組織局部肌肉間隙增寬,導致心肌組織結構改變,最終影響心功能。本研究發現,反復力竭運動后呈現先下降后上升的趨勢,且運動后4 h、12 h浦肯野氏纖維ADAMTS-1mRNA表達顯著低于即刻,故反復力竭后運動性室性心律失常的易感性更高。綜上,反復力竭運動后心臟傳導系統ADAMTS-1 mRNA和蛋白表達均出現不同程度升高,可能影響正常心律的起搏與傳導,構成運動性心律失常的發生基礎。
4 小結
4.1 反復力竭運動后即刻心臟傳導系統ADAMTS-1 mRNA和蛋白表達均出現不同程度升高,作為炎性因子的大量表達,易引起傳導系統炎性細胞浸潤,細胞間質增殖乃至纖維化,是運動性心律失常的誘發因素之一。
4.2 心臟傳導系統不同部位在反復力竭游泳運動后ADAMTS-1 mRNA和蛋白表達存有差異,其中運動后即刻浦肯野氏纖維ADAMTS-1蛋白表達顯著低于竇房結和房室結,而運動后4 h竇房結顯著高于浦肯野氏纖維,24 h竇房結顯著低于房室結和浦肯野氏纖維。
[1]曲綿域.實用運動醫學[M].北京:北京科學技術出版社,1996: 311-318.
[2]常蕓.運動心臟的實驗研究[M].北京:人民體育出版社,1998.
[3]常蕓.運動心臟理論與實踐[M].北京:人民體育出版社,2008. 106-132.
[4]常蕓.運動員心臟的醫務監督[M].北京:北京體育大學出版社, 2009.203-207.
[5]王利,王憲,孔煒.新型金屬蛋白酶ADAMT S家族的研究進展[J].生理科學進展,2008,3 9(1):49-52
[6]Kuno K, Kanada N, Nakashima E, et al.(1997). Molecular cloning of a gene encoding a new type of metallopmteinase-disintegrin family protion with thmmbospondin motifs as an inflammation associated gene[J]. J Bid Chem, 272(1):556-562.
[7]Kramer K, Dijkstra H, Bast A. (l993). Control of physical exercise of rats in a swimming basin. Physiol Behav, 53(2): 271-276.
[8]Thomas D P, Marshall Kl. (1988). Effect of repeated exhaustive exercise on myocardial subcellular membrane structures. Int J Sports Med. 9(4): 257-260.
[9]Splawski I, Shen J, Timothy KW, et al.(1998). Gramme structure of three long QT syndromegenes: KVLQTI, BERG, and KCNEI. Grammes, 51(1): 86
[10]常蕓,楊紅霞.不同力竭運動后大鼠心臟傳導系統結蛋白m RNA和蛋白表達的變化及其在運動性心律失常發生中的作用[J].中國運動醫學雜志,2012,31(04):34-321
[11]Mittaz L, Ricardo S, Martinez G, et al. (2005). Neonatal calyceal dilation and renal fibrosis resulting from loss of Adamts-1 in mouse kidney is due to a developmental dysgenesis [J]. Nephrol Dial Transplant, 20(2): 419-423.
[12]Jonsson-Rylander AC,Nilsson T, Fritsche-Danielson R et al. (2005). Role of ADAMTS-1 in atheroselerosis: remodeling of carotid artery,immunohistochemistry, and Proteolysis of
[13]versiean.Arterioseler Thromb Vasc Biol.25(l):180-185.申鍔,陳瑞珍,楊英珍.ADAM TS-1與小鼠急、慢性病毒性心肌
[14]炎心肌纖維化相關性的初步研究[J].中華心血管病雜志, 2007,35(9):854-858.
[15]申鍔.CvB3致小鼠病毒性心臟病心肌纖維化的發生機制及其藥物治療研究[D].復旦大學博士學位論文,2007,42.馮小蘭,馮震博等實驗性大鼠急性心肌梗死ADAM TS1表達的研究[J].廣西醫科大學學報,2008,25(3):373-375
[16]Kuno K, Kanada N, Nakashima E, et al. (1997). Molecular cloning of a gene encoding a new type of metallopmteinase-disintegrin family protion with thmmbospondin motifs as an inflammation associated gene[J]. J Bid Chem, 272(1):556-562
[17]Mittaz L, Ricardo S, Martinez G, et al.(2005). Neonatal calyceal dilation and renal fibrosis resulting from loss of Adamts-1 in mouse kidney is due to a developmental dysgenesis [J]. Nephrol Dial Transplant, 20(2):419-423.
(責任編輯:何聰)
Changes of ADAMTS-1 of the Rat Cardiac Conduction System after Repeated Exhaustive Exercise and Its Role in Athletic Arrhythmia
YANG Hong-xia, CHANG Yun
(China Institute of Sport Science, Beijing 100061, China)
Objective To find out the expressive characteristics of sinoatrial node, atrioventricular node and Purkinje's fibre cell inflammatory factor MMP-1 gene and protein level at the different phases after repeated exhaustive exercises so as to provide experimental reference for the occurrence mechanism of athletic arrhythmia. Method 100 healthy adult male SD rats were divided randomly into repeated exhaustive exercise groups and control groups. There are 10 rats in each group. Samples were collected immediately, 4h, 12h and 24h after the exhaustive exercise for electrocardiogram, immunofluorescence technology and PCR analysis. Adopting microdissection technology to position and collect the changes of cardiac conduction system ADAMTS-1 mRNA and protein expression of atrioventricular node and Purkiny's fibre cell inflammatory factor ADAMTS-1. Result Cardiac conduction system ADAMTS-1 mRNA and protein expression immediately after repeated exhaustive exercise rose to some extent. Then the cardiac conduction system sinoatrial node, atrioventricular node and Purkinye's fibre ADAMTS-1 mRNA and protein expression decreased at 4h, 12h and 24 hours (P<0.05, P<0.01) until recovery. There is a difference between ADAMTS-1 mRNA and protein expression of the different parts of cardiac conduction system after repeated exhaustive exercise. Purkinye's fibre ADAMTS-1 protein expression was clearly lower than those of sinoatrial node and atrioventricular node immediately after the exercise (P<0.01). After 4 hours, protein expression of sinoatrial node was significantly higher than that of Puekinye's. After 24 hours, The protein expression of sinoatrial node was evidently lower than those of atrioventricular node and Purkinye's fibre (P<0.01). Conclusion ADAMTS-1 mRNA and protein expression rose to some extent immediately after repeated exhaustive exercise. Large quantity expression of inflammatory factor may cause inflammatory cell filtration , Intercellular substances proliferation and fibrosis. This is one of the risk factors for athletic arrhythmia.
exhaustive exercise; MMP-1; cardia conduction system
G804.5
A
1006-1207(2012)04-0021-04
2012-06-27
國家體育總局體育科學研究所基本科研業務經費(10-01)
楊紅霞,女,研究生. 主要研究方向:運動心臟病理與醫學監督.
國家體育總局體育科學研究所,北京體育館路11號,北京100061

