蚧蟲初孵若蟲采集、保存和玻片標本制作1)
趙杰軍 王自力 陳曉鳴
(中國林業科學研究院資源昆蟲研究所,昆明,650224)
蚧蟲屬半翅目(Hemiptera)蚧總科(Coccoidea)昆蟲的通稱,全世界報道蚧蟲有7364種[1],中國記錄有1155種[2]。蚧蟲的分類鑒定主要依據雌成蟲的形態特征,較少涉及初孵幼蟲的形態特征。初孵幼蟲形態特征種間存在差異,對于種的鑒定具有重要的分類參考價值[3]。此外,蚧蟲寄主植物選擇機理研究應首先弄清楚初孵幼蟲觸角、足和口器等感受器官的形態與結構,因為成蟲期這些感受器官發生退化,不能真實地反映蚧蟲選擇寄主過程中涉及的感受器官的形態特征[4]。蚧蟲初孵幼蟲為微小昆蟲,體長不足1 mm,用解剖鏡僅能觀察清楚蟲體輪廓如體形、體色、蠟絲等外部形態特征,采用掃描電鏡觀察,首先必須制作玻片觀察清楚蟲體的形態特征,再用掃描電鏡進行重點形態結構分析。蚧蟲初孵幼蟲柔軟、體被蠟絲,借用成蟲制作方法容易引起蟲體變形,借用其它微小昆蟲(蚜蟲)的制作方法不能完全除蠟,因此,探討蚧蟲初孵幼蟲玻片制作技術依然具有重要的價值。筆者以白蠟蟲初孵幼蟲玻片標本制作為例,旨在提供蚧蟲初孵幼蟲的保存和玻片標本的制作方法,主要介紹新引入的蟲體轉移用具與使用方法,以供相關的研究人員參考與交流。
1 標本采集與保存
蚧蟲成蟲通常采用70%酒精保存,酒精容易引起蟲體表皮皺縮,玻片標本主要適用表皮結構觀察研究,而皺縮的表皮又會影響整體觀察效果。白蠟蟲初孵幼蟲的保存引入植物材料常用的保存液FAA。由于初孵幼蟲蟲體柔軟,FAA的配方為50%酒精90 mL+冰醋酸5 mL+福爾馬林5 mL,并按固定液體積的5%加入甘油。FAA與酒精保存液差別在于加入冰醋酸提高了滲透速度,使蟲體快速固定不變形,甘油軟化硬化結構確保蟲體不變形,并且FAA可以同時保存蚧蟲及其寄主植物。一般采用FAA固定標本0.5~2.0 h,即可進入玻片制片階段。
在野外用剪刀取有蟲枝條或者葉片,若種蟲周圍有孵化的幼蟲,直接用毛筆掃蟲放入采集瓶;若種蟲周圍無孵化的幼蟲,則取有蟲寄主植物材料帶回室內,放入培養皿(底墊光滑白紙)培養,待幼蟲孵化,用毛筆掃入標本瓶。標本采集完畢,在標本瓶中加入蟲體體積20~30倍的保存液。蟲體固定一段時間后,更換保存液1~2次,室溫保存可達數年。
2 玻片標本的制作
2.1 蟲體轉移工具
顯微眼科鑷子:由于蟲體微小,用一般的鑷子夾取極為困難,若采用顯微眼科鑷子(頭寬0.1 cm)可以輕松將蟲子移動。用吸管取蟲雖操作方便,操作者不用訓練就可以移動蟲體,但吸管吸取蟲體的同時常夾帶其它雜質,用顯微眼科鑷子夾取蟲體避免了吸管取蟲的缺點。
轉移蟲袋:在制片過程中,操作者通常發現蟲體經過KOH處理后,蟲體幾乎透明,用肉眼極難辨認,常規方法在蟲體清洗、染色和脫水等過程中容易將蟲體丟失,并且耗時,處理的標本數量較少。若采用轉移蟲袋,可避免常規制片出現的問題,既節省時間,還適用于批量制作,更重要的是避免了每個制片環節挪動蟲體,較為完整地保存了蟲體的細微結構特征。此外,轉移蟲袋減少制片過程中接觸KOH、酒精、冰醋酸和二甲苯等溶液,使制片過程更為安全。轉移蟲袋采用200目以上的尼龍紗布制作,200目紗布孔徑不超過74 μm。制作方法簡單,將紗布裁剪為8 cm×4 cm方塊,按圖1所示虛線折疊,用昆蟲針或曲別針扣邊即可制作成轉移蟲袋(圖2)。
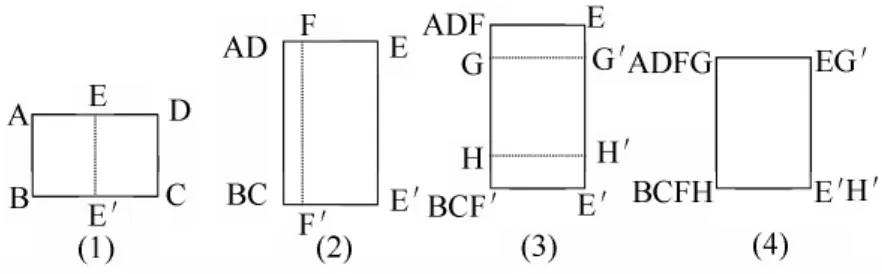
圖1 轉移蟲袋制作示意圖

圖2 轉移蟲袋
2.2 冰醋酸酒精混合脫水
在脫水過程中,采用常規的系列酒精溶液脫水,蟲體出現硬化、破碎,不易獲得完整的標本。若采用酒精和冰醋酸體積比1︰1的混合溶液進行脫水,蟲體細微結構特征保存完好,并有利于整姿。酒精和冰醋酸的混合溶液設置70%、85%、95%、100%4個梯度,每個梯度用相應體積分數的酒精和冰醋酸混合配制而成。
2.3 Euparal封片
微小昆蟲用中性樹脂或加拿大樹膠封片不容易整姿。用Euparal膠封片,可支持顯微鏡下緩慢地整理蟲體附肢。此外,Euparal膠封存的標本更為平整和透明。
2.4 制作過程
①蟲體軟化與沖洗。用吸管吸取蟲子,放入轉移蟲袋,掛上標簽,將轉移蟲袋浸泡在10%KOH溶液中,30~40℃水浴;當蟲體發白,立刻投入蒸餾水(60℃)沖洗3~5次,每次5 min。②系列冰醋酸酒精混合液脫水。將轉移蟲袋放入系列冰醋酸酒精混合溶液中脫水,每處理3~5 min;蒸餾水沖洗。③1%酸性品紅染色。將沖洗完畢的轉移蟲袋,放入1%酸性品紅染液中,染色時間控制在30~90 min;待肉眼觀察到蟲體發紅即可。④100%冰醋酸酒精混合液清洗脫水。將染色的轉移蟲袋直接放入冰醋酸酒精體積比1∶1混合溶液洗脫1~2 min,重復2次。⑤丁香油透明。打開轉移蟲袋,用吸管吸取丁香油緩慢沖洗袋子將蟲子洗脫于小培養皿或稱量皿,透明處理2~3 h后,開始封片。⑥整姿封片。取載玻片,在玻片中央部位滴1滴Euparal膠。在解剖鏡下,用顯微眼科鑷子夾取完整透明的蟲體放在載玻片上,轉移到100倍顯微鏡下,用超微針整理蟲體足和觸角,用一根超微針輕輕壓住蟲體,另一根針撥動附肢即可進行整姿。取蓋玻片對準蟲體接觸Euparal膠后,立刻松開手指,使蓋玻片自然沉降到蟲體身上,注意不可擠壓蓋玻片,以免壓碎蟲體。按照該方法制作的白蠟蟲初孵若蟲玻片標本見圖3。
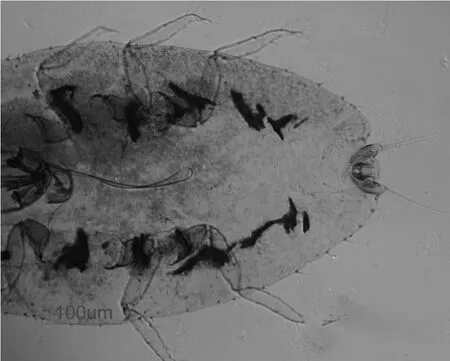
圖3 白蠟蟲初孵若蟲玻片標本
3 結論與討論
白蠟蟲初孵幼蟲玻片制作與其它微小昆蟲制片方法基本一致,僅在保存液、脫水溶液、封片劑以及轉移工具和軟化處理條件等方面進行了改進,因此,白蠟蟲初孵幼蟲玻片標本的制作方法同樣適用于其它一些微小昆蟲的玻片制作。
蟲體軟化是制作優質玻片的首要環節。用KOH軟化蟲子除內臟時,水浴溫度不宜過高,控制在30℃為宜。當蟲體發白時,立刻移入蒸餾水(60℃)清洗2~3次。對于體長小于0.5 mm的小型昆蟲,用超微針穿刺蟲體除內臟,即使在100倍解剖鏡也很難準確定位穿刺部位。因此,微小昆蟲除內臟建議用KOH稀溶液水浴溶解法。脫水是制片過程中重要的中間環節。采用冰醋酸或酒精單一脫水溶劑處理獲得標本不完整。若將冰醋酸酒精對半混合脫水處理的標本較為完整。蟲體整姿、封片是微小昆蟲制片操作最為困難的環節。微小昆蟲必須在高倍顯微鏡下進行整姿。整姿完畢后,用Euparal膠封片較少出現蟲體皺縮和氣泡。
在制片過程中,用轉移工具轉移蟲體使得蟲體的移動變得更為簡便、快捷。通常采用挑蟲環、挖耳和吸管等工具轉移蟲體[5-9]。挑蟲環可能適用于相對較大的蟲體,并且需要練習,否則在溶液中挑蟲是困難的。吸管容易移動蟲體,但同時夾帶雜質。此外,微小昆蟲通常將少量的蟲體放在玻片上進行脫水、染色和透明,操作者眼睛必須隨時盯住蟲體,否則蟲體在換溶液時易丟失。蟲體軟化后蟲體外骨骼透明,操作者憑肉眼幾乎無法辨認蟲體位置。微小昆蟲制片使用轉移蟲袋可以解決常規制片存在的問題。
玻片標本制作的安全性,逐漸受到了關注[6]。二甲苯透明標本具有速度快、透明性好的特點,其副作用也明顯,建議使用丁香油代替二甲苯。昆蟲表皮屬于幾丁質,以酸性品紅對幾丁質的染色效果突出,所以在昆蟲玻片制作上應廣泛使用酸性品紅。對于酸性品紅致癌性較少有人關注,酸性品紅滲透速度快,在染色過程中必須戴手套。
總之,微小昆蟲擬采用的制片方法必須確保獲得的玻片標本清晰、潔凈和完整,操作簡單易行,對人體安全無毒副作用。
[1]Ben-Dov Y.A systematic catalogue of eight scale insect families(Hemiptera:Coccoidea)of the world Aclerdidae,Asterolecaniidae,Beesoniidae,arayonemidae, Conchaspididae, Dactylopiidae,Kerriidae and Lecanodiaspididae[M].Amesterdam:Elsevier,2006.
[2]湯祊德.我國蚧蟲研究的歷史、現狀和展望[J].武夷科學,2001,17(1):82-86.
[3]Cook L G,Gullan P J,Stewart A C.First-instar morphology and sexual dimorphism in the gall-inducing scale insect Apiomorpha Rübsaamen(Hemiptera:Coccoidea:Eriococcidae)[J].Journal of Natural History,2000,34:879-894.
[4]Koteja J.On the phylogeny and classification of the scale insects(Homoptera,Coccinea)(discussion based on the morphology of the mouthparts)[J].Acta Zool Cracoviensia,1974,19:267-325.
[5]王子清.中國動物志昆蟲綱:第22卷[M].北京:科學出版社,2001:261-270.
[6]付海濱,王有福,王耀,等.植物檢疫性蚧蟲玻片標本制作技術[J].植物檢疫,2009,23(3):30-31.
[7]喬魯芹,張小娣.粉虱玻片標本制作方法的改進[J].昆蟲知識,1997,34(5):309.
[8]張宏瑞,Okajima S,Mound L A.薊馬采集和玻片標本的制作[J].昆蟲知識,2006,43(5):725-728.
[9]高占林,李耀發,黨志紅,等.蚜蟲玻片標本的制作方法與技巧[J].河北農業科學,2009,13(3):159,168.

