牙齦卟啉單胞菌對人臍靜脈內皮細胞分泌 IL-1β和 IL-6的影響研究
崔平平,張明珠,稅艷青,徐 杰,趙瑜敏,雷雅燕
(昆明醫科大學附屬口腔醫院口腔內科,云南昆明650031)
流行病學研究發現牙周病與全身性疾病有關[1],牙周病可能是冠心病的一個重要的危險因素。動脈粥樣硬化(AS)是嚴重威脅人類健康的疾病,其斑塊的破裂可觸發急性冠脈綜合癥(ACS)的發生,表現為不穩定心絞痛、急性心肌梗塞和猝死。在促進AS和RS發生、發展的眾多因素中,越來越多的實驗證實炎癥和細胞因子是主要的危險因素,其中TNFα、IL-1與AS的關系較為密切。血液炎性細胞及血管內皮細胞和 VSMCs均能分泌TNF-α、IL-6、IL-8 及血小板活化因子(PAF),且這些因子之間具有復雜的交互作用[2]。
牙齦卟啉單胞菌(Porphyromonas gingivalis,Pg)是牙周病的主要可疑致病菌,研究發現在動脈粥樣斑塊中存在 Pg 的 DNA[3-4],但其在 AS 發生及發展中的作用機制目前尚不清楚,本研究試圖通過觀察Pg上清液對體外培養的人臍靜脈內皮細胞(human umbilical vein endothelial cells,HUVEC)合成分泌細胞因子的變化,探討Pg對AS可能的影響,為研究牙周炎與動脈粥樣硬化的關系提供實驗室依據。
1 材料和方法
1.1 主要材料和試劑
牙齦卟啉單胞菌ATCC 33277株(四川大學華西口腔醫院國家重點實驗室);抗人第Ⅷ因子相關抗原單克隆抗體(福建邁新);噻唑藍(MTT sigma公司,美國 );Rabbit IL-1β ELISA KIT、Rabbit IL-6 ELISA KIT(R&D公司,美國);高純總 RNA快速提取試劑盒(離心柱型,北京遠泰生物技術有限公司);TaKaRa PrimeScript One Step RT-PCR Kit Ver.2(TaKaRa 公司);兔 β-actin、IL-1β、IL-6 引物(大連寶生物公司)。
1.2 Pg的培養及上清的提取
取Pg標準菌株常規復蘇后接種于加有羊血及VitK1的CDC培養板上,37℃厭氧(800 mL/L N2、100 mL/L H2、100 mL/L CO2)培養72 h,形態學檢查后,挑取菌落轉種于BHI液體培養基中增菌24 h。然后取100 μL增菌菌液在硫乙醇酸鹽中以1/10的比例倍比稀釋至原始濃度的10-7,分別取10-5、10-6、10-7三個濃度的稀釋液各 100 μL 分別在CDC培養板上涂板,繼續培養48 h后計菌落數,推算出原始菌液的濃度。其余增菌菌液8 000 r/min,4℃離心15 min,取Pg上清過濾后分裝入1.5 mL EP管,-80℃保存備用。
1.3 人臍靜脈內皮細胞(HUVECs)的培養及鑒定
人臍靜脈均來自昆明醫科大學第一附屬醫院產科,經產婦知情同意后,剪取臍帶15~20 cm,PBS沖洗,用1g/L I型膠原酶37℃消化15 min,1 000 r/min離心10 min;加入培養液5 mL吹打成細胞懸液,以5×107/L~1×108/L的細胞密度轉移至25 cm2的培養瓶中,37℃、50 mL/L CO2條件下培養并傳代,12 h換液1次。取第3代細胞進行人第Ⅷ因子相關抗原免疫組化及透射電鏡觀察進行細胞來源鑒定。
1.4 RT-PCR 法檢測 IL-1β 和 IL-6 mRNA 的表達水平
取第5代HUVECs以2.5×105/mL的密度接種于25 mL培養瓶并隨機分為兩組,實驗組加入ECM稀釋的5×106CFU/mL的Pg上清液5 mL;對照組加入等量ECM培養液37℃,50 mL/L CO2條件下進行培養。分別于培養6、12、18、24 h提取各組細胞總 RNA,用下列引物(表1)進行一步法RT-PCR反應:反應體系按照94℃預變性3 min,94℃ 30 s、55 ℃ 30 s、72 ℃ 60 s,共 35 個循環,72℃ 10 min延伸終止反應。反應產物進行瓊脂糖凝膠電泳,紫外儀下觀察,并使用計算機圖像采集系統拍照,分析凝膠目的條帶灰度值。以目的基因條帶的灰度值與內參β-actin條帶的灰度值的比值作為目的基因表達強弱的指標。

表1 引物序列
1.5 ELISA法檢測 Pg上清對 HUVECs生成IL-1β和 IL-6 蛋白水平的影響
取第5代HUVECs以5×104/mL的密度接種于96孔培養板,上述條件培養至細胞貼壁后隨機分為實驗組和對照組,實驗組加入用ECM稀釋的5×106CFU/mL的Pg上清液200 μL;對照組加入等量ECM培養液繼續培養。分別于培養6、12、18、24 h取各組細胞,每組復6孔,ELISA法檢測HUVECs生成IL-1β和IL-6蛋白的水平。
1.6 統計學分析
2 結果
2.1 HUVECs的形態學觀察及細胞鑒定
倒置顯微鏡下觀察內皮細胞原代培養3 d后完全融合形成“鋪路石”樣的單層細胞。細胞呈多角形或橢圓形,邊界清楚,胞漿豐富,細胞核較大,有1~3個核仁(圖1)。免疫組化檢測抗人第Ⅷ因子相關抗原陽性(圖2黑色箭頭示)。透射電鏡觀察,HUVECs核膜清晰,胞漿內富含微管、線粒體、內質網結構。且可見HUVECs特征性標志的Weibel-Palade(W-P)小體,其橫切面呈圓形,周圍有膜包繞;縱切面呈桿狀,其中可見小管狀結構(圖3~4,黑色箭頭示W-P小體)。

圖1 原代培養第3天的HUVECs形態 (×10)
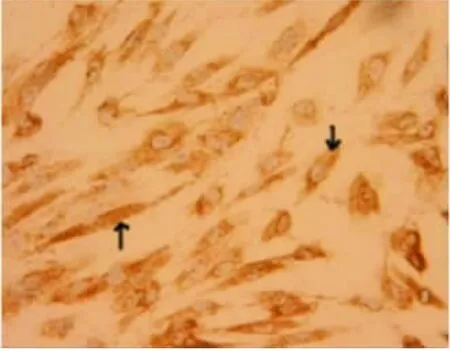
圖2 UVECs免疫組化鑒定(×40)

圖3 HUVECs的超微結構(W-P小體橫切面)

圖4 HUVECs的超微結構(W-P小體縱切面)
2.2 Pg上清液對 HUVECs IL-1β 和 IL-6 mRNA表達的影響
RT-PCR反應產物凝膠電泳結果見圖5。以目的基因條帶灰度值與內參β-actin條帶灰度值的比值作為目的基因表達強弱的指標,對不同時間點進行比較發現,IL-1β mRNA水平在Pg上清液刺激12、18 h時的表達高于對照組,差異有統計學意義(P <0.05),刺激 6、24 h 時兩組無統計學差異(P>0.05)(圖6);IL-6 mRNA水平在Pg上清液刺激12 h的表達明顯高于對照組(P<0.05),而其他各時間點兩組均無統計學差異(P>0.05)(圖7)。
2.3 Pg上清液對 HUVECs生成 IL-1β 和 IL-6蛋白水平的影響
IL-1β蛋白在Pg上清液刺激18、24 h的表達量明顯高于對照組(P<0.05);而6、12 h兩組無統計學差異(P>0.05)(圖8)。IL-6蛋白在Pg上清液刺激12、18、24 h三個時點均明顯高于對照組(P <0.05)(圖9)。

圖5 RT-PCR反應產物凝膠電泳圖(Treat為實驗組,Control為對照組)

3 討論
牙周炎是由牙周致病菌導致的一種炎癥性疾病,牙齦卟啉單胞菌是目前公認的引起牙周炎的常見致病菌,能表達多種潛在的毒力因子。魯維希等[5]將 Pg等牙周致病菌的 BHI增菌液進行15 000 r/min離心10 min后取其上清液用核磁共振代謝圖譜法進行研究發現,Pg菌液經高速離心后的上清液內保留了Pg的主要致病成分,可代表Pg的毒性成分,所以本實驗選擇 Pg上清液與HUVECs共同培養,觀察其對 HUVECs合成、分泌IL-6和 IL-1β 的影響。
另外,我們前期的實驗結果發現,Pg上清液在高濃度(>5×106CFU/mL)時,對 HUVECs的增殖有明顯的抑制作用,在相對低濃度(≤5×106CFU/mL)時對 HUVECs的增殖則無明顯影響。故選擇對細胞增殖無明顯抑制作用濃度組中的最高細菌濃度作為本實驗的細胞刺激濃度。
血管內皮細胞在Pg的直接和間接作用下,可通過分泌大量的粘附分子或炎性介質促進單核巨噬細胞的聚集與粘附,促進平滑肌細胞的增殖與遷移,在血管內膜下吞噬氧化的脂質而形成大量的泡沫細胞;同時,由于內皮功能受損,內膜下的膠原暴露,組織因子大量釋放,引起血小板的活化和血栓形成,共同導致AS的發生[6]。有研究顯示,Pg纖毛、內毒素、細菌外膜蛋白和熱休克蛋白可刺激人內皮細胞表達血管間細胞粘附分子(VCAM-1)、細胞間粘附分子(ICAM-1)、E-選擇素和P-選擇素等,并觀察到其炎癥基因表達上調[7-8]。
白細胞介素 -1(interieukin-1,IL-l)是一種強效的炎癥反應調節因子,主要由單核細胞、巨噬細胞、血管內皮細胞等產生,具有調節免疫反應和介導炎癥反應發生的雙重作用。Bhaskar等[9]研究發現,體內運用抗IL-lβ抗體可抑制載脂蛋白缺陷鼠動脈斑塊的形成。Wang等[10]認為,IL-lβ 濃度可作為診斷急性冠脈綜合征的炎癥指標。
IL-6是一種多功能細胞因子,可由成纖維細胞、上皮細胞、單核巨噬細胞、成骨細胞、血管內皮細胞等多種細胞合成分泌。近年的流行病學研究和臨床研究提示:IL-6是心血管疾病有力的獨立預示因子之一。Lai等[11]認為,IL-6可能是判斷心血管疾病嚴重程度的重要指標,與動脈硬化斑塊的活動性密切相關。McDermott等[12]認為,持續的高IL-6水平與外周動脈疾病快速功能下降有關。以上研究表明,IL-6是反映動脈粥樣硬化演進的重要標志物,且對遠期心血管事件具有預測價值。
本結果顯示,以5×106CFU/mL濃度的Pg上清液刺激HUVECs后,細胞上清中的IL-1β和IL-6的基因表達增強,蛋白表達水平均增高,而且其基因的高表達早于相應蛋白的表達。提示,Pg可通過促進 HUVECs的 IL-1β、IL-6的表達,從而在AS的發生發展中起到促進推動作用。但是,牙周炎對AS的影響究竟是通過致病菌毒力因子直接刺激內皮細胞而導致的炎癥因子水平升高,還是通過局部組織炎癥因子的釋放使得外周血液中IL-1β和IL-6水平升高從而對內皮細胞發揮間接的損傷作用,還有待進一步的探索。
[1]Meurman JH,Sanz M,Janket SJ.Oral health,atherosclerosis,and cardiovascular disease[J].Crit Rev Oral Biol Med,2004,15:403-413.
[2]吳興利,王士雯,徐雅琴,等.銀杏葉提取物對兔血管平滑肌細胞分泌細胞因子的影響[J].中國新藥與臨床雜志,2003,22(5):292-295.
[3]Kozarov E,Sweier D,Shelburne C,et al.Detection of bacterial DNA in atheromatous plaques by quantitative PCR[J].Microbes Infect,2006,8(3):687 -693.
[4]Fiehn NE,Larsen T,Christiansen N,et al.Identification of periodontal pathogens in atherosclerotic vessels[J].J Periodontol,2005,76:731 -736.
[5]魯維希,吳亞菲,肖麗英,等.牙周可疑致病菌代謝組學鑒定的初步研究[J].華西口腔醫學雜志,2009,27(3):310-312,316.
[6]周小波,吳慧琴,張雪梅,等.血管內皮炎癥與動脈粥樣硬化[J].中國心血管病研究,2008,6(4):308 -309.
[7]Kocgozlu L,Elkaim R,Tenenbaum H,et al.Variable cell responses to P.gingivalis lipopolysaccharide[J].J Dent Res,2009,88(8):741 -745.
[8]Hashizume T,Kurita-Ochiai T,Yamamoto M.Porphyromonas gingivalis stimulates monocyte adhesion to human umbilical vein endothelial cells[J].FEMS Immunol Med Microbiol,2011,62(1):57-65.
[9]Bhaskar V,Yin J,Mirza AM,et al.Monoclonal antibodies targeting IL-1 beta reduce biomarkers of atherosclerosis in vitro and inhibit atherosclerotic plaque formation in Apolipoprotein E-deficient mice[J].Atherosclerosis,2011,216(2):313 -320.
[10]Wang YN,Che SM,Ma AQ.Clinical significance of serum cytokines IL-l beta,sIL-2R,IL-6,TNF-alpha,and INF-v in acute coronary syndrome[J].Chin Med Sci J,2004,19(2):120 -124.
[11]Xing JP,Zhao JO.Relationship between coronary atherosclerosis plaque characteristics and high sensitivity C-reactive proteins,interleukin-6[J].Chin Med J(Engl),2011,124(16):2452-2456.
[12]McDermott MM,Liu K,Ferrucci L,et al.Relation of interleukin-6 and vascular cellular adhesion molecule-1 levels to functional decline in patients with lower extremity peripheral arterial disease[J].Am J Cardiol,2011,107(9):1392 - 1398.

