原發性甲減合并煙霧綜合征1例報告
谷惠子, 汪 軍, 劉 暢, 侯瑋琛, 劉 群
煙霧病(Moyamoya disease,MD)是以頸內動脈末端(TICA)和大腦前動脈(ACA)、大腦中動脈(MCA)近端進行性狹窄或閉塞,血管造影顯示顱底異常煙霧狀血管網為特征的一組血管病[1]。煙霧綜合征(Moyamoya syndrome,MMS)則是臨床和影像表現類似煙霧病而可能存在血管狹窄致病因素的一組綜合征[2]。人們已達成共識,即原發性甲狀腺功能減退或亞臨床甲狀腺功能減退與動脈粥樣硬化有相關性。最近有研究也表明:甲狀腺自身抗體異常是煙霧病的獨立危險因素之一。MMS合并甲狀腺功能減退的報道在臨床上非常少見[3]。我院日前診治1例煙霧病合并甲狀腺抗體增高的原發性甲減,現將其臨床特征及治療方案報道如下。
1 臨床資料
患者,男性,60歲,因頭暈、頭痛、走路不穩4d入院。該患者于入院前4d無明顯誘因出現頭暈、頭痛、走路不穩,伴惡心,無嘔吐。病程期間出現視物模糊,反應慢,記憶力差。既往:患者6年前因腦梗死在當地救治,病情好轉后出院,遺留頭暈癥狀持續,間斷治療,未見明顯好轉;4月前發現膽囊炎、膽囊結石;右下肢靜脈曲張7年。吸煙史30年,10支/日,飲酒史30年,4兩/日,6年前均戒斷。查體:血壓150/80mmHg,體溫37.9℃,右側同向性偏盲伴視物變色,命名性失語,雙側指鼻實驗欠穩準。輔助檢查:腦彩超(2011-8-10):左側頸內動脈發出眼動脈之前重度狹窄或閉塞,左側后交通動脈側枝開放,左側頸外動脈→頸內動脈側枝開放。右側頸內動脈發出眼動脈之前重度狹窄或閉塞,右側后交通動脈側枝開放,右側頸外動脈→頸內動脈側枝開放。頸部彩超:雙側頸部動脈內中膜不均勻增厚伴多發斑塊形成,雙側頸內動脈管徑相對細,右側為著,提示先天發育不良合并顱內段或入顱段重度狹窄或閉塞。頭部CTA(見圖1 A~E):雙側頸內動脈管壁鈣化。腦內血管多發狹窄(雙側大腦前、中,雙側頸內動脈、左側大腦后動脈),考慮為煙霧病所致。頭部CT(見圖1F):肺部多排CT平掃:左側顳枕葉腦軟化灶,腦室系統積血。右肺中葉、左肺舌葉及雙肺下葉少許炎變;甲狀腺改變。甲狀腺及其引流區淋巴結彩超:甲狀腺右葉內多個實性結節,較大的25×21mm,內部血流信號豐富,甲狀腺左葉內多個強回聲結節,較大的14.7×14.5mm,邊界清,內部血流信號豐富,提示:雙側甲狀腺多發實質性占位性病變。血常規:中性粒細胞百分比(NE)0.83%,淋巴細胞百分比(LY)0.09%,紅細胞比容(HCT)0.353L/L,紅細胞分布寬度(RDW)14.5%。鐵代謝:鐵 6.9μmol/L,總鐵結合力 37.2 μmol/L,鐵蛋白646.3μg/L。維生素 B12 65.80pmol/L,葉酸(FOL)5.50nmol/L。甲功五項測定:促甲狀腺素(TSH)41.450μIU/m l(參考值:0.27 ~ 4.2μIU/ml),游離 T4(FT4)10.35pmol/L(參考值:12.0 ~22.0pmol/L),甲狀腺球蛋白抗體(A-TG)667.50IU/ml(參考值: <115.0IU/ml),抗甲狀腺微粒體抗體(TMAb)153.00IU/ml(參考值:<35.0IU/ml)。血沉、腫瘤標志物未見明顯異常。
患者入院后診斷為“煙霧綜合征、腦室出血、原發性甲減(不除外橋本氏甲狀腺炎)、甲狀腺占位、雙肺肺炎、貧血、膽囊結石伴膽囊炎”。給予優甲樂25mg,2次/日,并給予營養神經、促進出血吸收、對癥及支持治療10d。頭暈、惡心、頭痛、走路不穩緩解,復查頭部CT:出血吸收良好。
甲狀腺激素治療后半年復查:甲功五項測定:促甲狀腺素(TSH)9.6uIU/ml,游離 T4(FT4)15.73pmol/L,甲狀腺球蛋白抗體(A-TG)800.80IU/m l,抗甲狀腺微粒體抗體(TMAb)156.30IU/ml。維生素 B12 121.00pmol/L,葉酸(FOL)>45.31nmol/L。腦彩超、頸部彩超提示:血管病變較前無明顯加重。
2 討論
常見的合并MMS的疾病包括:鐮狀細胞貧血、再生障礙性貧血、系統性紅斑狼瘡、抗心磷脂綜合征、鉤端螺旋體病、唐氏綜合征、結節性硬化、顱腦放射和自身免疫性甲狀腺疾病等[4]。MMS和甲狀腺疾病并存的病例很少見,到目前為止,英文文獻上僅有幾十例報道[2,3,5~9]。在這些病例中,報道較多的是MMS合并甲亢。而MMS合并甲減少見[1]。
雖然還沒有確切的證據,但越來越多的學者認為甲狀腺疾病與MMS之間有相關性。目前,學者們對Graves病和腦血管疾病的相關性研究較多,而對原發性甲狀腺功能減退或亞臨床甲狀腺功能減退與腦血管疾病的相關性研究較少。學者們對甲狀腺功能減退的相關研究也主要側重于甲狀腺功能減退和心血管疾病相關性方面的研究。正是基于這樣的事實,即越來越多的心血管疾病出現在甲狀腺功能減退或亞臨床甲狀腺功能減退的患者。臨床研究發現甲狀腺功能減退合并冠狀粥樣硬化的患者是沒有甲狀腺功能減退的患者的兩倍。另一方面,給予足夠的甲狀腺激素替代治療可能會對病情的發展起到抑制作用[10]。人們已達成共識,即原發性甲狀腺功能減退或亞臨床甲狀腺功能減退與動脈粥樣硬化有相關性,而動脈粥樣硬化是心血管疾病的危險因素[1,11]。最近,有兩個獨立的臨床研究將煙霧病患者與非煙霧病的卒中患者及健康人的甲狀腺抗體含量進行對比,在這兩個臨床研究中,分別有63名和118名煙霧病患者接受了調查。結果發現甲狀腺自身抗體的升高出現在煙霧病患者中要比在非煙霧病的卒中患者中更加常見[8,12]。并且發現升高的甲狀腺自身抗體是煙霧病的獨立風險因素之一[8,12]。Mootha等首次報道了2例煙霧病患兒合并下丘腦功能異常的病例,其中1例患兒表現為原發性甲狀腺功能低下。作者認為二者之間有相關性[3]。Malik等認為甲狀腺受體抗體與來自大腦動脈的某種抗原的交叉反應可導致免疫介導的血管炎,導致MMS。在此過程中,T3間接增強交感神經系統的反應,同時升高的甲狀腺激素水平可能增加交感神經系統的敏感性,進而促進顱內大動脈的阻塞,最終引起卒中[6]。由此看來,進一步支持該患者的兩種疾病可歸于一元論解釋。據我們了解,到目前為止,尚沒有成年患者患有煙霧病合并原發性甲狀腺功能減低的相關報道。本病例中,MMS和甲狀腺功能減退同時出現于同一成年患者,該患者抗甲狀腺過氧化物酶抗體、抗甲狀腺球蛋白抗體遠遠高出正常值,患者的葉酸、B12低于正常值,并伴有貧血,且貧血表現為慢性病貧血,考慮可能為自身免疫性疾病所致,以上證據表明其存在免疫功能異常。同時有頸部彩超和影像學方面的原發性甲減和煙霧病的相關證據。因此,我們認為該患者MMS的病情發展可能與其原發性甲狀腺功能減退及自身免疫有關。
此外,本例患者CTA(見圖1A~E)示左側大腦后動脈受累,此類病變不同于經典的煙霧病患者。曾有文獻報道證實煙霧病不僅累及前循環,同時也累及后循環的大腦后動脈(PCA),PCA不僅參與側枝循環代償,同時亦可發生狹窄和閉塞的可能性[13]。提示這部分患者的血管病變機制可能存在這不同于以往報道的煙霧病的血管病變機制。通常,青少年多以短暫性腦缺血發作和腦梗死起病,而以腦出血發病的臨床上在成年人多見[1]。對于血管閉塞型煙霧病的患者,通常采用血管重建術進行治療。endo等[2]報道了對58例煙霧病的患者進行了血管重建術,其中有4例合并有Graves病。對于出血型Moyamoya病的患者通常采用營養神經、促進出血吸收、對癥及支持治療。
本病例表現為出血型,我們同時給予甲狀腺激素替代治療后血管病變未繼續發展。說明對于合并有甲狀腺功能減低的患者甲狀腺激素替代治療或許會阻止病變進展。由于該患者的甲狀腺自身抗體在治療后沒有恢復正常水平,鑒于甲狀腺自身抗體與煙霧病之間的相關性,長期的隨訪是必要的。
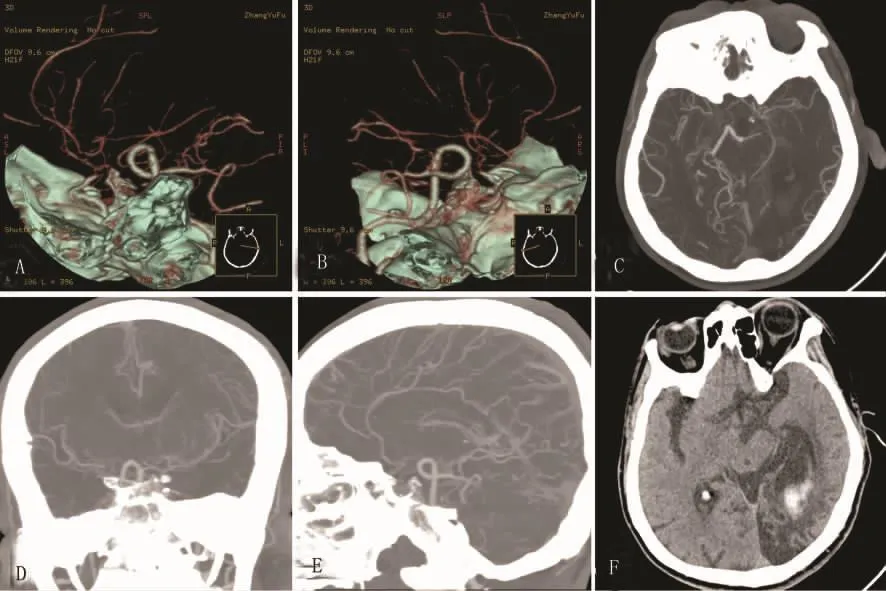
圖1 頭部CTA(A~E):雙側頸內動脈管壁鈣化,腦內血管多發狹窄(雙側大腦前、中,雙側頸內動脈、左側大腦后動脈)頭部CT(F):左側顳枕葉腦軟化灶,腦室系統積血
[1]Squizzato A,Gerdes VE,Brandjes DP,etal.Thyroid diseases and cerebrovascular disease[J].Stroke,2005,36:2302-2310.
[2]Endo H,Fujimura M,Niizuma K,etal.Efficacy of revascularization surgery formoyamoya syndrome associated with Graves'disease[J].Neurol Med Chir(Tokyo),2010,50:977-983.
[3]Mootha SL,RileyWJ,Brosnan PG.Hypothalamic-pituitary dysfunction associated with Moyamoya disease in children[J].JPediatr Endocrinol Metab,1999,12:449-453.
[4]Touho H,Yamada Y,Kuroiwa T,etal.Clinical study of acute brain swelling during operation for moyamoya disease[J].No Shinkei Geka,2010,38:1097-1101.
[5]Hsu SW,Chaloupka JC,Fattal D.Rapidly progressive fatal bihemispheric infarction secondary to Moyamoya syndrome in association with Graves thyrotoxicosis[J].AJNR Am JNeuroradiol,2006,27:643-647.
[6]Malik S,Russman AN,Katramados AM,etal.Moyamoya syndrome associated with Graves'disease:a case reportand review of the literature[J].JStroke Cerebrovasc Dis,2011,20:528-536.
[7]Ohba S,Nakagawa T,MurakamiH.ConcurrentGraves'disease and intracranial arterial stenosis/occlusion:special considerations regarding the state of thyroid function,etiology,and treatment[J].Neurosurg Rev,2011,34:297-304.
[8]Kim SJ,Heo KG,Shin HY,etal.Association of thyroid autoantibodies withmoyamoya-type cerebrovascular disease:a prospective study[J].Stroke,2010,41:173-176.
[9]Lee R,Sung K,Park YM,etal.A case of Moyamoya disease in a girl with thyrotoxicosis[J].YonseiMed J,2009,50:594-598.
[10]Utku U,Asil T,Celik Y,Tucer D,etal.Reversible MR angiographic findings in a patientwith autoimmune Graves disease[J].AJNR Am JNeuroradiol,2004,25:1541-1543.
[11]Razvi S,Shakoor A,Vanderpump M,etal.The influence of age on the relationship between subclinical hypothyroidism and ischemic heart disease:ametaanalysis[J].JClin Endocrinol Metab,2008,93:2998-3007.
[12]Li H,Zhang ZS,Dong ZN,etal.Increased thyroid function and elevated thyroid autoantibodies in pediatric patientswithmoyamoya disease:a case-control study[J].Stroke,2011,42:1138-1139.
[13]Mugikura S,Takahashi S,Higano S,etal.Predominant involvement of ipsilateral anterior and posterior circulations in moyamoya disease[J].Stroke,2002,33:1497-1500.

