3種化學鍵離解能的區別和聯系
羅渝然
(中國科學技術大學化學與材料科學學院 安徽合肥 230026)
1 大一學生提出的問題
我們使用《普通化學原理》(第3版)[1]做大一學生的參考教材。在答疑課時,一位學生問:該書第278頁的下部注釋如何理解?為什么氫分子中的H—H鍵(離解)能有3個數值(458,432和436kJ/mol)?我的回答是:這一現象有普遍性,任何分子都有此特性,你們的知識還不夠,先承認它吧。進入高年級課程,答案自然會有。
我的回答是“想當然”。因我長期旅居海外,不熟悉國內現行各大學教材之間的銜接。但隨后,我查閱了物理化學、量子化學、結構化學等許多版本的國內教材。令我驚訝的是,這些教材并沒有提供上一問題的答案。我認為,它是各專家在為本科生“編織多維知識網”(編寫各分支學科大學教材)時的一處遺漏。
學生要理解上一問題,需要有分子振動、零點能、分子轉動、化合物等壓熱容、熱力學標準條件和非標準條件下化合物焓變等預備知識。這些知識分別屬于分子物理學、物理化學、化學熱力學、統計熱力學、結構化學、量子化學、光譜學和質譜學等分支學科。國內某些物理化學、量子化學、光譜學及材料學的教材,討論過De和Do之間的區別與聯系。但沒有任何大學教材討論De,Do,D2983者之間的區別與聯系。這確實遺憾。建議專家在編寫新教材時,關注分支學科之間相互交叉、相互滲透、又很有實用價值的教學內容。
2 我們的論述
為了理解De,Do,D2983者之間的區別與聯系,首先要搞清De,Do,D298的不同定義。文獻[2]和文獻[3]論述了這一問題。De,Do,D298這3個物理量有相同點,也有不同點。相同點是三者都討論1mol理想氣體的RX發生化學鍵離解反應(1)的能量變化。

(1)
這里,R與X是碎片(原子、分子、自由基或離子等)物種,RX是其締(化)合物。
De,Do和D298是離解反應(1)對應不同溫度下物理量,各有不同的明確定義,如圖1所示。
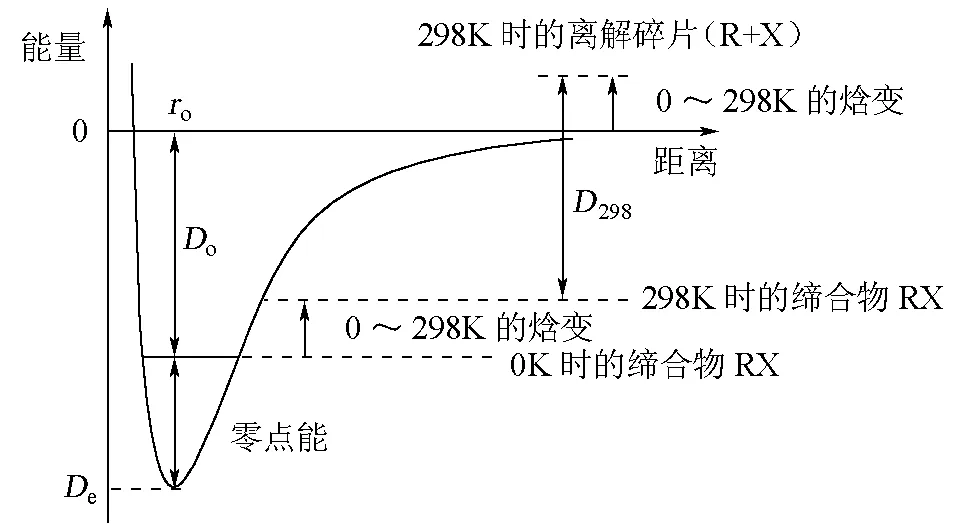
圖1 De,Do和D298的區別和聯系[2-3]
圖1中De是0K時的純理論的鍵(離解)能,源于量子化學計算,很難用實驗技術直接測量。此物理量又叫碎片物種(R+X)之間在0K時的結合能(binding energy)。
通常,碎片物種(R+X)與締(化)合物RX在不斷地平動、轉動和振動。但在0K時,平動和轉動自由度凍結。碎片物種(R+X)與締(化)合物RX的振動能之差,叫零點能(zero point energy,ZPE)。如圖1所示,Do和De通過零點能相關:
Do=De-Δ(零點能)
(2)
這里,Δ(零點能)=零點能(R)+零點能(X)-零點能(RX)。等式右端3項,分別對應于多原子碎片與締合物中的零點能。對于雙原子分子(或離子),零點能的計算特別簡單:

(3)
這里,h是Planck常數,ν和ωe分別代表雙原子分子(或離子)中的基態振動頻率和光譜常數。
化學鍵的鍵(離解)能D298定義為在熱力學標準條件下,1mol理想氣體RX中化學鍵R—X發生離解反應(1)時的焓變。對化學鍵均裂過程,按Hess定律,得:
D298(R—X)=ΔfH?(R) + ΔfH?(X)-ΔfH?(RX)
(4)
這里,ΔfH?(R),ΔfH?(X)和ΔfH?(RX) 分別代表碎片和締合物是理想氣體時的標準生成熱(焓)。
與Do明顯不同,D298(R—X)是298.15K時的物理量。溫度從0K上升到298.15K,多原子碎片和締合物中許多自由度被激發,這分別相應于碎片和締合物從0K到298.15 K的焓變。從圖1看到,D298(R—X)就是298.15K時,產物(R+X)與反應物RX的標準生成熱的差值,即式(4)。
表1的前4欄總結了De,Do和D298的區別,包括相應溫度、對研究化學過程的重要性以及數據來源等。對于研究實際的化學反應,D298的概念遠比De和Do更有價值也更加重要,測量方法也多得多(見表1第4欄),已積累的D298實驗數據近兩萬個(見表1第5欄)。

表1 De,Do和D298的區別
順便提一句,本短文不涉及平均鍵能。因為曾經有過歷史功績的平均鍵能法在今天其實用價值已經喪失。關于這一問題,筆者已在另處討論[5]。
3 雙原子分子的鍵離解
對于雙原子分子(或離子),De、Do和D298的區別和聯系很簡單。按分子物理學中的能量均分定律,等壓條件下,離解反應(1)前后的等壓熱容改變為:
ΔCp=R/2+R=3R/2
(5)
從0K到298.15 K,等壓熱容改變對焓變的貢獻是ΔCp×(298.15-0)。因此,Do和D298的關系是:
(6)
下面以氫分子的H—H鍵離解為例,詳細敘述De(H—H),Do(H—H)和D298(H—H)的區別和聯系。
首先,計算氫分子中的零點能:

這里,ωe的數值取自文獻[4]。
2004年,張彥鵬和他的同事[6]用高分辨脈沖激光光譜技術測量獲得:
Do(H—H)=36118.062±0.010cm-1(432.0619±0.0001kJ/mol)
這一測量值的精度非常高,遠遠超過“化學精度”(±4.184kJ/mol),進入了“光譜精度”(±1cm-1或±0.0120kJ/mol)。根據這測量值,我們可推算:
De(H—H)=Do(H—H)+零點能=432.0619+26.3251=458.3870±0.0001kJ/mol
以及氫分子的H—H鍵能測量值[2-3,7]:
D298(H—H)=Do(H—H)+3.71805=435.7799±0.0001kJ/mol
表1的右邊最后欄,歸納了根據張彥鵬等[6]觀測的Do(H—H)推算出來的De(H—H)和D298(H—H)數值。
4 為什么手冊上很難查閱到De和Do的數值?
在大型工具書“CRCHandbookofChemistryandPhysics”中[7],筆者列舉了約3700個典型雙原子和多原子物種(分子、離子、自由基、絡合物等)中的化學鍵的D298數值,Dr.Lide介紹了大約270個雙原子分子的De值,該大型手冊沒有直接給出Do值。在文獻[3]中,筆者提供了近2萬個化學鍵的D298數值。這本最新的化學鍵能數據大全,也不提供De和Do的數值。為什么手冊上很難查閱到化學鍵的De和Do的數值? 主要理由有以下兩點:
1) 對研究實際的化學反應,D298數值遠比De和Do的數值更有價值。De和Do是絕對0度時的物理量。0K下,分子的平動自由度被凍結,分子之間沒有碰撞,分子不可能發生化學反應。這叫化學第零定律[8-9]。換句話說,只有在溫度大于0K,化學反應才發生。De和Do等絕對0度時的物理量,有理論上的重要性,而對實際化學反應僅有參考價值。反之,D298數值是熱力學標準狀態下的物理量。D298與其他熱力學標準狀態下的其他物理量互相緊密關聯,例如自由原子和自由基的標準生成熱(焓)。雖然幾乎所有的化學反應不是在熱力學標準狀態下發生,但是按化學熱化學的規律,可預測實際條件下(遠偏離熱力學標準狀態)的化學過程。這些轉換細節,在化工熱力學的教材中有豐富的文字說明。
2) 觀測化學鍵的D298值的方法要比測量Do的方法多很多,積累的化學鍵的D298測量數據已近兩萬[3,7,10],而Do的測量數據相對很少。正因為這原因,化學出版物逐漸形成一條不成文的習慣約定,如果在文章中沒有特殊強調和文字交代,提到某化學鍵的鍵離解能的數值,就是指D298值。但是在光譜學和質譜學的文獻中,某化學鍵的鍵離解能的數值,通常是指Do值,即直接從實驗獲得的值。
在收集、選擇、評論、構建化學鍵能數據庫時[2-3,7,10],考慮到上面提及的習慣約定和絕大多數讀者的要求,我們已經把從光譜和質譜測量獲得的Do數據轉換成D298值,即沒有同時列出Do和D298值。如果某些讀者希望知道當初觀測的Do數據,可查閱數據庫中[3,7,10]提供的原始文獻。
總之,目前大學教材僅論述De和Do之間的區別與聯系,忽略了在討論化學反應時更有實際價值的D298。有人對國內教材給出如下評論:當前教材多考慮自身理論系統的完整性 (這頗像自耕農在幾畝土地內多年辛勤地精耕細作),不僅與現代科學中的實際問題聯系很不夠,而且經常避開相互交叉、相互滲透、靈活與多角度的科學課題。本文為該評論觀點提供了又一個實例。
5 精確觀測的鍵能數值將沖擊精確的量子化學計算
眾所周知,目前任何量子化學計算(分子軌道法,密度泛函法)均非嚴格的,都需要輸入若干可靠實驗數據(其中包括自由原子的標準生成熱(焓))用于選擇或調整。因為精確的鍵能觀測值可推算出自由原子的標準生成熱(焓),故它有可能沖擊精確的量子化學計算。下面看一個實際例子。2005年,莫宇翔小組利用離子速度成像法[11],給出:
Do(F—F)=1.606±0.001eV(154.952±0.096kJ/mol)
Do(F+—F)=3.334±0.001eV(321.674±0.096kJ/mol)
F—F和F+—F都是雙原子物種,利用式(6),我們推算出熱力學標準條件下的鍵能:
D298(F—F)=158.670±0.096kJ/mol
D298(F+—F)=325.393±0.096kJ/mol
根據Hess定律和鍵(離解)能的定義,我們推算出氟原子的標準生成熱(焓):
ΔfH?(F)=D298(F—F)/2=79.335±0.068kJ/mol
這個由莫宇翔小組2005年測量結果導出的氟原子的標準生成熱比CODATA(Committee on Data for Science and Technology,國際科學技術數據委員會)在1984年推薦的、至今仍被文獻接受的79.38±0.30kJ/mol更精確。我們建議,在用量子化學方法研究氟化合物的化學反應時,最好采用更精確的氟原子的標準生成熱(焓),ΔfH?(F)=79.335±0.068kJ/mol。基于后一數據的量子化學計算,將使含氟化合物的理論預測更精細化。
6 結論與建議
(1) 國內化學教材在為本科生編織多維知識網時,遺漏了一個重要的內容,即沒有討論3種化學鍵離解能(De,Do,D298) 的區別和聯系。
(2) 本短文論述了3種化學鍵離解能(De,Do,D298) 的區別和聯系,并以氫分子的H—H鍵離解為例,給出了詳細的解釋。
(3) 在實際化學反應中,描述化學鍵斷裂和生成的D298的概念和數據遠比De和Do更有實用價值,因此,建議把3種化學鍵離解能(De,Do,D298) 的區別和聯系,增補到新版的物理化學或有關大學教材之中。這有利于靈活、多角度教學,使大學生了解鍵能的準確概念(化學中的最基本概念之一),以及它的廣泛應用。
參 考 文 獻
[1] 華彤文,陳景祖,嚴洪杰,等.普通化學原理.第3版.北京:北京大學出版社,2005
[2] 羅渝然,郭慶祥,俞書勤,等.現代科學中的化學鍵能及廣泛應用.合肥:中國科學技術大學出版社,2008
[3] Luo Y R.Comprehensive Handbook of Chemical Bond Energies.USA:CRC Press,2007
[4] Haynes W M.CRC Handbook of Chemistry and Physics.92nd ed.USA:CRC Press,2011
[5] 羅渝然,俞書勤,張祖德.大學化學,2011,26(4):67
[6] Zhang Y P,Cheng C H,Kim J Y,etal.PhysRevLett,2004,92:203003
[7] Luo Y R.Bond Dissociation Energies∥CRC Handbook of Chemistry and Physics.92nd ed.USA:CRC Press,2011
[8] 羅渝然,俞書勤,張祖德,等.大學化學,2010,25(4):78
[9] 羅渝然,Benson S W.化學通報,1989(10):22
[10] 羅渝然.化學鍵能數據手冊.北京:科學出版社,2005
[11] Yang J,Hao Y,Li J,etal.JChemPhys,2005,122:134308

