熱力學平衡中的假想態淺議
陳良坦
(廈門大學化學化工學院 福建廈門 361005)
物理化學邏輯性強,一般的常規研究方法如對立統一的辯證方法,歸納與演繹的邏輯方法,對復雜體系引入假設并建立模型、最后上升為理論的數學物理方法等都在物理化學的研究中被普遍應用。下面談談假想態概念在處理熱力學平衡規律中的作用。
1 稀溶液體系中溶質的化學勢等溫式
在稀溶液中,溶質B的化學勢等溫式依濃度表示形式的不同而變:
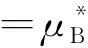
(1)
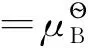
(2)
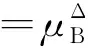
(3)
事實上,上述3式不但適用于揮發性溶質,而且可用于難揮發性溶質。物質的揮發性與否都是相對的,“假想態”反映的是高濃度溶質偏離亨利定律的行為,而與溶質的揮發性大小或在氣相中的行為無關。因此,只要溶質在氣相中存在并與液相達平衡,則通過相同的導出方法,同樣可導出不揮發溶質的化學勢等溫式。當然,為避免引入困惑,最好將“不揮發溶質”改為“難揮發溶質”,盡管僅一字之差,但結論卻截然不同。原則上,不揮發溶質并無化學勢等溫式可言。
在稀溶液中溶質化學勢等溫式的推導過程中,引入假想態概念的好處有:
① 賦予化學勢等溫式中的各項以明確的物理意義;
② 等溫式只與溶質的液相性質有關,而與溶質在氣相中的行為無關;
③ 使公式簡化的同時又不影響實際計算結果。
2 非均相反應體系中平衡常數的計算
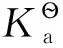


Hg2Cl2(c1) 2AgCl(c2)
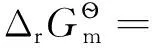
(4)
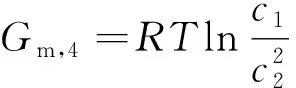
將有關結論代入式(4)并整理可得:
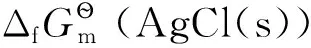
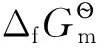
3 在電化學平衡體系中的應用
可利用假想態的引入求得無法從實驗上測定的標準電極電勢值。如對下列反應:
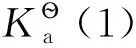
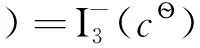
(5)
由于碘的飽和濃度很低(298K時,cs=1.320×10-3mol·dm-3),因此,I2(c?)是假想態,這說明E?無法從實驗上直接測量得到。
可借助下列過程求E?(I2/I-):
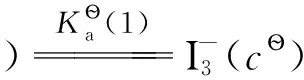
(A)

I2(cs)

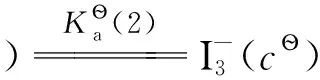
(B)
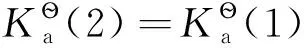
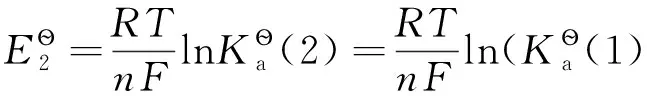
(6)
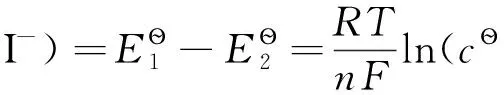
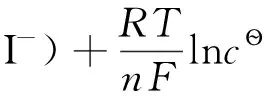
(7)
式(7)中的cs=1.320×10-3mol·dm-3,E?(I2(s)/I)=0.540V,代入可求得E?(I2/I-)=0.625V。
綜上所述,在物理化學的教學和計算中,合適地引入假想態,可方便公式的推導、引導和拓展學生的思路;也有利于學生分析能力和創新能力的培養。
參 考 文 獻
[1] 高盤良.物理化學學習指南.北京:高等教育出版社,2002
[2] 孫世剛.物理化學(上).廈門:廈門大學出版社,2008

