南陽黃牛CD14基因擴增及序列分析
馬蓓蓓,龍 塔,薛 云,周 峰,趙戰勤
(河南科技大學 a.動物科技學院;b.醫學技術與工程學院,河南洛陽471003)
0 前言
牛白細胞分化抗原14(CD14)是一種存在于單核細胞、巨噬細胞、樹突狀細胞等免疫細胞表面的分化抗原。CDl4是一種模式識別受體蛋白,它能識別多種革蘭氏陽性菌和陰性菌的細胞壁成分,如磷酸脂多糖、肽聚糖等,將其傳遞給Toll樣受體蛋白,激活單核巨噬細胞,引起一系列炎癥促進因子和炎癥抑制因子的表達。因此,CD14是天然免疫系統的重要成分之一,是啟動和介導病原微生物抗原信號轉導途徑的關鍵分子,與多種傳染病的發生、發展和預后密切相關[1-3]。CD14對研究感染與免疫的發生機理意義重大。南陽黃牛是分布在南陽地區的地方特有品種,是中國五大良種之一,且是分布最廣的品種。南陽黃牛肉質好,生產周期短,其抗病性尤其引人關注[4],研究表明:南陽黃牛對如結核病等傳染病的抵抗力遠優于奶牛,但其遺傳分子機制未明。近些年來,國際上已在DNA水平上對奶牛進行了一些研究,主要涉及到奶牛的分子群體遺傳特征及起源進化、經濟性狀分子遺傳標記及相關功能基因多態性研究等[5]。但對南陽黃牛的基因研究仍鮮見報道。CD14是重要的病原微生物識別受體蛋白,但南陽黃牛CD14基因的生物學信息分析還從未有過詳盡研究。
本文通過擴增南陽黃牛CD14基因完整編碼區和近端非編碼區,對基因結構及其編碼的氨基酸進行了生物信息學分析,了解中原地區南陽黃牛CD14基因的生物信息學特點,獲得的參數為今后研究南陽黃牛的抗病性提供試驗依據,也為進一步的群體遺傳學的研究奠定基礎。
1 材料與方法
1.1 材料
采用南陽黃牛中心產區典型群隨機抽樣的方法在河南省南陽地區采集黃牛血樣。頸靜脈采血10 mL,用ACD抗凝劑1∶6(體積比)抗凝,-70℃冰箱凍存[6]。用鹽析法進行基因組DNA的提取。
1.2 主要試劑和儀器
基因組提取試劑盒、Taq DNA聚合酶、dNTPs、D16000-DNA Marker及有關緩沖液等均購自上海Sagon公司。GeneAmp PCR儀、Tanon 1600凝膠成像系統、北京市六一儀器廠DYY-10C型電泳儀等。
1.3 引物序列設計
參照GenBank上已發表的荷斯坦奶牛的CD14基因序列(登錄號:D84509.1),使用Premier5.0軟件設計擴增CD14基因編碼區的引物,分4段擴增,引物由上海Sagon公司合成,序列見表1。
1.4 PCR擴增
PCR 反應體系為 30 μL,包括:3 μL 10 × PCR Buffer,1 μL Taq 酶,2 μL MgCl2,10 μmol的上下游引物各 1 μL,1 μL 模 板 DNA,2μL dNTPs,然后加滅菌雙蒸水 19 μL 至30 μL。PCR反應程序為:94℃預變性5 min,94 ℃變性 30 s,58.5 ℃退火30 s,72 ℃延伸 50 s,30 個循環,最后72℃總延伸10 min,4℃保存。PCR產物通過1%(質量分數)瓊脂糖凝膠電泳鑒定后進行序列測定(由上海Sagon公司完成)。
1.5 序列的分析與結構預測
利用DNAstar軟件將擴增的序列與GenBank上已發表的荷斯坦奶牛、水牛、豬、山羊、綿羊、人、獼猴、大猩猩、小鼠的CD14基因序列進行同源性比較,制作進化樹;用NCBI中的ORF Finder軟件進行開放閱讀框的識別,翻譯成氨基酸序列;TMHMM Server v.2.0預測跨膜結構[7]。

表1 引物序列
2 結果
2.1 南陽黃牛CD14基因的PCR擴增結果
電泳結果表明PCR產物特異性良好(見圖1)。4段產物長度分別為:1 578 bp(見圖1a),832 bp(見圖1b)、825 bp(見圖1c)、747 bp(見圖1d),電泳結果與預期片段大小相符。
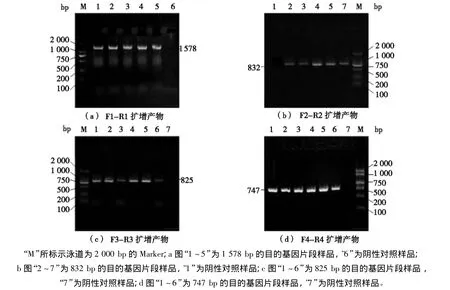
圖1 CD14基因PCR擴增
2.2 南陽黃牛CD14基因測序結果和氨基酸序列推導
CD14基因PCR產物經純化后,送生物公司進行DNA測序。拼接4段擴增片段結果,獲得牛CD14基因的完整序列。堿基組成的含量分別為 A(18.4%)、T(18.4%)、C(32.9%)、G(30.2%)。通過NCBI的ORF Finder軟件進行開放閱讀框的識別,得到南陽黃牛的CD14基因編碼區共966 bp,與GenBank已公布的荷斯坦奶牛CD14基因序列(登錄號:D84509.1)比較,有2個堿基突變;5’端非編碼序列長度為1 543 bp,發生了2個堿基突變;3’端非編碼序列長460 bp,發生了5個堿基突變(見表2)。南陽黃牛CD14基因核苷酸共編碼321個氨基酸,與荷斯坦奶牛相比,南陽黃牛位于編碼區的2個DNA突變并沒有引起氨基酸序列的改變。

表2 南陽黃牛與荷斯坦奶牛CD14基因核苷酸序列的比對結果
2.3 南陽黃牛CD14基因的同源性比對
通過MegAlign軟件得到南陽黃牛CD14基因的序列與GenBank中荷斯坦奶牛、水牛、綿羊、山羊、豬、獼猴、大猩猩、人、小鼠的同源性分別為 99.8%、98.2%、96.8%、92.8%、83.5%、79.8%、79.7%、79.5%、71.9%,如圖2所示。
2.4 南陽黃牛CD14進化樹構建
利用DNAStar中的MegAlign軟件對物種間的系統發生樹進行構建(見圖3)。系統發生樹總體分為兩支,小鼠單獨為一支,南陽牛、荷斯坦奶牛、水牛、豬、山羊、綿羊、人、獼猴、大猩猩為另一獨立的大支。南陽黃牛與荷斯坦奶牛聚在一起,再與水牛聚為一類,山羊和綿羊先聚在一起,再與南陽牛、荷斯坦奶牛、水牛聚為一類,然后再與豬聚為一類。人和猩猩先聚在一起,再與獼猴聚為一類,然后再與南陽牛、荷斯坦奶牛、水牛、山羊、綿羊和豬共同聚為一支。
2.5 南陽黃牛CD14跨膜結構預測
通過TMHMM Server v.2.0在線分析發現CD14蛋白沒有跨膜結構域,見圖4。
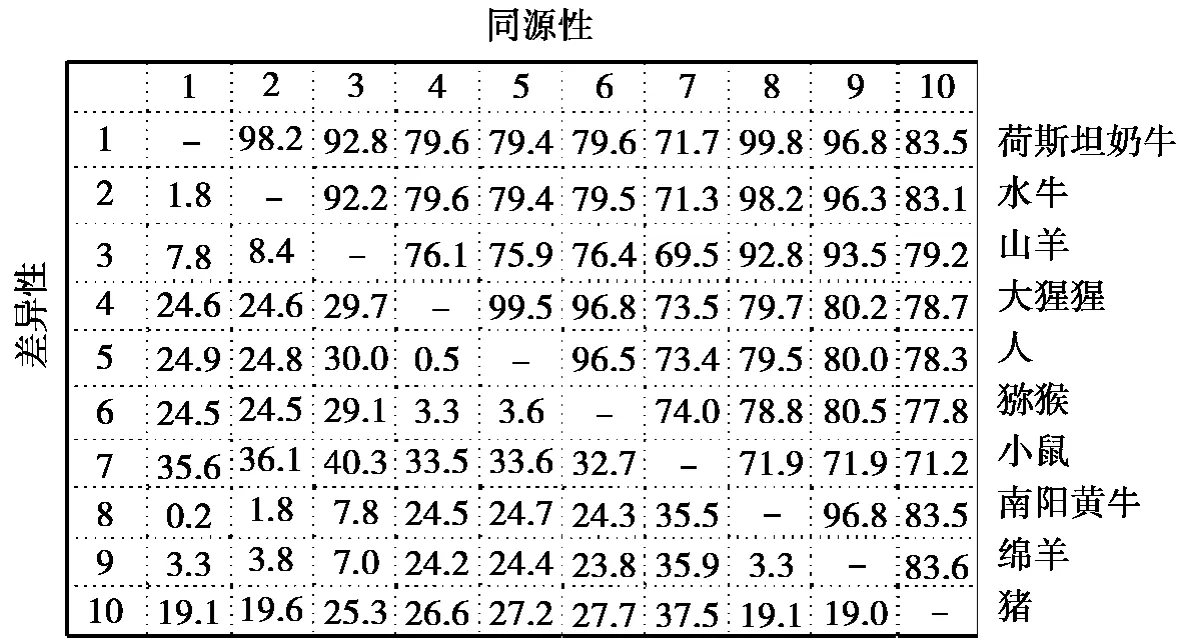
圖2 南陽黃牛與其他動物的CD14基因同源性比較
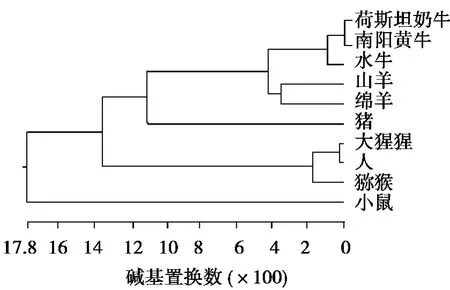
圖3 南陽黃牛CD14基因進化樹
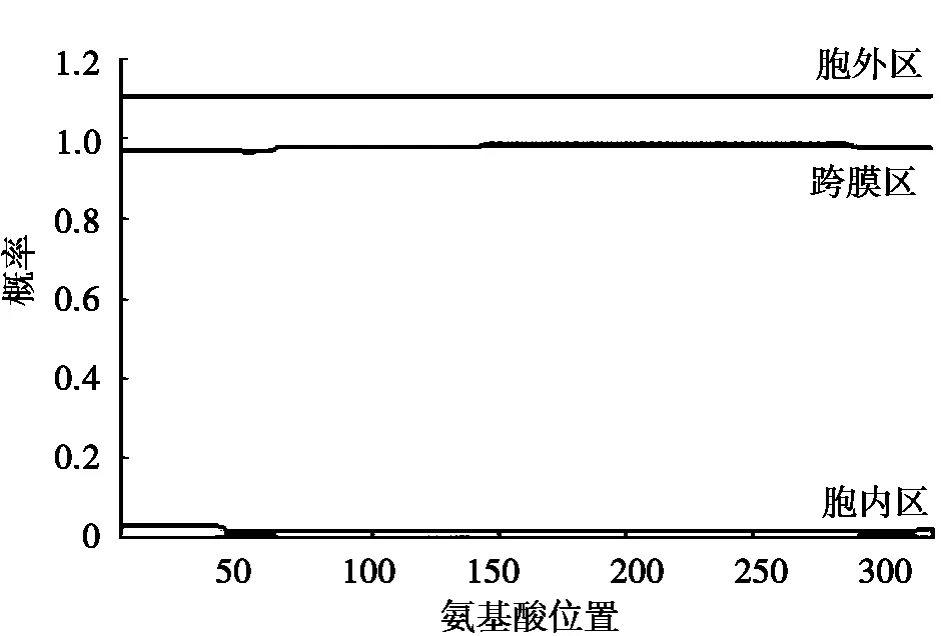
圖4 南陽黃牛CD14跨膜結構預測分析圖
3 討論
參照GenBank上已發表的荷斯坦奶牛的CD14基因序列(登錄號:D84509.1),設計了4對引物,擴增了涵蓋南陽黃牛CD14基因非編碼區和完整編碼區的目的片段,之后進行序列測定和拼接,成功獲得了CD14基因的全部序列。通過NCBI的ORF Finder軟件進行開放閱讀框的識別,得到南陽黃牛CD14基因開放閱讀框全長966 bp,共編碼321個氨基酸。堿基組成為A(18.4%)、T(18.4%)、C(32.9%)、G(30.2%)。A+T的含量(36.8%)顯著低于G+C含量(63.1%),這一模式與水牛、野牛等其他品種的牛CD14基因相似,但與其他動物具有一定差異[8]。
在南陽黃牛CD14基因的5’端發現了長1 543 bp的非編碼區,與已發表的荷斯坦奶牛CD14基因序列相似度很高[9],經比對有2個接近編碼區的堿基發生突變;南陽黃牛CD14基因的編碼區966 bp,與荷斯坦奶牛相比發生了2個堿基突變;在3’端也發現了一段較長的非編碼區,長460 bp,與荷斯坦奶牛對比發生了5個堿基突變。盡管發現數個堿基突變,南陽黃牛CD14氨基酸序列與荷斯坦奶牛完全一致。通過TMHMM Server v.2.0分析發現南陽黃牛CD14基因編碼的氨基酸序列沒有跨膜結構域(見圖4),驗證了CD14確屬細胞表面糖蛋白家族成員之一,可能作為一種特異性的單核細胞和巨噬細胞表面標記物,在機體免疫、防御系統引起的一系列病理反應中起關鍵作用[10]。
通過MegAlign軟件將南陽黃牛CD14基因的序列與GenBank中荷斯坦奶牛、水牛、豬、山羊、綿羊、人、獼猴、大猩猩、小鼠等物種同源核苷酸序列進行比對。結果表明:南陽黃牛與荷斯坦奶牛的同源性最高,達到99.8%,與水牛、綿羊和山羊的同源性較高,分別為98.2%、96.8%、92.8%,由此證明了CD14基因在反芻動物間的高度保守性。由圖3進化樹分析圖表明:南陽黃牛與荷斯坦奶牛、水牛、綿羊、山羊、豬、獼猴、大猩猩、人、小鼠的親緣關系依次變遠。與豬、獼猴、大猩猩、人的同源性分別為83.5%、79.8%、79.7%、79.5%,與小鼠同源性最低,僅為71.9%。通過MegAlign構建的進化樹(見圖3)可以看出:各物種的分化與物種進化規律一致,牛和羊同為反芻類動物,因此聚為一支,而人與大猩猩和獼猴同為靈長類動物,因此聚為一支,符合物種遺傳距離遠近的實際情況。
CD14基因系統發生關系上與各物種間的親緣關系密切,說明了該基因在物種進化過程中保守性很高,在動物生命活動中起到很重要的作用[11]。本試驗再一次證明了CD14基因在反芻動物之間進化過程中保守性很高,從而可以推測反芻動物CD14基因轉錄、翻譯及其作用機制等都可能是相似的。另外,研究還發現不同物種間的牛CD14基因序列存在一定程度的差異。結合牛CD14基因的功能來推測,這可能與不同物種的遺傳差異性、生長環境等都有很大的關系。
目前,對人CD14基因的結構和功能研究已經比較深入,在細菌、病毒、真菌感染以及抗腫瘤作用方面表現出巨大的應用前景[2,12-13]。但是對于牛CD14基因的研究方面,僅有國外少量報道,尤其對中國南陽黃牛這一中原地區主要地方品種的研究更為鮮見。本文對南陽黃牛CD14基因進行了擴增和序列分析,為研究南陽黃牛抗病性強的分子機制,與其他牛種的分子遺傳學差異,為中國進一步開發、應用南陽黃牛優秀的品種資源打下了基礎。
4 結論
利用生物信息學技術對南陽黃牛CD14基因的核苷酸和推導氨基酸序列進行了分析和預測,初步了解該基因的結構特點,這對于進一步開展南陽黃牛CD14分子的結構功能、揭示病原微生物入侵宿主的致病機制以及設計免疫預防控制技術和抗病育種策略等方面都有重要的理論價值。
[1]薛云.CD14和TLR2基因多態性與中國漢族人群結核病易感性的關聯研究[D].杭州:浙江大學,2010.
[2]陳敏,吳斌,李文.CDl4基因-159 C/T位點多態性對哮喘患者血漿IL-5的影響[J].山東醫藥,2009,49(5):13-15.
[3]張海鄰.TLR4和CD14基因多態性和兒童特應性疾病的相關性研究[D].杭州:浙江大學,2006.
[4]梁子安,魯云風,文禎中,等.南陽黃牛可持續發展探討[J].安徽農業科學,2006,34(18):4592-4596.
[5]吳波,張書環,鄧銓濤,等.四種牛分枝桿菌特異性蛋白融合表達及在牛結核病診斷中的臨床應用[J].中國奶牛,2007(10):16-19.
[6]李興芳,柏學進,龔宜超,等.渤海黑牛H-FABP基因外顯子2的序列測定與分析[J].安徽農業科學,2009,37(10):4436-4438.
[7]巨向紅,徐漢進,雍艷紅,等.巴馬香豬Toll樣受體4基因cDNA的克隆及生物信息學分析[J].中國實驗動物學報,2010,18(3):185-190.
[8]韋葉生,藍艷,劉運廣,等.廣西地區漢族人群CDl4基因啟動子-159C/T多態性研究[J].廣東醫學,2006,27(2):179-181.
[9]Ibeagha-Awemu E M,Lee J W,Ibeagha A E,et al.Bovine CD14 Gene Characterization and Relationship Between Polymorphisms and Surface Expression on Monocytes and Polymorphonuclear Neutrophils[J].BMC Genetics,2008,9:50.
[10]劉振華.牛可溶性CD14基因的克隆表達及對脂多糖毒性的保護作用的初步研究[D].揚州:揚州大學,2008.
[11]白潔,王威,蔭俊,等.可溶性CD14基因克隆及序列分析[J].生物技術通訊,2001,12(2):94-95.
[12]董蕻.CD14基因啟動子區SNP分析及其與LPS反應的關系[D].重慶:第三中醫大學,2004.
[13]許長瓊,王偉,王懷寧,等.CD14基因多態性與嚴重感染患者炎癥介質及預后的關系[J].中國醫師雜志,2009,11(1):45-47.

