1,25-二羥維生素D3對大鼠腎間質纖維化的作用研究
榮智利,張 旭,張翠薇,高 岑,江 燕,馬躍榮
瀘州醫學院病理教研室,四川瀘州 646000
腎間質纖維化(renal interstitial fibrosis,RIF)是一個多步驟、連續的動態過程,是各種慢性腎臟疾病發展至終末期的共同通路和主要病理改變[1],其變化的程度和范圍決定了腎功能的惡化程度[2-4]。單側輸尿管梗阻(unilateral ureteral obstruction,UUO)大鼠是一種經典的RIF動物模型,既可短期內致使腎間質纖維化,模擬慢性腎病時腎間質的病理表現,又可使病變局限在腎小管和腎間質,不引起腎小球及其他組織的損傷[5]。近期研究顯示,1,25-二羥維生素 D3〔1,25-dihydroxyvitamin D3,1,25-(OH)2D3〕 主要通過與其特異性受體結合發揮經典的骨鹽調節作用,并參與免疫調節、調控激素分泌和細胞有絲分裂、抑制細胞增殖、分化及凋亡等過程[6]。 1,25-(OH)2D3受體可選擇性表達于腎臟的近曲小管、遠曲小管、集合管和髓袢升支[7],但其是否在RIF形成過程中發揮作用不詳。本研究利用1,25-(OH)2D3干預UUO大鼠,觀察其對RIF形成有無影響,以探討其在RIF過程中的作用。
1 儀器與試藥
1.1 實驗動物
雄性 SD 大鼠,45 只,8 周齡,體重(200±20) g,購自瀘州醫學院醫學實驗動物中心。
1.2 藥物和主要試劑
1,25-(OH)2D3(Roche 公司,美國),兔抗大鼠 α-SMA 多克隆抗體(Santa Cruz公司,美國),尿蛋白雙縮脲試劑盒(Amresco公司,美國)。
2 方法與結果
2.1 實驗方法
2.1.1 實驗動物分組及處置 45只SD大鼠隨機均分為假手術組、UUO 組和 1,25-(OH)2D3干預組,每組各 15只。 采用單側輸尿管結扎建立UUO大鼠模型[8]。1%戊巴比妥鈉腹腔注射麻醉后,局部剃毛和常規消毒鋪巾,選腹正中切口依次切開皮膚至腹腔,游離腎臟及輸尿管,分別在左側輸尿管近腎盂處和輸尿管上1/3處用1-0絲線兩次結扎,剪斷輸尿管,然后逐層連續縫合皮膚。假手術組進入腹腔后僅游離腎臟和輸尿管而不結扎離斷,余手術方式與UUO組相同。干預組于術后第 1天起每天腹腔注射 30 ng/(kg·d)的 1,25-(OH)2D3[9],假手術組及UUO組每天腹腔注射等量生理鹽水。分別于術后第3、7和14天處死大鼠,每次5只,取梗阻側腎臟測量其大小及形態,固定包埋后,制片行HE、Masson和α-SMA染色;開胸經心臟取血檢測肌酐和尿素氮水平;各組大鼠于處死前1天收集24 h尿液,檢測尿蛋白含量。
2.1.2 腎臟病理檢查 每張HE、Masson和α-SMA切片隨機選取10個不重復視野(×200,HPF),組內求和取其平均值作為每組最終數據。①HE染色判定腎間質損傷及纖維化程度:HE切片依據Radford[10]標準設定8個參數指標(腎小管擴張、小管萎縮、小管上皮細胞空泡變性、間質水腫、間質炎細胞浸潤、間質纖維化程度、紅細胞管型、蛋白管型),每個參數按0~3分評定(0分,正常;1分,輕度受損,病變范圍<15%;2分,中度受損,病變范圍15%~50%;3分,重度受損,病變范圍>50%),由兩個觀察者盲法評分取其平均值,每個樣本的評分為0~24分。②Masson染色判定纖維化程度:Masson染色是用于顯示組織中纖維的一種染色方法,染色切片中膠原纖維呈綠色,肌肉、纖維素和紅細胞均呈紅色,細胞核呈藍色,正常腎組織中僅腎小管基底膜染成綠色。RIF進程中膠原纖維逐步取代正常腎單位,腎實質萎縮減少。本實驗通過對膠原纖維染色,運用Image Pro Plus 6.0圖像分析軟件計算鏡下綠染面積占整個視野的百分比,以了解受損腎臟的纖維化程度。③α-SMA免疫組化染色:在本實驗中α-SMA用于標記肌成纖維細胞(myofibroblast,MFB),其陽性信號為細胞胞漿呈現棕黃色顆粒。運用Image Pro Plus 6.0圖像分析軟件計算染色陽性細胞的積分光密度值(指將陽性細胞內染色量化為綜合面積和灰度值所得到的結果,其值越大,提示抗原表達水平越高,反之亦然)。
2.1.3 腎功能檢測 采血后3 000 r/min離心分離血清,于日本7180型全自動生化分析儀上檢測血肌酐、尿素氮水平(此血生化檢查由瀘州醫學院附屬醫院檢驗科協助完成);根據尿蛋白雙縮脲試劑盒的操作說明,檢測24 h尿蛋白含量。
2.1.4 統計學方法
用SPSS 17.0統計軟件進行統計學處理,所有數據采用均數±標準差(±s)表示,多組間計量資料比較用單因素方差分析(One-way ANOVA test),兩兩比較采用 Dunnett-t檢驗。以P<0.05為差異有統計學意義。
2.2 腎臟病理學改變結果
2.2.1 肉眼病理改變 假手術組患側腎臟大小形態正常;UUO組和干預組梗阻側腎臟均明顯腫大,顏色變淺,表面張力增加,有尿液潴留,切面腎實質變薄,腎盂腎盞擴張,皮髓質分界不清,腎乳頭缺血萎縮,并隨著時間的延長而加重,以UUO組病變更為明顯。
2.2.2 光鏡下病理改變 ①HE切片假手術組各時間點腎組織無明顯改變。UUO組術后第3天腎小管輕度少量擴張,上皮細胞濁腫變性,腎間質輕度水腫,伴炎細胞局灶性浸潤;術后第7天,腎小管進一步擴張,以皮髓交界處尤為明顯,上皮細胞空泡變性,管腔內見細胞或蛋白,伴炎細胞彌漫性浸潤和部分小管間質輕度纖維化;術后第14天,皮髓質變薄,小管擴張明顯,甚至擴張呈囊性,部分管腔塌陷,上皮細胞空泡變性顯著,出現大量壞死,間質內巨噬細胞、淋巴細胞彌漫性浸潤和成纖維細胞增生及膠原形成,纖維化明顯,各時間點腎間質評分差異明顯,有統計學意義(P<0.05)。②Masson切片顯示假手術組綠染區域主要位于小管基底膜及其周圍,小管間質幾乎無染色。術后第3天,UUO組皮髓交界區出現輕度纖維化,并隨著梗阻時間的延長綠染面積擴大,表現為腎間質進行性增寬,膠原纖維增加,染色加深,各時間點綠染面積所占百分比比較,差異有統計學意義(P<0.05)。③假手術組α-SMA僅表達于血管平滑肌細胞,腎小球、腎小管及間質均未見表達。UUO組術后第3天可見腎間質內α-SMA少量表達;術后第7天腎小管上皮細胞出現陽性表達,皮髓交界處出現輕微纖維化;術后第14天表達達到高峰,皮質區和皮髓交界區明顯,各時間點α-SMA的累積光密度值(IOD)比較,差異具有統計學意義(P<0.05)。④干預組與假手術組相比,各時間點各項指標明顯增高;而較之UUO組,各時間點各項指標明顯改善,其腎損傷、間質纖維化程度及α-SMA陽性率明顯改善,差異有統計學意義(P<0.05)。見表1、圖1。
表1 各組大鼠不同時間點光鏡下病理改變(±s,n=5)
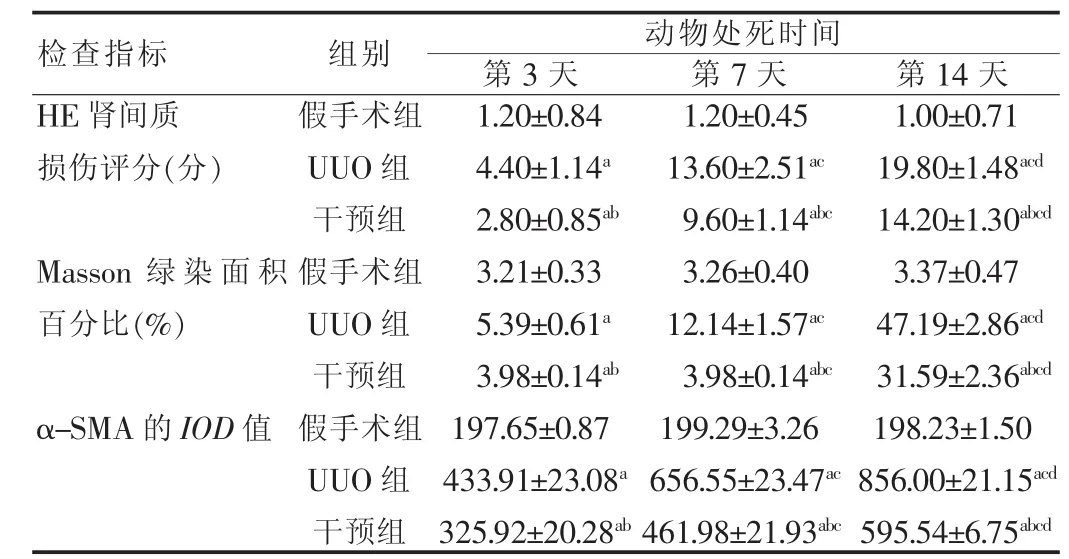
表1 各組大鼠不同時間點光鏡下病理改變(±s,n=5)
注:與假手術組比較,aP<0.05;與 UUO 組比較,bP<0.05;與第 3 天比較,cP<0.05;與第 7 天比較,dP<0.05
動物處死時間第3天 第7天 第14天HE腎間質損傷評分(分)Masson綠染面積百分比(%)α-SMA的IOD值檢查指標 組別假手術組UUO組干預組假手術組UUO組干預組假手術組UUO組干預組1.20±0.84 4.40±1.14a 2.80±0.85ab 3.21±0.33 5.39±0.61a 3.98±0.14ab 197.65±0.87 433.91±23.08a 325.92±20.28ab 1.20±0.45 13.60±2.51ac 9.60±1.14abc 3.26±0.40 12.14±1.57ac 3.98±0.14abc 199.29±3.26 656.55±23.47ac 461.98±21.93abc 1.00±0.71 19.80±1.48acd 14.20±1.30abcd 3.37±0.47 47.19±2.86acd 31.59±2.36abcd 198.23±1.50 856.00±21.15acd 595.54±6.75abcd
2.3 各組腎功能比較結果

圖1 各組大鼠第14天腎臟HE、Masson、a-SMA染色比較(×200)
與假手術組相比,術后第3、7和14天UUO組與干預組肌酐、尿素氮及24 h尿蛋白含量均明顯高于假手術組,差異有統計學意義(均P<0.05),其中第3、7天各指標呈現上升趨勢,第14天時表現為下降;與UUO組相比,干預組各時間點各項指標明顯改善,差異均有統計學意義(均P<0.05);而假手術組術后各時間點各項指標差異不明顯,差異無統計學意義(P>0.05)。 見表 2。
表2 各組大鼠不同時間點腎功能變化(±s,n=5)
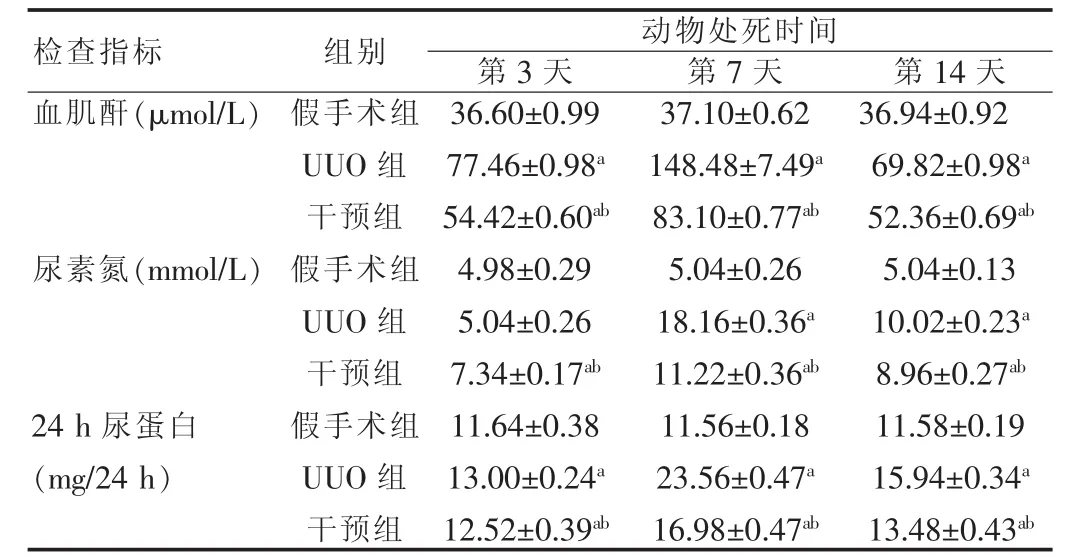
表2 各組大鼠不同時間點腎功能變化(±s,n=5)
注:與假手術組比較,aP<0.05;與 UUO 組比較,bP<0.05
動物處死時間第3天 第7天 第14天血肌酐(μmol/L)尿素氮(mmol/L)24 h尿蛋白(mg/24 h)檢查指標 組別假手術組UUO組干預組假手術組UUO組干預組假手術組UUO組干預組36.60±0.99 77.46±0.98a 54.42±0.60ab 4.98±0.29 5.04±0.26 7.34±0.17ab 11.64±0.38 13.00±0.24a 12.52±0.39ab 37.10±0.62 148.48±7.49a 83.10±0.77ab 5.04±0.26 18.16±0.36a 11.22±0.36ab 11.56±0.18 23.56±0.47a 16.98±0.47ab 36.94±0.92 69.82±0.98a 52.36±0.69ab 5.04±0.13 10.02±0.23a 8.96±0.27ab 11.58±0.19 15.94±0.34a 13.48±0.43ab
3 討論
RIF發生機制錯綜復雜,可概括為細胞外基質增多、腎小管上皮細胞轉分化 (epithelial tmesenchymal transition,EMT)和多種細胞因子及血管活性物質的激活與相互作用。近年研究表明,MFB的激活是RIF形成的關鍵[11],而其中1/3的MFB由EMT而來[12],這種EMT的細胞過度增殖,可分泌多種細胞因子致使細胞外基質合成與降解失衡,最終導致RIF的發生。RIF的病理過程是由病變初期的炎癥細胞浸潤,繼而EMT發生和腎間質成纖維細胞活化增殖,共同產生大量細胞外基質并發生沉積,最后腎小管萎縮消失,小管間質纖維化[4]。正常成熟的腎小管上皮細胞表達角蛋白,腎間質細胞表達波形蛋白,均無α-SMA的表達;而MFB是成纖維細胞的活化形式,胞漿內含肌動蛋白,可表達α-SMA。MFB廣泛存在于纖維化腎組織中,因此α-SMA作為MFB的重要標志,可指示RIF的病理進程[13]。而RIF又與腎功能關系密切,可作為準確預測腎功能惡化程度的指標[3]。UUO模型是目前研究RIF最常用的較成熟模型,具有無高血壓、蛋白尿、血脂異常及毒性損害等特點,適合RIF病理機制和防治的研究[5]。1,25-(OH)2D3主要通過與其受體結合發揮其多樣生物學作用,如參與維持鈣磷平衡;與其他轉錄因子相互作用,影響基因轉錄;與其他激素、生長因子及細胞因子等相互作用,參與聯系多個信號傳導途徑,從而發揮復雜而精細的調節作用。有研究表明,腎功能降低與血清中1,25-(OH)2D3的減少呈正比關系[14]。這就說明1,25-(OH)2D3可通過某些途徑對腎功能起保護作用,減緩腎臟的病理改變。
本實驗結果顯示,隨著時間延長,UUO組腎間質損傷和纖維化程度逐漸加重,α-SMA標記陽性的MFB逐漸增多;至術后第14天,腎間質纖維化明顯,α-SMA表達達到高峰。而肌酐、尿素氮和24 h尿蛋白水平于術后第3、7天與梗阻側腎臟損傷相平行,各項指標明顯升高;至第14天,各項指標明顯改善,這可能與實驗所取血液為全身血液,而此時健側腎臟發揮了全面代償作用有關。干預組與UUO組各時間點相比,干預組各項指標改善明顯。另有體外實驗證明,1,25-(OH)2D3能抑制轉化生長因子-β1(tranforming growth factor-β1,TGF-β1)誘發的 α-SMA 表達,并呈劑量依從關系[15]。TGF-β1是目前已知最強烈的促纖維化因子,可誘導EMT和成纖維細胞活化;而1,25-(OH)2D3的體內信號傳導途徑與TGF-β1存在有廣泛交互的作用[16]。 1,25-(OH)2D3在 RIF 中發揮保護作用的可能機制是通過拮抗TGF-β1誘導的EMT和減少蛋白尿而實現的。
RIF是一個多因子參與、多路徑調控的復雜病理過程,其機制還有待進一步的研究。本研究對1,25-(OH)2D3在RIF中所起的干預作用作了初步探討,為進一步研究RIF發病機制及尋找治療方法提供了一定證據和思路。
[1]Rohle A,Muller GA,Wehrmann M,et al.Pathogenesis of chronic renal failure in the primary glomemlopathies,renal vasculopathies,and chronic interstitial[J].Kidney Int,1996,49(Suppl 54):S2-S9.
[2]Gilbert RE,Cooper ME.The tubulointerstitium in progressive diabetic kidney disease:more than all aftermath of glomerular injury [J].Kidney Int,1999,56(5):1627-1637.
[3]Phillips AO,Steadman R.Diabetic nephropathy:the central role of renal proximal tubular cells in tubulointerstitial injury [J].Histol Histopath,2002,17(1):247-252.
[4]Eddy AA.Molecular basis of renal fibrosis[J].Pediatr Nephrol,2000,15(34):290-301.
[5]Kawada N,Moyama T,Ando A,et al.Increased oxidative stress in mouse kidneys with unilateral ureteral obstruction[J].Kidney Int,1999,56(3):l004-1013.
[6]Dusso AS,Brown AJ,Slatopolsky E.Vitamin D[J].Am J Physiol Renal Physiol,2005,289(7):8-28.
[7]Lanting L,May N,Anthony ML,et al.Vitamin D receptor gene expreession in mammalian kidney[J].J Am Soc Nephrol,1994,5(5):1251-1258.
[8]Yang J,Liu Y.Blockage of tubular epithelial to myofibroblast transition by hepatocyte growth factor prevents renal interstitial fibrosis[J].J Am Soc Nephrol,2002,13(1):96-107.
[9]Schwarz U,Amann K,Orth SR,et al.Effect of 1,25-(OH)2D3on glomerulosclerosisinsubtotallynephreatomizedrats[J].KidneyInt,1998,53(6):1696-1705.
[10]Radford MG,Donadio JV,Bergatralh EJ,et al.Predicting renal outcome in IgA nephmpathy[J].J Am Soc Nephrol,1997,8(2):199-207.
[11]Liu Y.Epithelial to mesenchymal transition in ranal fibrogenesis:pathologic significance,molecular mechanism and therapeutic intervention[J].J Am Soc Nephrol,2004,15(1):1-12.
[12]Iwano M,Plieth D,Danoff TM,et al.Evidence that fibroblasts derve from epithelium during tissue fibrosis[J].Clin Invest,2002,110(3):341-350.
[13]Kuhlmann A,Haas CS,Gross ML,et al.1,25-dihydroxyvitamin D3decreases podocyte loss and podocyte hypertrophy in the subtotally nephrectomized rat[J].Am Phyandsiol,2004,286(3):F526-F533.
[14]Ishimura E,Nishizawa Y,lnaba M,et al.Serum levels of 1,25-dihydroxyvitamin D,24,25-dihydroxyvitamin D and 25-hydroxyvitamin D in nondlalyzed patients with chronic renal failure[J].Kidney Int,1999,55(3):1019-1027.
[15]Li YC,Kong J,Wei M,et al.1,25-dihydroxyvitamin D3is a negative endocrine regulator of the rennin-angiotensin system[J].J Clin Invest,2002,110(2):229-238.
[16]Nanthakumar S,Gary ML,TerrieA C,et al.Cross-talk between 1,25-dihydroxyvitamin D3and transforminggrowth factor-βsignaling requires binding of VDR and smad 3 proteins to their cognate DNA recognition elements[J].J Biol Chem,2001,276(19):15741-15746.

