委陵菜黃酮衍生物促進L6細胞GLUT4的轉位活性
劉 佳,秦 楠,牛文彥,段宏泉
(1.天津醫科大學藥學院,基礎醫學研究中心,天津300070;2.天津醫科大學免疫學教研室,天津300070)
目前世界上糖尿病患病人數已高達2億5千萬人,每年新發病6百萬人,其中90%以上是2型糖尿病(T2DM)。2型糖尿病是由于胰島素分泌減少,胰島素作用缺陷以及靶組織(主要是肌肉和肝臟)的胰島素抵抗引起的。骨骼肌攝取葡萄糖主要由跨膜蛋白葡萄糖轉運子4(glucosetransporter4-GLUT4)完成,骨骼肌細胞膜上的GLUT4的數量決定葡萄糖攝取量[1-2]。本課題組通過對抗糖尿病活性成分委陵菜黃酮進行結構修飾得到了一系列黃酮類衍生物,報道了該類黃酮衍生物能夠顯著提高胰島素抵抗HepG2細胞的葡萄糖消耗量[3-4]。本文旨在評價黃酮衍生物對不同的糖尿病相關靶組織的作用,選擇了大鼠骨骼肌細胞(L6)并通過類ELISA法測定L6細胞膜上GLUT4的量,以評價黃酮衍生物對骨骼肌葡萄糖利用的影響。
1 材料與方法
1.1 材料
1.1.1 試劑 L6GLUT4myc細胞株由加拿大Amira Klip教授惠贈;α-MEM(天潤善達公司);胰酶(天潤善達公司),D-Hanks液配制;Hanks液(天潤善達公司);胎牛血清(以色列STERILE);抗myc單克隆抗體(9E10,Sigma公司);偶聯HRP的山羊抗兔抗體(Jackson Immuno Research);胰島素(Sigma公司)。
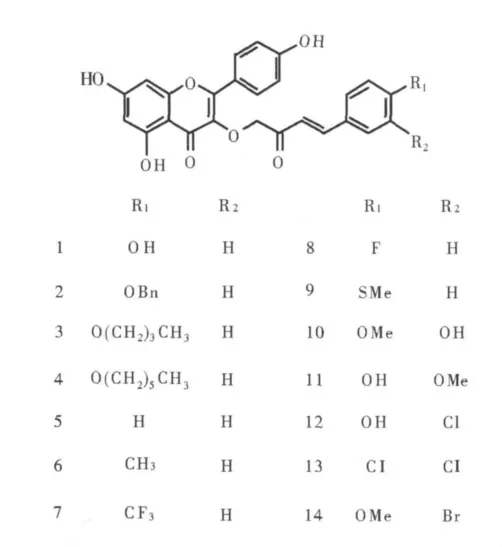
1.1.2 黃酮衍生物1~14的化學結構 圖示化合物均用DMSO溶解成濃度為10mg/mL的貯存液,實驗前用含10%胎牛血清的α-MEM培養基分別稀釋,配制成濃度分別為10μg/mL和5μg/mL的樣品溶液。
1.2 方法
1.2.1 細胞培養 用含10%胎牛血清的α-MEM培養基,在37℃,含5%CO2條件下培養細胞,待接種于培養板中的細胞密度達100%時,再用含1%胎牛血清的培養基分化為成肌細胞,每兩天換1次分化液,于接種后第8天用于實驗。
1.2.2 類ELISA法測定細胞膜上L6GLUT4myc 在分化后的L6 GLUT4myc培養板中加入黃酮衍生物稀釋液每孔1mL(留空白孔、背景孔和胰島素孔),24 h后無血清培養3 h[5],加入100 nmol/L的胰島素,20min后將培養板置于冰上;用預冷的含1mmol/L Ca2+和1mmol/LMg2+的PBS(+)溶液洗 3次,用 5%(v/v)山羊血清封閉肌管,10min后用抗myc單克隆抗體(1∶500稀釋)搖床上冰浴孵育 1 h;PBS(+)洗6次,用含4%的多聚甲醛冰上固定肌管10min,室溫固定20min,再用0.1mol/L的甘氨酸冰上淬滅10min,用偶聯過氧化物酶HRP的山羊抗兔IgG(1∶1 000稀釋)室溫孵育 40min;PBS(+)沖洗 6次,加入底物鄰苯二胺溶液,20 min后用0.20 mL的3 mol/L HCl溶液終止,490 nm測定上清液吸光度值。計算公式如下:
1.3 統計學方法 采用SPSS13.0統計軟件包,對所得數據采用表示,兩兩比較采用students t檢驗,P<0.05具有統計學意義。
2 結果
2.1 黃酮衍生物1~14對L6 GLUT4myc轉位的影響 本研究應用抗myc的抗體可在保持細胞膜完整的狀態下測定轉位到細胞膜上的GLUT4量。結果如圖1所示,相對于對照組,胰島素刺激組中GLUT4的量明顯上升為對照組的(2.71±0.06)倍(P<0.05),各黃酮衍生物組 1、5、6、8~11在濃度為 10μg/mL時,GLUT4的量分別為對照組的(3.60±0.30)倍、(3.66±0.26)倍、(2.87±0.49)倍、(3.97±0.37)倍、(2.82±0.45)倍、(3.37±0.67)倍、(4.43±0.61)倍(P值均小于0.05),對L6 GLUT4myc細胞GLUT4轉位顯示了明顯地促進作用。

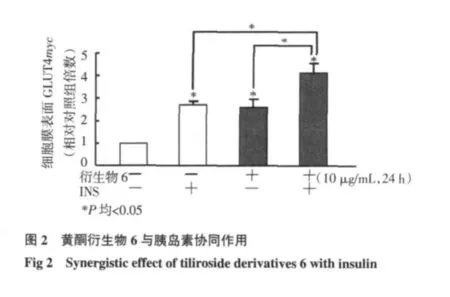
2.2 與胰島素疊加作用結果 黃酮衍生物6與胰島素疊加作用結果如圖2所示,相對于對照組,胰島素組、衍生物6組、衍生物6+胰島素組的GLUT4量明顯上升,GLUT4量分別為對照組的(2.71± 0.06)倍、(2.67±0.19)倍、(4.31±0.22)倍(P 值均小于0.05)。結果表明衍生物6不僅促進L6細胞GLUT4的轉位,并且與胰島素具有協同作用。
3 討論
帶有myc表位標記的L6GLUT4myc細胞的GLUT4myc表達量遠遠超過內源性的GLUT4,無論是基礎狀態下還是胰島素刺激狀態下的葡萄糖吸收都是由GLUT4myc轉運的[6]。因此,根據細胞膜上GLUT4myc數量變化可以推測細胞攝取葡萄糖量的變化。本文實驗結果表明,委陵菜黃酮衍生物1、5、6、8~11在 10μg/mL作 用 濃 度 下 顯 著 增加L6GLUT4myc大鼠骨骼肌細胞膜表面GLUT4myc的水平,即刺激GLUT4myc的轉位。與胰島素疊加作用實驗結果表明,黃酮衍生物6與胰島素具有協同作用。
雖然文獻報道了大量黃酮類化合物的抗糖尿病活性,包括在脂肪細胞(3T3-L1)[7]和肝細胞(HepG2)以及糖尿病模型動物中的抗糖尿病作用[8-9],但在骨骼肌細胞(C2C12)中的研究僅有1篇報道了橘皮素在100μmol濃度下促進GLUT4的轉位作用[10]。本文首次報道了黃酮衍生物在20~30μmol濃度下顯著促進骨骼肌細胞L6GLUT4的轉位,并與胰島素存在協同作用,有進一步深入研究的價值。
[1]Klip A.Themany ways to regulate glucose transporter 4[J].Appl PhysiolNutrMetab,2009,34(3):481
[2]Jessen N,Goodear L J.Contraction signaling to glucose transport in skeletalmuscle[J].JApplPhysiol,2005,99(1):330
[3]Zhu Y,Zhang Y,Liu Y,et al.Synthesis and biological activity of trans-tilioside derivatives as potent anti-diabetic agents[J].Molecules,2010,15(12):9174
[4]Qin N,Li C B,Jin M N,et al.Synthesis and biological activity of novel tilirosidederivants[J].Eur JMed Chem,2011,46(10):5189
[5]Kundu JK,Surh Y J.Inflammation:Gearing the journey to cancer[J].MutatRes,2008,659(1/2):15
[6]NiuW,Bilan PJ,Ishikura S,etal.Contraction-related stimuliregulateGLUT4 traffic in C2C12-GLUT4myc skeletalmuscle cells[J].Am JPhysiolEndocrinolMetab,2010,298(5):E1058
[7]Thyagarajan-Sahu A,Lane B,Sliva D.ReishiMax,mushroom based dietary supplement,inhibits adipocyte differentiation,stimulates glucoseuptakeandactivatesAMPK[J].BMCComplementAlternMed,2011,11(9):74
[8]Li Y,Xu S,Mihaylova M M,etal.AMPK phosphorylates and inhibits SREBPactivity toattenuatehepatic steatosisand atherosclerosis in diet-induced insulin resistantmice[J].CellMetab,2011,13(4):376
[9]ZhangW Y,Lee JJ,Kim IS,etal.7-O-methylaromadendrin stimulates glucose uptake and improves insulin resistance in vitro[J].BiolPharm Bull,2010,33(9):1494
[10]Kim M S,Hur H J,Kwon D Y,etal.Tangeretin stimulates glucose uptake via regulation of AMPK signaling pathways in C2C12 myotubes and improves glucose tolerance in high-fat diet-induced obesemice[J].MolCellEndocrinol,2012,358(1):127

