萊茵衣藻FAB2的原核表達以及不同脅迫條件下的表達模式
郭雪潔, 路延篤, 張 蕾, 姜 鵬, 秦 松
(1. 中國科學院 海洋研究所, 山東 青島 266071; 2. 中國科學院 煙臺海岸帶研究所, 山東 煙臺 264003;3. 中國科學院 青島生物能源與過程研究所, 山東 青島 266101; 4. 中國科學院 研究生院, 北京 100049)
萊茵衣藻FAB2的原核表達以及不同脅迫條件下的表達模式
郭雪潔1,4, 路延篤2,3, 張 蕾2,4, 姜 鵬1, 秦 松1
(1. 中國科學院 海洋研究所, 山東 青島 266071; 2. 中國科學院 煙臺海岸帶研究所, 山東 煙臺 264003;3. 中國科學院 青島生物能源與過程研究所, 山東 青島 266101; 4. 中國科學院 研究生院, 北京 100049)
脂肪酸去飽和酶(fatty acid desaturase)是不飽和脂肪酸合成途徑的關鍵酶, 催化脂肪酸鏈的特定位置脫氫形成雙鍵, 其通過引入雙鍵調節脂肪酸不飽和度, 以適應周圍環境的變化。萊茵衣藻(Chlamydomonas reinhardtii)質體酰基-酰基載體蛋白去飽和酶(plastid acyl-ACP desaturase, FAB2)在Δ9位脫氫, 催化脂肪酸中第1個雙鍵的形成。本文首先在大腸桿菌中異源表達了FAB2, 另外將其氨基酸序列與其他高等植物、微藻、真菌等進行了多序列比對以及系統進化分析, 推測其與高等植物親緣關系更近。利用定量 RT-PCR技術研究了衣藻 FAB2基因不同脅迫條件下的表達模式, 結果表明4 ℃ +0%NaCl, 25 ℃ +1%NaCl 脅迫條件下FAB2基因表達量都有一定程度升高。
萊茵衣藻(Chlamydomonas reinhardtii); 酰基-酰基載體蛋白去飽和酶; 表達; 實時熒光定量PCR
不飽和脂肪酸在生物體的生命活動中占有重要地位, 動物、植物和微生物等的膜脂中都含有特定的不飽和脂肪酸, 它是機體生物膜的重要組成成分,對生物膜結構、機能、相轉變、通透性的調節及相關過程的調控有重要作用。并且, 它參與細胞生物化學反應、轉運過程和細胞應激反應, 影響脂肪代謝、尋靶作用、免疫反應、耐寒、抗氧化等生理過程。此外, 不飽和脂肪酸還是哺乳動物體內生成前列腺素、凝血啞烷和白三烯等激素的前體, 具有提高人體免疫力、預防心血管疾病和癌癥等重要的生理功能[1]。多不飽和脂肪酸具有極其重要的營養價值和藥用價值, 微藻是多不飽和脂肪酸的初級生產者, 但常溫下含量極低,通過分子生物學的方法改造微藻,有望提高多不飽和脂肪酸的含量。多不飽和脂肪酸(PUFA) 在微藻中的合成是以飽和脂肪酸如硬脂酸為底物, 通過一系列脫飽和酶(Desaturase, DS) 和延長酶(Elongase, EL) 的催化作用形成的, 脂肪酸去飽和酶是PUFA 合成途徑的關鍵酶[2]。
脂肪酸去飽和酶能夠在脂肪酸的烴鏈上引入雙鍵, 存在于幾乎所有生物中, 其在維持生物膜正確的結構和功能方面具有重要作用[3]。根據脂肪酸結合的載體不同可分為 3類: (1)酰基脂去飽和酶(acyl-lipid desaturase)只在糖脂結合態的脂肪酸中引入不飽和鍵, 是一類膜蛋白, 存在于植物葉綠體、真核微藻和原核藍藻。(2)酰基-酰基載體蛋白去飽和酶(acyl-ACP desaturase)只在酰基載體蛋白(ACP)結合態的脂肪酸中引入雙鍵, 主要存在于植物細胞質,以可溶的形式存在。 (3)酰基-輔酶 A 去飽和酶(acyl-CoA desaturase)在輔酶A 結合態的脂肪酸中引入不飽和鍵, 是一種膜蛋白, 存在于動物、真菌、酵母[4]。Δ9去飽和酶(簡稱Δ9DES或Δ9D)催化脂肪酸中第一個雙鍵的形成, 是不飽和脂肪酸生物合成的關鍵調節酶, 都以鐵為輔因子, 在藍藻中又稱為DesC。其功能是催化 16∶0-ACP 和 18∶0-ACP 轉化為 16∶1(Δ9)-ACP 和 18∶1(Δ9)-ACP[5]。有人已分別從 Synechocystis sp.、Synechocystis PCC 6803、Spirulina platensis 這 3種藍藻中克隆到基因序列,都屬于酰基脂去飽和酶。另外, Nishizaki等[6]也從A.nidulans 中克隆了Δ9去飽和酶基因desC。它可以與多種膜脂的C16 和C18碳脂肪酸作用,形成Δ9位雙鍵。將desC基因轉入煙草植株,轉基因植株膜脂中單不飽和脂肪酸含量隆低。植株暴露于1℃達7 d 或者種子在10℃萌發并生長70 d 都沒有任何受傷癥狀。這說明煙草的抗寒性能在表達了Δ9去飽和酶后大為提高。衣藻CC503 FAB2是一種質體酰基-酰基載體蛋白脂肪酸去飽和酶, 理論上可以將 18∶0-ACP轉化為18∶1(Δ9)-ACP, 在多不飽和脂肪酸的生物合成途徑中引入第一個雙鍵, 是多不飽和脂肪酸生物合成的關鍵調節酶。
在高等植物或藻類中都存在一些應對逆境的途徑, 其中就包括脂肪酸介導的抵御外界脅迫的途徑[7-14]。在微藻的光合膜中, 脂肪酸的不飽和水平決定著膜脂的相轉變溫度, 即不飽和程度越高, 膜的相轉變溫度越低[15]。外界環境因素(如溫度、鹽度、光照等)正是通過某些分子機理來調節脂肪酸去飽和酶的表達和活性的, 通過調節去飽和酶的酶量和活性, 就能夠改變膜脂的不飽和度, 從而使細胞得以迅速改變脂肪酸的組成來適應環境的變化。很多研究結果表明外界環境中的溫度、光照、活性氧濃度、氧化還原電位、N/P比、鹽度等因素對微藻生長和脂肪酸的組成有顯著影響。脂肪酸去飽和酶及其基因克隆、轉基因技術的發展, 理論上為進一步研究溫度、鹽度等外界因素調節去飽和酶表達的模式, 明確微藻低溫適應等的分子機理奠定了基礎。
為了闡述衣藻 CC503FAB2是否在衣藻適應低溫、高鹽環境時發揮作用, 本文在測定相應脅迫條件下衣藻脂肪酸組成和含量變化的之后, 進一步運用Real-time PCR技術研究衣藻FAB2不同溫度、鹽度脅迫條件下的表達模式來幫助闡述這一過程。
1 材料和方法
1.1 材料
1.1.1 藻株和培養方法
萊茵衣藻(Chlamydomonas reinhardtii)CC503,購自美國 Chlamydomonas Genetic Center of Duke University。衣藻 CC503接種于 TAP (Tris-acetatephosphate)培養基[16],于 25℃光照條件下靜止培養,光照強度2 000 lx , 光/暗周期為12h/12h。
1.1.2 菌種與質粒載體
菌種: 大腸桿菌菌株 TOP10, Escherichia coli BL21 由本實驗室保存。
載體: T-A克隆載體pMD18-T載體購自TAKARA公司, 表達載體pET-28a(+)由本實驗室保存。
1.1.3 儀器設備與試劑
儀器設備: PCR儀(Tpersonal), 德國Biometra公司; 電泳儀(PAC300), 美國Bio-Rad公司; 凝膠成像分析系統(ImageMaster VDS) , 日本 FuJiFilm公司;常/低溫臺式離心機(Labofuge300/ Biofuge Stratos);ABI 7500 Fast Real-Time PCR 儀(ABI)。
試劑: T-A 克隆載體連接試劑盒, TaKaRa(大連)有限公司; 凝膠回收試劑盒, 上海飛捷(Fastagen)生物技術有限公司; Taq酶(TaKaRa公司); TRizol Reagent(Invitrogen公司); 反轉錄試劑盒PrimeScript?RT reagent Kit Perfect Real Time (TaKaRa);Real-time PCR 試劑盒 SYBR?Premix Ex TaqTMII(Perfect Real Time), TaKaRa; 10×DNaseI Buffer、RNase-inhibitor、DnaseI 均購自Fermentas公司。
1.2 方法
1.2.1 萊茵衣藻總 RNA 的提取、RT-PCR 法克隆FAB2cDNA片段
1.2.1.1 萊茵衣藻總RNA的提取
采用 Trizol法提取總 RNA, 具體操作如下: 取對數生長期的新鮮藻細胞, 4, 5℃ 000 r/min 離心8min,收集藻體, 液氮速凍后加入到液氮充分預冷的研缽中, 添加液氮充分迅速研磨材料成粉末。將材料轉移至DEPC處理過的1.5 mL離心管中, 加入1 mL Trizol, 室溫靜置3 min; 然后加入200 μL 氯仿, 蓋緊EP管, 劇烈振蕩15 s后, 室溫孵育3 min; 4, ℃12 000 r/min 離心15 min, 上清轉入新的離心管中,加入等體積的異丙醇, 顛倒混勻, 室溫靜置 15min;4, 12℃ 000 r/min 離心15 min, 棄上清, 用700 μL 75%乙醇洗沉淀一次, 4, 12℃ 000 r/min 離心5 min; 室溫下晾干后溶入適量的DEPC處理的水中(約20 μL),于-70 ℃儲存備用。
1.2.1.2 DNaseI處理消化基因組DNA
用 RNase-free DNaseI 消化總 RNA 樣品中的DNA, 按順序加入每一種試劑, 總反應體積為 20μL。依次加入: 總 RNA(3 μg/μL)16 μL, 10× DNaseI buffer 2 μL, RNase-free DNaseI(1 U/μL)1 μL, RNase Inhibitor(40 U/μL)1 μL,37℃下溫浴 20 min。加入終止buffer 2. 5μL, 80 ℃處理 2 min, 于-70 ℃儲存。
1.2.1.3 cDNA第一鏈的合成
cDNA第一鏈的合成采用反轉錄試劑盒。反應體系如下: 5×PrimeScriptTMBuffer 2 μL, PrimeScriptTMRT Enzyme Mix I 0.5 μL, Oligo dT Primer(50μmol/L)0.5μL, Random 6 mers(100 μmol/L)0.5 μL,Total RNA 6.5 μL, RNase Free dH2O補齊。輕甩混合上述體系, 并快速離心, 37 ℃溫育15 min, 85 ℃處理5 s,-20 ℃可保存3個月以上。
1.2.1.4 RT-PCR法克隆FAB2cDNA片段
根據NCBI上公布的萊茵衣藻CC503 FAB2 的cDNA序列, 設計特異性引物(引物由上海生工生物技術有限責任公司合成): 上游引物 fab2-F(5′-CAGGATCCCATATGGCTCTGGGCCAGCAGG-3′)和 下 游 引 物 fab2-R (5′-CCCAAGCTTTTACAGGGCCACCTCGCGG-3′), 分別包含 BamHI 和 HindIII酶切位點。以上一步合成的cDNA為模板PCR擴增FAB2cDNA 片段。25 μL PCR 體系中含 10×Buffer 2.5μL, dNTP mix 0.5 μL, cDNA 模板為 1 μL,上下游引物各 1 μL,ddH2O 18.7 μL, Taq 酶(5U/μL)0.3 μL。反應條件為: 94℃預變性5 min, 然后94 ℃ 30 s, 56 ℃30 s, 72 ℃ 1 min30s, 30個循環, 最后72 ℃延伸7 min。取40 μL PCR 擴增產物進行瓊脂糖凝膠電泳回收特異性擴增片段, 并克隆至 pMD18-T 載體中,挑取陽性克隆進行序列測定。基礎的分子生物學操作參考分子克隆實驗指南(第三版)[17]。
1.2.2 萊茵衣藻 FAB2基因原核表達載體構建及在大腸桿菌中的表達
將測序鑒定正確的 pMD18-T-fab2 質粒用BamHI 和 HindIII 雙酶切, 將目的基因亞克隆至pET-28a(+) 載體上。將重組的原核表達質粒轉化大腸桿菌BL21后, 挑取單個菌落接種5 mL LB培養基(Amp+)中, 37 ℃繼續振蕩培養3 h 后(A值大約為0.5左右), 加IPTG至終濃度為1 mmol/L, 37℃繼續振蕩培養。IPTG 誘導不同時間(1、2、3、4、5、6 h)收集菌體進行SDS-PAGE分析。
1.2.3 序列分析
1.2.3.1 氨基酸序列分析
利用 NCBI網站(http://www.ncbi.nlm.nih.gov)上的BLAST工具進行基因序列的相似性及同源性查找, 將目的基因氨基酸序列與其他真核藻類及高等植物的采用ClustalW[18]軟件進行多序列比對分析,進而進行基因同源性的比較。此外, 根據其氨基酸序列,運用在線工具進行序列分析。采用在線 HNN網站(http://npsa-pbil.ibcp.fr/cgibin/npsa_automat.pl?page =npsa_nn. html) 進行蛋白質二級結構分析, 采用在線Prot Param (http://www.expasy.ch/tools/protparam.html)網站進行蛋白質基本物理化學參數分析。
1.2.3.2 系統進化分析
獲取NCBI中同種類不同物種的FAB2基因采用ClustalW軟件進行多序列比對分析,然后利用MEGA 4.0[19]軟件進行系統發生和進化的分析。系統樹采用NJ法(Neighbour-Joining)方法構建。
1.2.4 萊茵衣藻FAB2不同脅迫條件下表達模式研究
1.2.4.1 不同培養條件下衣藻生長曲線的測定
接種對數生長期相同藻量的衣藻于100 mL新鮮TAP培養基中, 待生長至對數生長期(A750=0.4~0.5)時, 轉入各不同誘導條件(25℃ + 0%Na Cl,15℃ + 0%Na Cl, 4 ℃ + 0%Na Cl, 25 ℃ +0.5%NaCl, 25℃+1%NaCl)下分別進行培養, 而后測定一段時間內不同生長條件下衣藻的生長曲線。
1.2.4.2 不同脅迫條件下萊茵衣藻 FAB2實時熒光定量
接種對數生長期相同藻量的衣藻于 50mL新鮮TAP培養基中, 待生長至對數生長期(OD750=0.4~0.5)時, 分別轉入各不同誘導條件(25 ℃ + 0%NaCl,15℃ + 0%Na Cl, 4 ℃ + 0%Na Cl, 25 ℃ +0.5%NaC l, 25℃+1%NaCl)下誘導36 h后收集藻體(每個條件下5個平行)。液氮中速凍10min, 放入-80℃冰箱中保存。提取不同條件誘導下樣品的RNA并反轉錄成cDNA(具體方法參見1.2.1)。設計衣藻FAB2基因的上游引物RT-FAB2F: 5′-CTCAACACCCTGGACGGC-3′和下游引物 RT-FAB2R: 5′-GGTAGGGGTTGTTCTCGGTC-3′, 內參 actin 上游引物 RT-actinF: 5′- GCAGTAGGAGGCATAGGGTT-3′和下游引物 RT-actinR: 5′-TCATCATCCTCCGTCGTTAG-3′。采用 SYBR Green I 染料法在熒光定量 PCR儀上采用 ABI 7500 Fast Real-Time PCR System 標準程序進行擴增, 對上述不同誘導條件下FAB2基因表達量進行分析。20 μL的 PCR反應體系中含有: SYBR?Premix Ex TaqTMII(2×)10.0 μL, PCR Forward Primer(10μ)0.8 μL, PCR Reverse Primer(10μm)0.8 μL, ROX Reference Dye II(50×)0.4 μL, cDNA 模板 2.0 μL, dH2O(滅菌蒸餾水)6.0 μL, 總共為 20.0 μL。
采用兩步法 PCR擴增標準程序, 數據分析根據公式ΔCT = CT(Target)- CT(Actin),取每份樣品5個重復樣的平均CT值計算目的基因FAB2相對于內參基因actin的ΔCT值, 采用常用的2-Ct△△法[20]計算目的基因衣藻FAB2在不同脅迫條件下的相對表達量。
2 結果
2.1 目的片段的克隆及驗證
根據根據 NCBI上已公布的衣藻 CC503FAB2的cDNA序列, 設計特異性引物通過RT-PCR方法擴增出了與預期大小基本一致的DNA條帶, 大小約為1206bp。切膠回收該片段, 將其與pMD18-T載體連接。挑選陽性克隆, 菌液 PCR檢測, 提取質粒酶切檢測均為陽性。送交測序結果也與預期相符。
2.2 萊茵衣藻FAB2基因的原核表達
將測序鑒定正確的pMD18-T-fab2質粒用BamHI和HindIII 雙酶切, 將目的基因亞克隆至pET-28a(+)載體上。圖1顯示含重組質粒的單克隆細菌經IPTG誘導不同時間后的表達狀況, SDS-PAGE 電泳結果檢測到大約在分子量45 kD 處明顯有1條表達量很高的蛋白條帶。圖中箭頭指向a即表達的目的蛋白。
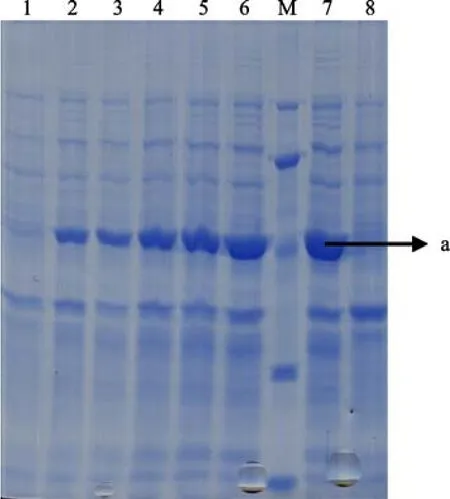
圖1 衣藻FAB2基因原核表達粗蛋白的SDS-PAGE分析Fig. 1 SDS-PAGE of crude protein extracts of FAB2 expressed in E.coli BL21 strainM. 蛋白質Marker(自上而下分別是: 116.0, 66.2, 45.0, 35.0, 25.0 kD); 1.未經 IPTG 誘導的 pET-28a-fab2 的表達;2、3、4、5、6、7分別為經 0.5 mmol/L IPTG 誘導 1、2、3、4、5、6h 的 pET-28a-fab2的表達; 8為空載體pET-28a(+)轉化BL21菌后的表達M: Protein molecular weight marker(from the top: 116.0, 66.2, 45.0,35.0, 25.0 kD); 1: Expression of pET-28a-fab2 not induced by IPTG;2、3、4、5、6、7: Expression of pET-28a-fab2 induced by 0.5 mmol/L IPTG for1、2、3、4、5、6 h; 8: Expression of pET-28a(+)
2.3 與其他真核藻類及高等植物的多序列比對分析
氨基酸多序列比對(圖 2)發現, 序列之間的同源性較高, 在連續多個位點出現多個氨基酸一致的情況。萊茵衣藻FAB2基因的氨基酸序列與團藻(Volvox carteri f. nagariensis)、雨生紅球藻(Haematococcus pluvialis)、木油桐(Vernicia montana)、擬南芥(Arabidopsis thaliana)基因的氨基酸序列同源性分別為83%、71%、59%、59%(圖2)。
2.4 蛋白質二級結構預測
采用在線 HNN 數據庫(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_hnn.html)對萊茵衣藻 FAB2氨基酸序列的二級結構進行預測分析。萊茵衣藻FAB2基因蛋白二級結構分析結果表明是由其大量分布在整個蛋白內的 α-螺旋結構、大量的無規則卷曲和少量擴展鏈結構組成, 含α-螺旋189個, 占47.13%; 擴展鏈31個, 占7.73%; 無規卷曲181個, 占45.14%;
2.5 編碼蛋白的生化特性分析
采用在線 Prot Param(http://www.expasy.ch/tools/protparam.html)網站進行蛋白質基本物理化學參數分析。
萊茵衣藻 FAB2基因編碼蛋白中各種氨基酸數量及比例顯示: 其中含有48個帶負電的氨基酸殘基(Asp + Glu), 占總數的11.9%; 46個帶正電的氨基酸殘基(Arg + Lys), 占總數的11.4%。經推算該蛋白的分子質量約為 44709.9 kD, 理論等電點為 6.65。在E. coi l中的半衰期大于10 h, 穩定系數為28.88, 屬于穩定的蛋白質類型。
2.6 系統發育分析
作者對比了來自不同物種的21個Δ9-acyl-ACP脂肪酸去飽和酶基因的氨基酸序列, 并利用MEGA4軟件對這些基因進行了分子系統學分析, 據此構建系統發育樹研究了衣藻 FAB2基因與其他物種基因之間的進化關系。從(圖 3)系統發育樹中可以看到,衣藻FAB2與幾種真核綠藻聚成一個分支, 介于細菌和高等植物之間, 但序列比對顯示衣藻的FAB2與高等植物的同源性更高, 揭示其在進化上可能與高等植物有更近的親緣關系。
2.7 不同培養條件下萊茵衣藻生長曲線
在光照強度等其他培養條件一致的情況下,25℃ + 0%Na Cl, 15℃ +0%NaCl, 4℃+0%NaCl, 25℃+0.5%NaCl, 25 ℃ + 1%NaCl五種不同培養條件下萊茵衣藻的生長曲線如圖4所示。
萊茵衣藻在不同培養條件下的平均生長速率不同, 由實驗所繪制的生長曲線可知,正常生長條件25℃ + 0%Na Cl下, 萊茵衣藻細胞生長速率最快。其他培養條件下衣藻的生長速率均有所減緩, 但又不至于脅迫細胞致死(在衣藻耐受范圍內)。因此設置以上溫度、鹽度梯度對萊茵衣藻進行誘導, 以25℃ + 0%Na Cl下培養的衣藻作為對照, 研究目的基因表達量的變化。

圖2 萊茵衣藻FAB2 與其他真核藻類及高等植物氨基酸序列比對結果Fig. 2 Amino acid sequences of FAB2 in comparison with the microsomal homologs from other plantsChlamydomonas reinhardtii(CrFAB2)、 Volvox carteri f. nagariensis(VcFAB2)、 Haematococcus pluvialis(HpSACP)、 Vernicia montana(VmSACP)、Arabidopsis thaliana(AtFAB2)
2.8 萊茵衣藻 FAB2不同脅迫條件下的表達特征
目標基因的相對表達量按 Livak和 Schmittgen的方法計算[20]。根據擴增曲線得到的CT 值(熒光信號達到設定的閾值時所經歷的循環數), 計算出目標基因FAB2和內參基因actin CT 值的差異△CT; 進而以差異最大的樣本作為參照樣本, 計算出不同樣品相對于參照樣本基因表達倍數2-△△CT, 從而制作出相對定量的圖表(圖5)。
由圖5中可以看出, 與正常生長條件25℃+0%NaCl相比, 目的基因 FAB2在 15 ℃ + 0%Na Cl、25 ℃ + 0.5%Na Cl條件下相對表達量沒有明顯變化,而在4 ℃ + 0%Na Cl、25 ℃ + 1%NaCl條件下表達量均有一定程度的升高, 但表達量的增加很小, 統計學分析顯示與對照組沒有顯著性差異。說明FAB2基因的表達確實受到溫度、鹽度的影響, 但可能不是在響應該刺激過程中起最關鍵作用的基因。
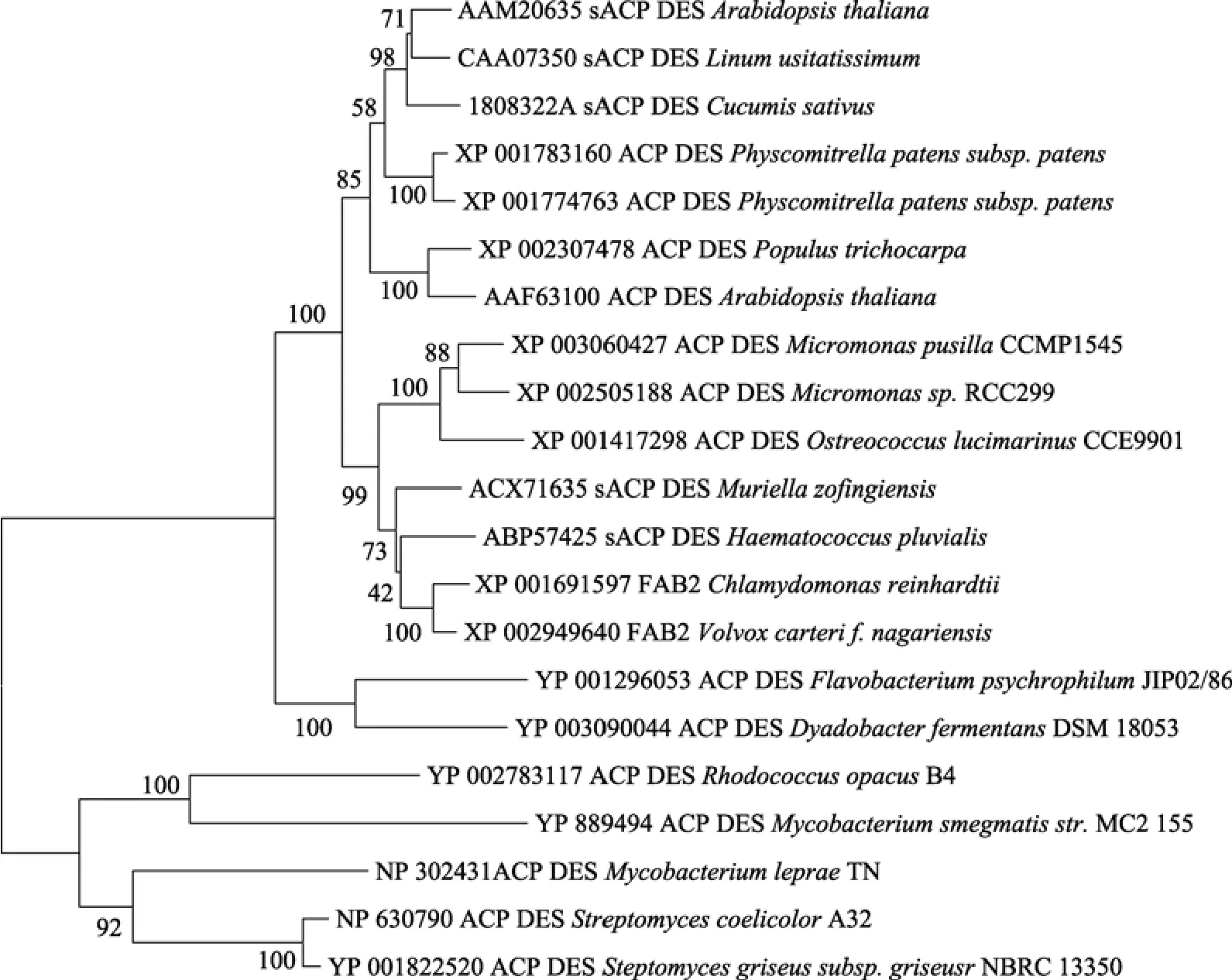
圖3 來自不同物種的Δ9-acyl-ACP 脂肪酸去飽和酶的系統進化樹分析Fig. 3 Phylogenetic tree based on the amino acid sequences of Δ9-acyl-ACP desaturase homologous genesof different species
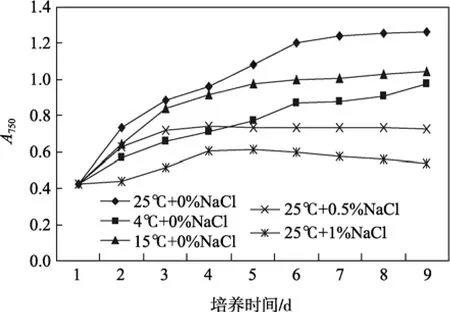
圖4 衣藻在不同培養條件下的生長曲線Fig. 4 The growth curve of C. reinhardrtii at different temperature and salinity stresses
3 討論
本文選取模式生物萊茵衣藻來研究酰基-酰基載體蛋白脂肪酸去飽和酶基因的相關特性及不同條件下表達特征。首先將克隆到的衣藻 FAB2的 cDNA序列的編碼區連接到原核表達載體上, 將該基因在大腸桿菌中進行了表達, 蛋白條帶大小與預測的相符。衣藻FAB2基因的原核表達為后續研究該基因編碼蛋白的活性(體內活性及體外活性)奠定了基礎。衣藻屬于綠藻, 在現存的所有單細胞真核藻類中, 綠藻是與陸生植物親緣關系最近的一支[21]。本文系統發育分析結果也表明, 衣藻的FAB2基因與高等植物的該基因同源性更高, 提示其與高等植物有更近的親緣關系。另外, 很多研究表明溫度、鹽度等外界條件會在一定程度上影響到脂肪酸去飽和酶的表達。為了探究不同脅迫誘導條件下衣藻 FAB2基因的轉錄譜, 本實驗選取不同溫度、鹽度梯度為誘導條件,使用實時熒光定量 PCR手段檢測發現: 與正常生長條件25 ℃+0%Na Cl相比, 目的基因在15℃ + 0%NaCl、25 ℃ + 0.5%NaCl條件下相對表達量沒有明顯變化, 而在 4 ℃ + 0%NaCl、25 ℃ + 1%Na Cl誘導條件下表達量均有一定程度的升高, 但升高程度也非特別顯著, 分析存在以下原因: 實驗中設置的該溫度、鹽度梯度尚不足以充分說明問題, 還應進一步降低溫度、提高鹽度(在衣藻生長可耐受范圍內)重復該研究; 亦或是因為在萊茵衣藻響應溫度、鹽度刺激時, 本文所研究的衣藻FAB2基因并非起關鍵作用的基因, 也可能存在其他關鍵脂肪酸去飽和酶基因或其他基因。本研究初步說明溫度、鹽度影響到了衣藻FAB2基因的表達, 即該基因在衣藻應答不同溫度、鹽度外界環境刺激時起了一定作用, 但可能不是響應該刺激的最關鍵基因。也說明了萊茵衣藻逆境適應過程的復雜性, 具體的作用機制有待深入研究。
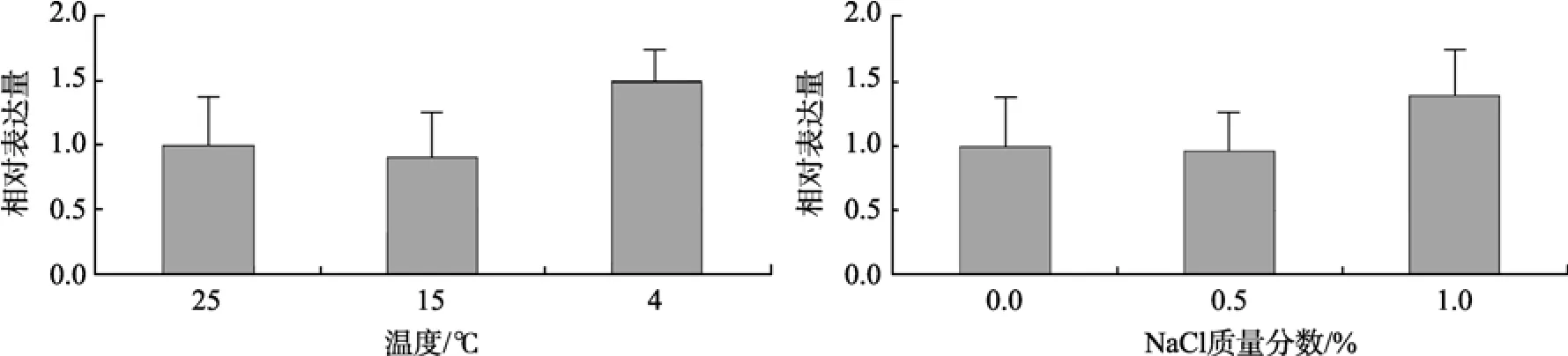
圖5 衣藻FAB2不同溫度、鹽度脅迫下(36 h)的相對表達量Fig. 5 Relative expression quantity of FAB2 from Chlamydomonas reinhardtii in responseto temperature and salinity changes
多不飽和脂肪酸(PUFA)是機體生物膜的重要組成成分, 對維系和調節細胞的正常生物學功能起著重要的作用, Δ9-desaturase又是多不飽和脂肪酸合成途徑中的第一個關鍵酶, 環境因素(如溫度、光照等)正是通過某些分子機理來實現對去飽和酶的表達及其活性調控,使細胞得以迅速改變脂肪酸的組成來適應環境的變化。本文對萊茵衣藻 FAB2基因不同溫度、鹽度下表達模式的研究, 理論上為明確微藻低溫適應、高鹽適應的分子機理奠定了基礎, 同時對進一步開展其他脂肪酸去飽和酶的研究提供了示例。
[1] 元冬娟, 江黎明. 海洋微藻脂肪酸去飽和酶[J]. 生命的化學, 2006, 26(5): 422-424.
[2] WICHIEN Y, WARD O P.ω-3 fatty acids: Alternative sources of production[J ]. Process Biochem, 1989, 8(3):117-125.
[3] Los D A, Murata N. Structure and expression of fatty acid desaturases[J]. Biochim Biophys Acta, 1998, 1394:3-15.
[4] Pereira S L. Recent advances in the study of fatty acid desaturases from animals and lower eukaryotes[J].Prostaglandins Leukot Essent Fatty Acids, 2003, 68(2):97-106.
[5] Los D A, Ray M K. Differences in the control of the temperature-dependent expression of four genes for desaturases inSynechocystissp. PCC 6803[J]. Mol Microbio, 1997, 25(6): 1167-1175.
[6] Nishizawa O I, Fujii T, Azuma M, et al. Low temperature resistance of higher plant s is significantly enhanced by a nonspecific cyanobacterial desaturase [J].Nature Biotechnology, 1996, 14: 1003-1006.
[7] Vijayan P, Shockey J, Levesque C A, et al. A role for jasmonate in pathogen defence of Arabidopsis[J]. Proc Natl Acad Sci USA, 1998, 95: 7209-7214.
[8] Kachroo P, Shanklin J, Shah J, et al. A fatty acid desaturase modulates the activation of defense signaling pathways in Plants[J]. Proc Natl Acad Sci USA, 2001,98: 9448-9453.
[9] Kachroo A, Lapchyk L, Fukushigae H, et al. Plastidial fatty acid signaling modulates plants epigenetically suppressed in phenylalanine ammonialyase expression do not develop systemic acquired resistance in response to infection by tobacco mosaic virus[J]. Plant Cell,2003b, 10: 281-293.
[10] Kachroo A, Venugopal S C, Lapchyk L,et al. Oleic acid levels regulated by glycerolipid metabolism modulate defense gene expression in Arabidopsis[J]. Proc Natl Acad Sci USA, 2004, 101: 5152-5157.
[11] Kachroo P, Venugopal S C, Navarre D A, et al.Role of salicylic acid and fatty acid desaturation pathways in ssi2-mediated signaling[J]. Plant Physiol, 2005, 139:1717-1735.
[12] Weber H. Fatty acid derived signals in plants[J]. Trends Plant Sci, 2002, 7: 217-224.
[13] Li C, Liu G, Xu C, et al. The tomato suppressor of prosystemin-mediated responses gene encodes a fatty acid desaturase required for the biosynthesis of jasmonic acid and the production of a systemic wound signal for defense gene expression[J]. Plant Cell, 2003, 15: 1646-1661.
[14] Yaeno T, Matsuda O, Iba K. Role of chloroplast trienoic fatty acids in plant disease defense responses[J]. Plant J,2004, 40: 931-941.
[15] Kis M, Zsiros O. Light-induced expression of fatty acid desaturase genes[J]. Proc Natl Acad Sci USA, 1998,95(8): 4209-4214.
[16] Harris E H. The Chlamydomonas Sourcebook: A Comprehensive Guide to Biology and Laboratory Use[M].San Diego, California: Academic Press, 1989.
[17] 薩姆布魯克, 拉塞爾. 分子克隆實驗指南[M]. 第 3版. 黃培堂譯. 北京: 科學出版社, 2002.
[18] Thomp son J D, Higgins D G, Gibson T J. CLUSTALW:Improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice [J].Nucleic Acids Res, 1994, 22: 4673-4680.
[19] Tamura K, Dudley J, Nei M, et al. MEGA4 : Molecular evolutionary genetics analysis (MEGA) software version 4.0[J]. Molecular Biology and Evolution, 2007, 24:1596-1599.
[20] Livak K J, Schmittgen T D. Analysis of relative gene expression data sing real-time quantitative PCR and the 2(-Delta Delta C (T)) method[J]. Methods, 2001, 25(4):402-408.
[21] Qiu Y L, Palmer J D. Phylogeny of early land plants:insights from genes and genomes[J]. Trends Plant Sci,1999, 4: 26-30.
Heterologous expression of acyl-ACP desaturase (FAB2) from Chlamydomonas reinhardi in Escherichia coli and its expression features in response to different temperature and salinity stresses
GUO Xue-jie1,4, LU Yan-du2,3, ZHANG Lei2,4, JIANG Peng1, QIN Song1
(1. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2.Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, China; 3. Qingdao Institute of BioEnergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, China; 4.Graduate School of the Chinese Academy of Sciences, Beijing 100049, China)
Nov.,5,2011
Chlamydomonas reinhardtii ; acyl-ACP desaturase; expression; quantitative real-time PCR
Fatty acid desaturases are enzymes that introduce double bonds into the hydrocarbon chains of fatty acids. The expression of genes for desaturase is very important since it provides the molecular basis for the acclimation of organisms to changing environment. The plastid acyl-ACP desaturase(FAB2) from Chlamydomonas reinhardi is a kind of Δ9 desaturase, which catalyses the formation of a double bond between the ninth and tenth carbon in the fatty acid chain. In this paper, acyl-ACP desaturase (FAB2) From C. reinhardi was heterologous expressed in Escherichia coli. Homologous annlysis indicated that amino sequence of FAB2 is quite similar to those homologies from plants. The expression levels of FAB2 from C. reinhardi cells which under different temperature and salinity stresses were relatively analysised by using fluorescent quantitative real-time PCR technology. Results showed that the expression quantity of FAB2 during 4℃+0%NaCl, 25℃+1%NaCl were much higer than that of normal situations.
Q943.2
A
1000-3096(2012)05-0034-08
2011-11-05;
2012-03-22
國家 863計劃資助項目(2009AA10Z106); 中國科學院知識創新方向項目(KZCX2-YW-209); 國家自然科學基金項目(40876082)
郭雪潔(1986-), 女, 山東聊城人, 碩士, 主要從事藻類功能基因研究, 電話: 0532-82898863, E-mail: xuejie.ll@163.com; 秦松,通信作者, 研究員, E-mail: sqin@yic.ac.cn
(本文編輯:梁德海)

