低聚殼聚糖的美拉德反應及其衍生物的抗氧化性能研究
孫 濤, 朱 云, 王燕萍, 謝 晶, 薛 斌
(1.上海海洋大學 食品學院, 上海 201306; 2. 上海水產品加工及貯藏工程技術研究中心, 上海 201306)
低聚殼聚糖的美拉德反應及其衍生物的抗氧化性能研究
孫 濤1,2, 朱 云1, 王燕萍1, 謝 晶1, 薛 斌1
(1.上海海洋大學 食品學院, 上海 201306; 2. 上海水產品加工及貯藏工程技術研究中心, 上海 201306)
醇沉法制得低聚殼聚糖美拉德反應 8、16 h以及 24 h的衍生物, 分別記為 CC-8、CC-16以及CC-24。對 3種衍生物進行紅外表征和分子量測定, 并研究其對超氧陽離子O-2˙、DPPH的清除能力以及還原能力。結果顯示: 反應體系pH呈下降趨勢; UV-Vis光譜在280 nm波長處吸收峰有明顯增強, 反應16 h后增長緩慢; 在343 nm的激發波長和420 nm發射波長下的熒光強度明顯增高, 反應16 h后開始下降; 3種衍生物均保留著低聚殼聚糖的特征吸收峰; 其對O-2˙、.DPPH的清除能力以及還原能力均得到顯著提高, 且CC-16抗氧化能力最好。
低聚殼聚糖; 美拉德反應; 抗氧化性能
殼聚糖是一種廣泛存在于甲殼類動物、昆蟲的硬殼以及菌類的細胞壁中的堿性高分子多糖, 且低聚殼聚糖的抗氧化性優于高聚殼聚糖[1]。低聚殼聚糖具有的降低膽固醇、降血脂、抗腫瘤、抗菌、提高機體免疫功能、調節腸道菌群以及促進藥物吸收等生理活性, 在食品行業作為抗菌劑、保鮮劑以及抗氧化劑被廣泛關注[2]。低聚殼聚糖自身含有游離氨基和羰基易發生美拉德反應。
本實驗以美拉德反應為低聚殼聚糖的改性手段,制備低聚殼聚糖衍生物, 檢測了反應過程中 pH、吸光度以及熒光值等外在特征的變化, 并且考察了其對、DPPH 的清除能力以及還原能力, 旨在研究抗氧化能力與美拉德反應外在特征之間的聯系, 以期為拓寬低聚殼聚糖的改性和開發天然高效的抗氧化劑提供了新思路。
1 材料與方法
1.1 原料與試劑
低聚殼聚糖(純度>90%, 脫乙酰度>70%, 凝膠色譜測定其分子質量為 9370 Da), 購自浙江金殼生物化學有限公司; 魯米諾, DPPH, 購自 Sigma公司;其余試劑均為分析純, 購自上海化學試劑公司; 抗氧化測試所需溶液由二次蒸餾水配制。
1.2 主要設備和儀器
WFZ UV2000型紫外分光光度計(上海合利儀器有限公司); 970CRT熒光分光光度計(南京昕航科學儀器有限公司); EQUNOX55 傅立葉紅外-拉曼光譜儀(德國布魯克公司); Waters 2410型凝膠色譜儀(美國Waters公司); IFFM 2D型流動注射化學發光分析儀(西安瑞邁科技有限公司)。
1.3 低聚殼聚糖的美拉德反應
稱取殼聚糖10.0 g, 用100 mL的二次蒸餾水溶解, 在 80℃下回流反應, 檢測反應過程中 pH、吸光度以及熒光值的變化, 經反復醇沉, 制得殼聚糖反應8、16及24 h的衍生物, 分別記為: CC-8、CC-16以及CC-24。
1.4 測試表征
紅外光譜在 EQUNOX55傅立葉紅外-拉曼光譜儀上進行, 采用 KBr壓片法制樣, 測定波數范圍為500~4000 cm–1, 分辨率為 0.8 cm–1。
產物的相對平均分子質量及其分布采用GPC法測定。GPC測試條件如下: 流動相: 0.1 mol/L 醋酸鈉水溶液; 監測器: Waters 2410 示差折光監測器;柱子: TOSOH BIOSEP G4000SWXL; 溫度: 40 ℃;標準物質為: 葡聚糖。
1.5 抗氧化性能測定
用pH為10.20的0.05 mol/L Na2CO3-NaHCO3緩沖溶液配制濃度為 1.5×10–3mol/L的魯米諾溶液,用1×10–3mol/L的鹽酸配制濃度為0.1 mol/L的鄰苯三酚儲備液, 使用前用去離子水稀釋至 1×10–4mol/L。以緩沖液作為溶劑, 配制不同濃度的樣品溶液。用流動注射化學發光分析儀依次測定從稀到濃的樣品溶液, 讀出峰面積[3]。清除率=(A0–Ai)/A0×100%。其中A0為空白溶液峰面積;Ai為樣品溶液峰面積。經SOD, 過氧化氫酶及甘露醇檢測, 該體系產生的自由基為超氧陰離子。
1.5.2 對DPPH自由基的清除
在比色管中加入2.0 mL的濃度為1×10–4mol/L DPPH無水乙醇溶液, 再加入不同濃度的樣品溶液2.0 mL, 室溫下避光靜置30 min, 在517 nm處測量吸光度Ai。用去離子水代替樣品溶液, 得吸光度A0,無水乙醇代替 DPPH, 得吸光度Aj。清除率=[1-(Ai-Aj)/A0]×100%[4]。
1.5.3 還原能力的測定
pH為6.60的0.2 mol/L磷酸緩沖液和1%鐵氰化鉀溶液各2.5 mL, 加入到2.0 mL不同濃度的樣品溶液中, 混勻, 50℃水浴20 min后迅速冷卻, 加入2.5 mL 10%三氯乙酸溶液, 混勻后在3 000 r/min下離心10 min, 取上清液2.0 mL, 加入2.5 mL去離子水和0.5 mL0.1%的三氯化鐵溶液, 靜置10 min后在700 nm處測定其吸光度[5]。
2 結果與分析
2.1 pH值的變化
美拉德反應中一般形成一些有機酸, 如甲酸和乙酸[6-7], 引起體系pH下降。圖1為低聚殼聚糖美拉德反應過程中體系pH的變化圖。反應體系pH值呈下降趨勢, 其中反應8~16 h之間下降較快, 反應體系pH由4.8下降到3.5; 反應16 h后pH緩慢下降。
2.2 吸光度的變化
圖 2描述了低聚殼聚糖自身美拉德反應過程中的紫外-可見吸收光譜在280 nm和420 nm處的吸光度。高聚殼聚糖在280 nm沒有吸光度[8], 而低聚殼聚糖含有相當多的還原活性基因。在制備低聚殼聚糖的反應中就開始發生并形成有色化合物, 因此最初的低聚殼聚糖也存在280 nm處的吸收[2]。如圖所示, 在280 nm處吸收峰有明顯增強, 表明美拉德反應過程中生成中間產物[9], 且反應前16 h增幅較大,其后增加緩慢。在420 nm處吸收峰隨著反應時間的延長緩慢增強, 表明美拉德反應產物增多[10-11]。

圖1 低聚殼聚糖美拉德反應過程中pH的變化Fig. 1 The pH change of Maillard reaction

圖2 UV-Vis在280 nm和420 nm處的吸光度Fig. 2 The UV-Vis absorbance at 280 nm and 420 nm
在酸性條件下, 美拉德反應易發生糖的異構和脫水, 產生糠醛類物質[12]。羥甲基糠醛是在酸性條件下美拉德反應的標示物, 在280 nm左右存在特征吸收峰[13]。紫外-可見吸收在280 nm和420 nm附近的吸收, 分別代表美拉德中間產物羥甲基糠醛及褐變物質的量[14], 如圖 2所示, 美拉德反應過程中褐變物質在不斷積累。
2.3 熒光值的變化
圖3描述的是在343 nm激發波長和420 nm發射波長下體系的熒光強度。如圖所示, 反應16 h的熒光值達到最大值, 16 h后開始下降, 這表明具有熒光性質的美拉德產物的產生、積累以及降解。熒光物質被視為美拉德反應的指示劑, 因為它們靈敏地反映了美拉德反應的早期過程, 反應后期熒光物質將參與類黑素等大分子的形成, 所以隨著反應進行,熒光物質的積累會越來越少[8]。
美拉德初期產物經過脫水、裂變會產生無色的還原酮與熒光物質, 此時不飽和的羰基化合物增加,如: 糠醛、脫氧鄰酮醛糖等。由于產生了一些小分子化合物, 這個體系的熒光特性增強, 而后會與其他物質聚合生成類黑素, 所以在16 h后開始下降。

圖3 在激發波長343 nm和發射波長420 nm處的熒光強度Fig. 3 The fluorescence intensity of Maillard reaction with Ex at 343 nm and Em at 420 nm
2.4 低聚殼聚糖美拉德產物的結構表征
圖 4是低聚殼聚糖及其衍生物的紅外光譜圖。殼聚糖及三種衍生物在1 100 cm–1附近都有3個較強的多糖特征吸收峰, 分別是 895、1 085 cm–1以及1 155 cm–1, 這些吸收峰都來自殼聚糖主鏈環狀結構,可作為判定低聚殼聚糖及其衍生物存在的特征吸收峰[4]。低聚殼聚糖在1 621、1 515和1 381 cm–1附近的吸附帶, 分別歸因于酰胺I(C=O)、自由氨基(—NH2)和酰胺Ⅲ[15]。且CC-16和 CC-24在1 621、1 515 cm–1和1 381 cm–1的吸收峰較低聚殼聚糖有所降低, 表明了反應16 h后, 酰胺I(C=O)、自由氨基(–NH2)和酰胺Ⅲ的減少[16], 即低聚殼聚糖參與了美拉德反應。
采用Waters 2 410型凝膠色譜儀, 測得樣品低聚殼聚糖的分子量為 9 370 Da, 美拉德反應制得的低聚殼聚糖衍生物CC-8、CC-16和CC-24的分子質量分別為11 759 Da、11 761 Da和11 895 Da。美拉德衍生物的分子質量較低聚殼聚糖都有所增加, 表明低聚殼聚糖分子自身含有游離氨基和羰基相互反應形成了更大的分子。

圖4 低聚殼聚糖及三種低聚殼聚糖美拉德衍生物的紅外圖Fig. 4 The FTIR spectra of COS, CC-8, CC-16 and CC-24

圖5 低聚殼聚糖及其美拉德衍生物對超氧陰離子的清除能力Fig. 5 Scavenging activities of COS, CC-8, CC-16 and CC-24 on superoxide anions
2.6 對DPPH 自由基的清除
圖6描述了殼聚糖及其衍生物對DPPH自由基的清除能力。由圖可知, 三種低聚殼聚糖衍生物對DPPH的清除能力均優于低聚殼聚糖, 即抗氧化能力: CC-16>CC-8>CC-24>COS。美拉德反應產物對DPPH的清除能力與體系的熒光值有一定關系[18]。本實驗表明, 殼聚糖衍生物對 DPPH自由基的清除能力與反應過程中熒光值的變化結果一致。低聚殼聚糖分子鏈中的活性氨基和羥基可以提供氫與 DPPH結合, 從而達到清除DPPH的目的[4]。這一結果同樣顯示, 雖然經美拉德反應后氨基的含量減少, 但低聚殼聚糖衍生物對 DPPH的清除能力明顯增強, 與對的清除結果相仿。
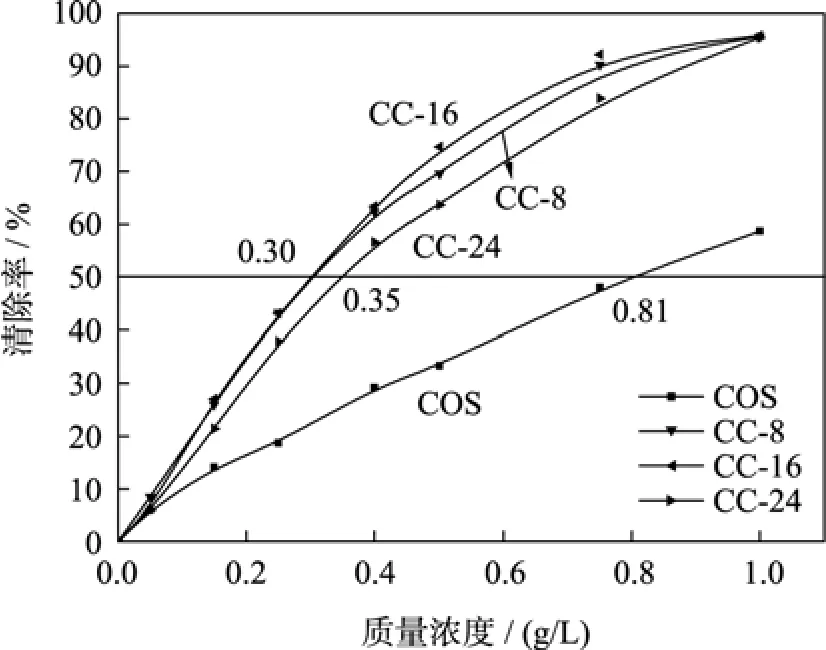
圖6 低聚殼聚糖及其美拉德衍生物對DPPH的清除能力Fig. 6 Scavenging activities of COS, CC-8, CC-16 and CC-24 on DPPH radicals
2.7 還原能力的測定
還原能力是表示抗氧化物質提供電子能力的重要指標, 通過提供電子, 阻斷Fe2+向Fe3+的轉變, 從而表現出一定的還原能力。研究表明, 抗氧化活性和還原能力之間存在著密切的關系[19]。CC-8、CC-16、CC-24以及COS的還原能力如圖7所示。隨著濃度的增加, 各樣品的吸光值隨之增加, 即還原能力逐漸增強。在濃度為 2.5 g/L時, COS、CC-8、CC-16和CC-24的吸光度分別為0.48、0.83、0.89和0.79, 即還原能力順序為CC-16>CC-8>CC-24>COS。殼聚糖的還原能力也與其提供電子的活性氨基和羰基有關,美拉德反應后還原能力卻因活性基團的減少而增強,這與前面的結果一致。
本文研究表明低聚殼聚糖美拉德反應過程中,隨著反應時間的增加, 體系pH逐漸下降, 褐變不斷增強, 熒光值在反應16 h內增長, 16 h后開始下降。低聚殼聚糖美拉德衍生物的抗氧化能力 16 h的最好。由此可見, 低聚殼聚糖美拉德衍生物的抗氧化能力與反應褐變程度沒有關系, 而與熒光的變化有某種聯系。這一理論為熒光值作為美拉德反應生成抗氧化能力的產物監測指標奠定了基礎, 但其機理還有待進一步研究。

圖7 低聚殼聚糖及其美拉德衍生物的還原能力測定Fig. 7 Reducing capacity of COS, CC-8, CC-16 and CC-24
美拉德反應過程中會產生具有抗氧化性的物質,其中某些有抗氧化性的小分子物質可能生成、積累或者揮發, 也可能聚合成抗氧化性較好的大分子物質, 如類黑素等。通過美拉德反應制備三種低聚殼聚糖衍生物, 盡管消耗了活性氨基, 但其衍生物的抗氧化性卻得到了較大的提升, 其機理也有待進一步研究。
3 結論
本實驗通過對低聚殼聚糖本身的美拉德反應,制備低聚殼聚糖衍生物, 并檢測了低聚殼聚糖及其衍生物對、DPPH 的清除能力以及還原能力, 結果顯示衍生物的抗氧化性均優于低聚殼聚糖, 且反應16 h的低聚殼聚糖衍生物抗氧化性能較好。雖然低聚殼聚糖衍生物的活性氨基含量下降了, 但其抗氧化性能得到了提升, 故認為殼聚糖自身美拉德反應后抗氧化性能得到提高, 這為制備天然、安全、高效的抗氧化劑提供了思路。
[1] 尹學瓊, 林強, 張岐, 等. 低聚殼聚糖及其金屬配合物的抗活性研究[J]. 應用化學, 2002, 19(4):325-328.
[2] Zeng L T, Qin C Q, Chi W L, et a1. Browning of chitooligomers and their optimum preservation[J]. Carbohydrate Polymers , 2007, 67(4): 551-558.
[3] 姚倩, 孫濤, 徐軼霞. 低聚殼聚糖衍生物的制備及其抗氧化性能[J]. 天然產物研究與開發, 2008, 20(3):530-533.
[4] Yamaguchi T, Takamura H, Matoba T, et al. HPLC Method for evaluation of the free radical-scavenging activity of foods by using 1, 1diphenyl-2-picrylhrazyl[J]. Bioscience Biotechnology and Biochemistry,1998, 62(6): 1201-1204.
[5] Yen G C, Chen H Y. Antioxidant activity of various tea extracts in relation to their antimutagenicity[J]. Journal of Agricultural and Food Chemistry, 1995, 43(1):27-32.
[6] Ames J M. Applications of the Maillard reaction in the food industry[J]. Food Chemistry, 1998, 62(4):431-439.
[7] Brands C M J, Van Boekel M A J S. Kinetics modeling of reactions in heated monosaccharide-casein systems[J]. Journal of Agricultural and Food Chemistry,2002, 50(23): 6725-6739.
[8] Kim D, Petrisor I G, Yen T F. Geopolymerization of biopolymers: A preliminary inquiry[J]. Carbohydrate Polymers, 2004, 56(2): 213-217.
[9] Ajandouz E H, Tchiakpe L S, DalleOre F, et al. Effect of pH on caramelization and Maillard reaction kinetics in fructose-lysine model systems[J]. Food Science,2001, 66(7): 926-931.
[10] 趙希榮. 殼聚糖與葡萄糖發生美拉德反應的條件及產物的抗氧化性能[J]. 中國食品添加劑, 2004, 25(6):63-67.
[11] Sweetie R K, Ramesh C, Arun S. Chitosan glucose complex–A novel food preservative [J]. Food Chemistry, 2008, 106(2): 521-528.
[12] 孫麗平, 汪東風, 徐瑩. pH和加熱時間對美拉德反應揮發性產物的影響[J].食品工業科技, 2009, 30(4):122-125.
[13] Moralew F J, Romero C, Jimenez-perez S. Chromatographic determination of bound hydroxyl methyl furfural as an index of milk protein glycosylation[J].Journal of Agricultural and Food Chemistry, 1997,45(5): 1570-1573.
[14] Wittayachai L, Soottawat B, Munehiko T. Characteristics and antioxidative activity of Maillard reaction products from a porcine plasma protein-glucose model system as influenced by pH[J]. Food Chemistry, 2007,100(2): 669-677.
[15] Qin C Q, Du Y M, Xiao L, et al. Enzymicpreparation of water-soluble chitosan and their antitumor activity[J].International Journal of Biological Macromolecules,2002, 31(1-3): 111-117.
[16] Umemura K, Kawai S. Modification of chitosan by the Maillard reaction using cellulose model compounds[J].Carbohydrate Polymers, 2007, 68(2): 242-248.
[17] Xie W M, Xu P X, Liu Q. Antioxidant activity of water-soluble chitosan derivatives[J]. Bioorganic&Medicinal Chemistry Letters, 2001, 11(13):1699-1701.
[18] Francisco J M, Salvio J P. Free radical scavenging capacity of Maillard reaction products as related to colour and fluorescence[J], Food Chemistry, 2001, 72(1):119-125.
[19] Jing H, Kitts D D. Chemical and biochemical properties of casein–sugar Maillard reaction products[J]. Food and Chemical Toxicology, 2002, 40(7): 1007-1015.
The Maillard reaction of chitosan oligosaccharide and the antioxidative activities of its derivatives
SUN Tao1,2, ZHU Yun1, WANG Yan-ping1, XIE Jing1, XUE Bin1
(1. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China; 2. Institute of Marine Science, Shanghai Ocean University, Shanghai 201306, China)
Apr.,26,2011
chitosan oligosaccharide; Maillard reaction; antioxidative activity
Three kinds of chitosan oligosaccharide derivatives prepared through Maillard reaction by heating chitosan oligosaccharide for 8, 16 and 24 hours were named CC-8, CC-16 and CC-24, respectively. The pH, absorbance and fluorescence were determined during the reaction. Chitosan oligosaccharide derivatives were characterized by Fourier transform infrared (FTIR) spectroscopy and their molecular weights were determined by Gel permeation chromatograph (GPC). Their antioxidative activity was investigated by employing various established in vitro systems, such as superoxide anion, 1-diphenyl-2-picrylhydrazyl (DPPH) radicals scavenging, and their reducing capacity was also studied. The results showed that the pH value of the reaction system decreased during Maillard reaction. The UV-Vis absorbance increased significantly at 280 nm and this increase slowed down after 16 hr. The fluorescence intensity significantly increased with Ex at 343 nm and Em at 420 nm and also slowed down after 16 hr. All the three derivatives kept the characteristic absorption peak of chitosan oligosaccharide. Their antioxidative and reducing capacities were both much stronger than those of the chitosan oligosaccharide and CC-16 has the strongest antioxidative activity.
Q539
A
1000-3096(2012)05-0065-06
2011-04-26;
2011-07-20
“十二五”國家支撐計劃項目(2012BAD38B09); 上海市科委工程中心建設項目(11DZ2280300)
孫濤(1970-), 女, 副教授, 博士, 研究方向: 多糖的改性及生物功能的開發, 電話: 021-61900363, E-mail: taosun@shou.edu.cn
(本文編輯:康亦兼)

