美國FDA對輸液泵風險管理中的危害分析概述
北京市藥品監督管理局醫療器械技術審評中心(100061)王晨
首都醫科大學生物醫學工程學院(100069)劉志成
輸液泵產品是預期通過泵產生的正壓來控制流入患者體內的液體流量的設備,在臨床上是常用的護理設備。它在嵌入式軟件的控制下能夠精確控制輸液速度和輸液量,并能在輸液完成、管路發生氣泡或堵塞等情況下進行報警,使用起來較為方便,也減輕了護士的工作量。然而,輸液泵產品在國內的不良事件報告中一直處于高發生率,而美國FDA也在5年內收到了超過五萬份有關輸液泵的醫療器械不良事件報告,這引起了國內外醫療器械監管部門的極大重視。
從FDA不良事件報告中揭示出這些問題,可能是由于設計錯誤導致的,而最常見的問題包括軟件信息錯誤、人為因素(包括但不僅限于使用錯誤)、器件損壞、供電不足、警報遺漏、輸液過度或不足等[1]。
在輸液泵的設計開發過程中,需要對輸液泵的生產和使用等提出一系列可能影響其安全性和有效性的特征性問題,提問題的角度也是從涉及的操作者、患者和維護者等方面來考慮的[2]。FDA則明確了存在于輸液泵系統中的危險因素,要求企業對輸液泵進行危害分析,來識別所有可能出現的危害,并且在產品上市前通告(510(k))時需明示危險因素并描述危害分析的方法以及減輕危害的措施。這些危險因素包括操作危害、環境危害、電氣危害、硬件危害、軟件危害、機械危害、生物學和化學危害、使用危害8大類。本文列出了這些危害的示例表。

附表1 操作危害示例

附表2 環境危害示例

附表3 電氣危害示例

附表4 硬件危害示例

附表5 軟件危害示例

附表6 機械危害示例

附表7 生物學和化學危害示例
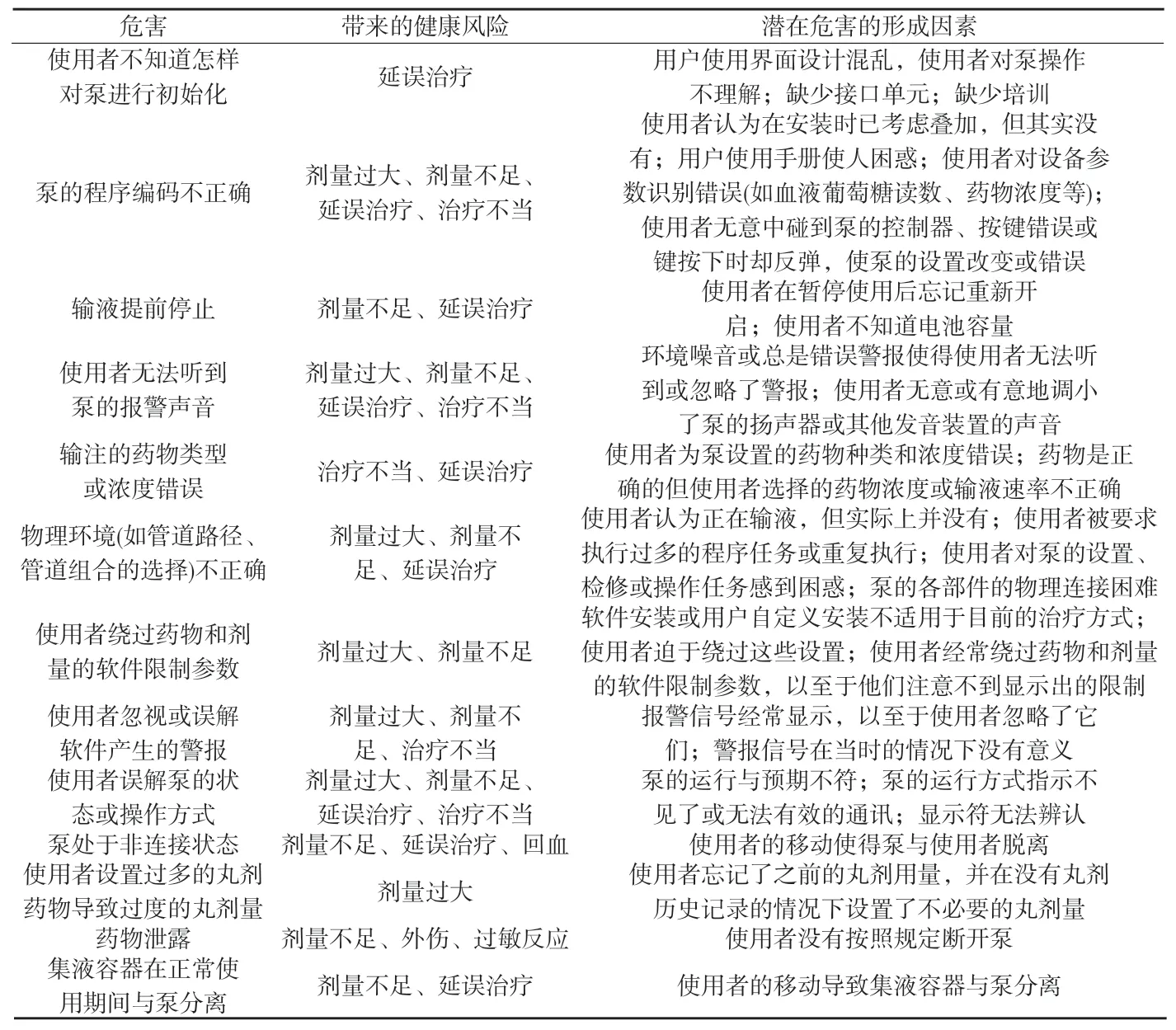
附表8 使用危害示例
1 操作危害
2 環境危害
3 電氣危害
4 硬件危害
5 軟件危害
6 機械危害
7 生物學和化學危害
8 使用危害
通過學習美國FDA對輸液泵的風險分析要求,可了解美國輸液泵上市前對產品風險的識別要求,幫助國內輸液泵企業在產品設計階段考慮降低危害發生的風險,為保證輸液泵的質量,最終避免在臨床使用時發生不良事件,具有主要的指導意義。

