食品中熱損傷沙門氏菌選擇性增菌及實時熒光聚合酶鏈式反應檢測
索 標,滕要輝,史賢明,艾志錄
(1.河南農業大學食品科學技術學院,河南 鄭州 450002;2.上海交通大學農業與生物學院,上海 200240)
食品中熱損傷沙門氏菌選擇性增菌及實時熒光聚合酶鏈式反應檢測
索 標1,2,滕要輝1,史賢明2,艾志錄1
(1.河南農業大學食品科學技術學院,河南 鄭州 450002;2.上海交通大學農業與生物學院,上海 200240)
為了能夠高效檢測食品中的亞致死損傷沙門氏菌,首先采用熱激脅迫的方法得到亞致死損傷沙門氏菌細胞,進而基于選擇性增菌培養液SEL建立一種實時熒光聚合酶鏈式反應檢測技術。結果表明:在SEL中經過20h增菌培養后,無論是否經過修復培養,1~2CFU/5mL SEL的亞致死損傷細胞都能得到完全修復并增菌至109CFU/mL水平;依此建立的實時熒光聚合酶鏈式反應檢測技術的純菌擴增效率為95.41%,檢測限為4CFU/反應體系,在人工污染碎食品樣品中的檢測限為3CFU/10g碎牛肉,而且與傳統培養檢測方法的結果相吻合。本方法在24h內即可完成食品中熱損傷沙門氏菌的修復、選擇性增菌以及實時熒光聚合酶鏈式反應檢測,可應用于食品中沙門氏菌污染狀況調查及高效檢測。
熱損傷;沙門氏菌;選擇性增菌;實時熒光聚合酶鏈式反應;檢測
沙門氏菌(Salmonella)是一種廣泛分布于自然界的危害極大的腸道致病菌,在我國,40%的細菌性食物中毒病例是由沙門氏菌引起的[1],因此必須采取高效的檢測手段以保障食品的安全。實時熒光聚合酶鏈式反應(polymerase chain reaction,PCR)方法是檢測微生物的有效分子手段之一[2],現在已經建立一些實時熒光PCR檢測技術以用于食品中沙門氏菌的檢測[3]。
食源性致病菌經過熱激等物理控制方法處理后會出現3種生理上狀態不同的細胞——未受損傷的細胞、亞致死損傷細胞和死亡細胞[4]。由于食品中亞致死損傷細胞存在的可能性,新型分子檢測技術的開發需要能夠同時檢出活性細胞和損傷細胞[5]。此外,絕大多數食品樣品中的致病菌都是以很低的水平存在(每25g食品一般只有1~2個細胞),食品樣品中也存在大量的背景微生物菌群,因此,在檢測之前仍需要對食品中的致病菌進行選擇性增菌培養[6]。然而,目前常用的作為選擇性培養基的成分對損傷致病菌的修復和生長會產生抑制作用[7],這也是目前食源性致病菌檢測之前,大都需要經過非選擇性修復培養后再經過選擇性增菌這兩步的主要原因[8]。SEL是Kim等[9]開發出來的用于沙門氏菌、大腸桿菌O157∶H7以及單核細胞增生李斯特菌的選擇性增菌培養液,本人前期也采用SEL建立了一種多重實時熒光PCR檢測平臺[10],但目前對該培養基修復并增菌培養損傷致病菌的能力尚不清楚。
本研究以鼠傷寒沙門氏菌為供試菌株,采用熱激的方法得到亞致死損傷細胞,進而研究其在SEL中的修復能力,建立實時熒光PCR檢測技術,并在人工污染的牛肉樣品中進行檢測試驗,從而建立一種新型的基于選擇性培養基SEL的損傷沙門氏菌的修復、選擇性增菌和實時熒光PCR檢測平臺。
1 材料與方法
1.1 材料、試劑與儀器
鼠傷寒沙門氏菌(Salmonella entericaTyphimurium ATCC14028) 美國標準菌種收藏所。
木糖賴氨酸去氧膽酸鹽瓊脂(XLD)、營養肉湯(NB)、營養肉湯瓊脂(NA)、營養肉湯瓊脂(NASA,添加4% NaCl)、緩沖李氏菌增菌肉湯(BLEB) 美國BD公司。
DNeasy組織總DNA提取試劑盒 美國Qiagen公司;抗生素Acriflavine、Nalidixic acid sodium salt、Phosphomycin disodium salt以及 Cycloheximide C 美國Sigma公司;熒光定量PCR試劑盒 美國應用生物系統公司;引物和實時熒光PCR探針由美國應用生物系統公司合成。
恒溫混合器、移液器 德國Eppendorf公司;ABI 7500型實時熒光PCR儀 美國應用生物系統公司;NanoDrop ND-100分光光度計 美國NanoDrop科技公司。
1.2 方法
1.2.1 熱損傷沙門氏菌的制備
將鼠傷寒沙門氏菌ATCC14028于37℃培養3.5h至指數后期,取0.5mL于55℃熱激處理6min后,熱激亞致死損傷細胞立即用于下步操作。
1.2.2 亞致死沙門氏菌在選擇性增菌培養液SEL中的修復
將熱激后的亞致死沙門氏菌菌液用0.9%生理鹽水進行梯度稀釋,分別在NA、XLD和NASA上測定活性細胞的數目。取50μL梯度稀釋后的亞致死菌液分別加入到有5mL BLEB培養基的20mL PA瓶中,以無菌0.9%生理鹽水作為空白對照,37℃、150r/min振蕩修復培養0、1h和2h后,根據選擇性增菌液SEL的配方[9],加入各種抗生素,以得到終質量濃度分別為0.01g/L的Acriflavine、0.05g/L的Cycloheximide、0.05g/L的Fosfomycin以及0.002g/L的Nalidixic acid。同等條件下再培養6h和20h后,從每個處理中各取1mL用于活細胞計數。每樣重復3次,取平均值。
1.2.3 亞致死損傷沙門氏菌細胞數目的測定
參照Aljarallah等的方法進行[11],將熱激或SEL培養后的菌液經10倍系列稀釋后,取0.1mL涂布于NA、XLD和NASA平板上,細胞外膜受損的亞致死細胞無法在XLD培養上生長,而細胞質膜受損的亞致死細胞無法在NASA培養基上生長,而亞致死損傷細胞在NA培養基上可以正常生長[11]。涂布后的NA和XLD平板在37℃培養24h,NASA平板培養48h,預實驗也證明更長的培養時間對存活細胞的計數結果沒有任何影響。培養結束后,計數各培養基上的菌落形成單位(CFU),根據各試驗結果,計算平均值和標準偏差。
1.2.4 基因組DNA的提取
1mL的細菌培養液用8000×g離心10min收集細胞后,用QIAGEN DNeasy Tissue Kit試劑盒法提取基因組DNA。提取后的基因組DNA用NanoDrop ND-100分光光度計確定所提取基因組DNA溶液的濃度與純度。
1.2.5 實時熒光PCR
參照前期建立的實時熒光PCR方法[10],所用invA基因引物的特異性已經得到證明。上游引物序列為:GTTGAGGATGTTATTCGCAAAGG;下游引物序列為:GGAGGCTTCCGG GTCAAG;TaqMan探針序列為:CCGTCAGACCTCTGGCAGTACCTTCCTC,探針的3′端標記有FAM熒光染料。每20μL實時熒光PCR反應體系中包含1×緩沖液、200nmol/L引物和探針、以及2μL的基因組DNA。混勻后,加入96孔板中,再加入2μL待檢測的模板基因組DNA,置實時熒光PCR儀上反應。反應程序為:95℃熱啟動10min,隨后是40個循環的95℃變性15s以及60℃復性和延伸1min。
1.2.6 亞致死沙門氏菌修復與實時熒光檢測技術在人工污染食品樣品中的應用
將0.1mL梯度稀釋后的亞致死鼠傷寒沙門氏菌ATCC 14028分別人工污染于10g碎牛肉樣品中,供試碎牛肉購自附近超市,并預先用傳統培養的方法(《USDA/FSIS Microbiology Laboratory Guidebook》)驗證樣品中不含有沙門氏菌的污染。在SEL選擇性增菌培養液中增菌培養20h后,1mL增菌液用于基因組DNA的提取和實時熒光PCR檢測,同時,樣品中修復并增菌后沙門氏菌的數目也用XLD選擇性平板計數法測定,以作為該實時熒光PCR檢測方法的對照。人工污染試驗重復進行3次,每次包含兩個平行處理。
2 結果與分析
2.1 熱損傷沙門氏菌在選擇性培養基SEL中的修復
本試驗用選擇性增菌培養基SEL回復培養55℃熱激亞致死損傷的沙門氏菌,結果如表1所示,熱激后的起始各濃度沙門氏菌細胞在XLD上的活細胞數目較在NA上少,而NASA平板上均不可生長,說明部分細胞的外膜受到了損傷,而幾乎全部活性細胞的質膜均受到了不同程度的損傷,為亞致死損傷細胞[11]。在SEL中增菌培養后的結果表明,如果接種量大于1.80×102CFU/5mL SEL時,在亞致死損傷細胞經過2h的非選擇性修復培養后,再在加入選擇性抗生素的SEL中經過6h的增菌培養,在XLD和NASA培養基上能檢出與在NA培養基上大致相等的菌落數目,如果只經過1h的回復培養,則1.80×102CFU/5mL SEL接種量的PA瓶中的菌液在NASA上無活性細胞檢出。而沒有經過回復培養的細菌,經過6h的增菌培養后,1.80×102CFU/5mL SEL或更低接種量的菌液在3種培養基上均無活性細胞檢出,更高接種量的菌液經過6h的SEL培養后,在3種培養基上的活性細胞數目基本一致,但與初始接種量相比,細胞數目并沒有得到明顯的增加。在SEL中經過20h的增菌培養后,無論是否經過一定時間的修復培養,各接種量菌液中的細胞都能得到完全修復并增菌到109CFU/mL。
2.2 實時熒光PCR檢測靈敏度
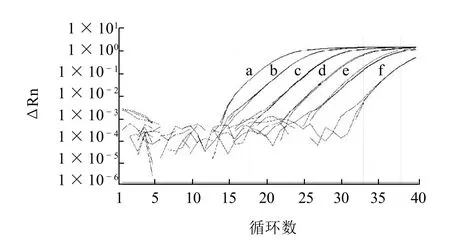
圖1 沙門氏菌實時熒光PCR檢測靈敏度Fig.1 Detection sensitivity of Salmonella by Real time PCR
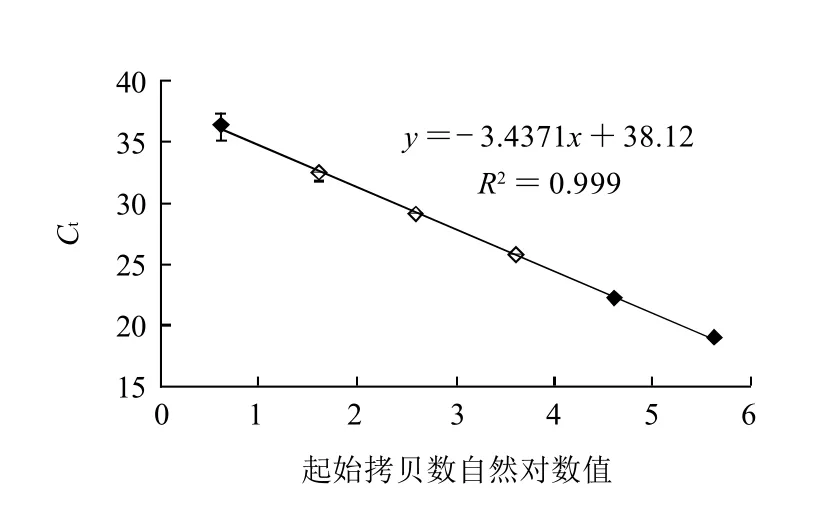
圖2 沙門氏菌實時熒光PCR檢測效率Fig.2 Detection efficiency of Salmonella by Real time PCR
為了測定實時熒光PCR檢測沙門氏菌的擴增效率,采用鼠傷寒沙門氏菌ATCC14028作為供試菌株,根據不同濃度的基因組DNA的擴增結果計算出標出曲線,再根據標準曲線的斜率k(-3.4371),由公式E=(10-1/k)-1計算出擴增效率(E)。如圖1、2所示,各質量濃度基因組DNA擴增曲線之間距離均勻,擴增效率為95.41%,最低為4個拷貝數的沙門氏菌基因組DNA可被檢測出。
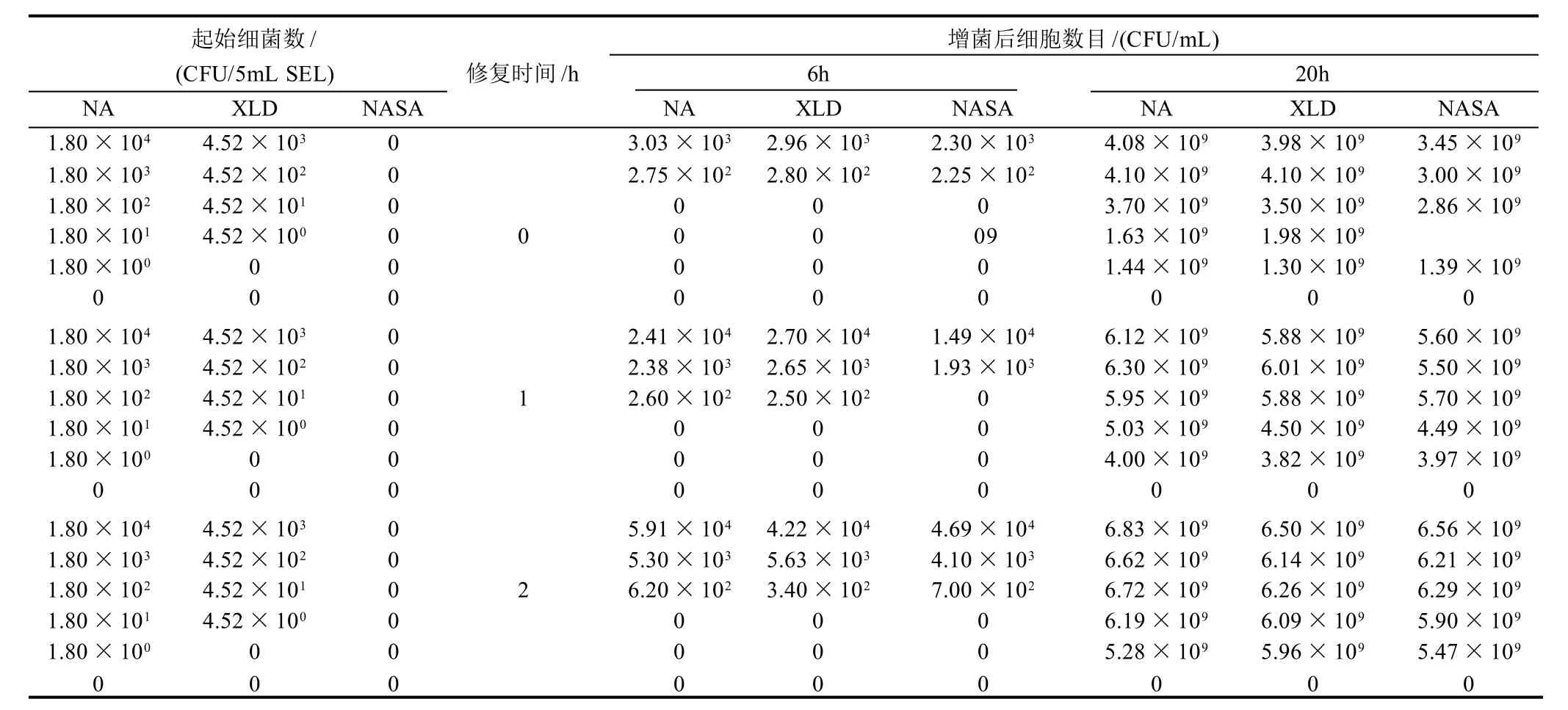
表1 熱損傷沙門氏菌在SEL培養液中的修復和增菌培養結果Table 1 Results of recovery and enrichment of thermal injured Salmonella in SEL broth
2.3 實時熒光PCR檢測方法在人工污染碎牛肉樣品中的應用
一系列10倍梯度稀釋的熱激亞致死鼠傷寒沙門氏菌ATCC 14028接種于10g碎牛肉中,經過在SEL中20h的增菌培養后,增菌液用于實時熒光PCR檢測,同時用選擇性XLD平板對各致病菌進行計數作為對照。結果如表2所示,經過20h的增菌培養后,用這兩種檢測方法均能從10g碎牛肉樣品中檢測出最低起始數目為3CFU的沙門氏菌,然而, 實時熒光PCR定量檢測結果得到的細胞數目略高于平板菌落計數結果。

表2 實時熒光PCR結合SEL選擇性增菌法從人工污染碎牛肉樣品中檢測沙門氏菌Table 2 Real-time PCR combined with SEL broth for detection of Salmonella in spiked ground beef
3 討 論
細菌受到熱激處理后會出現亞致死損傷甚至死亡,亞致死致病菌的檢測也是食品安全研究檢測的熱點和難點之一[5]。食品中亞致死損傷細胞的存在為食源性致病菌安全檢測提出了新的要求,必須引起人們的足夠重視,因為在食源性致病菌檢測過程中,亞致死損傷細胞的存在有可能會高估致病菌的數目[12],也有可能會造成假陰性檢測結果,特別是當用選擇性培養基檢測致病菌的時候[13],在后面一種情況下,必須包括一個亞致死損傷細胞的修復培養步驟。
目前用于亞致死損傷致病菌修復培養的培養基大多采用不含選擇性成分的營養培養基,如BPW、UPB以及TSB等[5,14]。曾慶梅等[15]研究了不同介質、溫度和時間對熱損傷腸炎沙門氏菌的修復的影響,得出最佳修復條件為營養肉湯37℃修復2h。然而,這些培養基均無法滿足檢測目標致病菌選擇性增菌的需要。由于食品樣品中大量背景菌群的存在,選擇性增菌培養也是避免出現假性檢測結果的重要步驟[16]。本實驗首次評價了選擇性增菌培養液SEL修復以及增菌培養熱致亞致死損傷鼠傷寒沙門氏菌的能力,結果表明了該培養液除了能夠選擇性增菌培養沙門氏菌之外[9],也能夠很好的修復鼠傷寒沙門氏菌外膜和質膜的損傷關鍵部位,但與前人報道的非選擇性培養液相比[17],添加了抗生素的該選擇性培養基也明顯延緩了細胞生長速度,既使經過1~2h的修復培養,6h的增菌培養也無法將1.80×101CFU/5mL SEL或更低的細胞增菌至可檢出水平,因此,20h的增菌培養對于后續的分子生物學檢測,仍是亞致死損傷沙門氏菌修復和增菌至可檢出水平所必須的。在該增菌培養條件下,即使不經過非選擇性修復步驟,1~2CFU/5mL SEL的熱激亞致死沙門氏菌也能夠增菌至可檢出水平。
在人工污染的碎牛肉樣品中,結合SEL選擇性增菌培養液,經過20h的培養,本實時熒光PCR檢測方法能在大量背景菌存在的條件下,從10g碎牛肉樣品中修復、增菌并檢測出2~3CFU的沙門氏菌,這也是目前實時熒光PCR等分子生物學方法所能達到的最低檢測限[16]。
本研究采用了活性平板計數的方法對增菌后的人工污染碎牛肉樣品中的致病菌進行了計數,并與實時熒光PCR的定量結果進行了比較,結果表明在所得到的分別用CFU/mL與基因組DNA拷貝/mL表示的定量結果之間有一定的差異,這是因為活細胞技術的方法僅僅可以測定能在選擇性平板上生長的具有活性的細胞,而PCR的方法定量的結果則包括了所有可培養以及不可培養的細胞,因而在食品樣品中檢測出的基因拷貝數結果大多高于活細胞數目。
至于該實時熒光PCR的檢測速率,從樣品增菌到檢測結果的分析,整個檢測過程可在24h內完成。與傳統的以培養為基礎的方法所需要的5~7d才能得到結果相比,本研究所開發的實時熒光PCR方法顯著提高了食品中沙門氏菌檢測的效率。
總之,本研究基于選擇性增菌培養液SEL,開發出了一個快速、靈敏的實時熒光PCR方法以從食品樣品中選擇性修復、增菌并檢測出熱損傷沙門氏菌。經過對其檢測靈敏度和有效性的綜合評價,本檢測方法可以完成大量食品樣品中包括亞致死細胞在內的沙門氏菌高效快速檢測。
[1] 童哲, 程蘇云, 梅玲玲. 浙江省272份食品沙門氏菌檢測結果[J]. 浙江預防醫學, 2003, 15(4)∶ 33-34.
[2] ESPY M J, UHL J R, SLOAN L M, et al. Real-time PCR in clinical microbiology∶ applications for routine laboratory testing[J]. Clin Microbiol Rev, 2006, 19 (1)∶ 165-256.
[3] 麻麗丹, 王殿夫, 巴中華, 等.TaqMan MGB PCR定量檢測水產品中沙門氏菌的方法建立[J]. 食品科學, 2009, 30(20)∶ 303-307.
[4] WUYTACK E Y, PHUONG L D, AERTSEN A, et al. Comparison of sublethal injury induced inSalmonellaenterica serovarTyphimuriumby heat and by different nonthermal treatments[J]. J Food Prot, 2003, 66(1)∶31-37.
[5] WU V C. A review of microbial injury and recovery methods in food[J].Food Microbiol, 2008, 25(6)∶ 735-744.
[6] MANDAL P K, BISWAS A K, CHOI K, et al. Methods for rapid detection of foodborne pathogens∶ an overview[J]. Am J Food Technol,2011, 6(2)∶ 87-102.
[7] JACOBSEN C N. The influence of commonly used selective agents on the growth ofListeria monocytogenes[J]. Int J Food Microbiol, 1999,50(3)∶ 221-226.
[8] NUGEN S R, BAEUMNER A J. Trends and opportunities in food pathogen detection[J]. Anal Bioanal Chem, 2008, 391(2)∶ 451-454.
[9] KIM H, BHUNIA A K. SEL, a selective enrichment broth for simultaneous growth ofSalmonella enterica,Escherichia coliO157∶H7, andListeria monocytogenes[J]. Appl Environ Microbiol, 2008, 74(15)∶4853-4866.
[10] SUO Biao, HE Yiping, TU S I, et al. A multiplex real-time polymerase chain reaction for simultaneous detection ofSalmonellaspp.,Escheri-chia coliO157, andListeria monocytogenesin meat products[J].Foodborne Pathog Dis, 2010, 7(6)∶ 619-628.
[11] ALJARALLAH K M, ADAMS M R. Mechanisms of heat inactivation inSalmonellaserotypeTyphimuriumas affected by low water activity at different temperatures[J]. J Appl Microbiol, 2007, 102(1)∶ 153-160.
[12] RITZ M, PILET M F, JUGIAU F, et al. Inactivation ofSalmonella TyphimuriumandListeria monocytogenesusing high-pressure treatments∶destruction or sublethal stress?[J]. Lett Appl Microbiol, 2006, 42(4)∶357-362.
[13] HOEFEL D, GROOBY W L, MONIS P T, et al. Enumeration of waterborne bacteria using viability assays and flow cytometry∶ a comparison to culture-based techniques[J]. J Microbiol Met, 2003, 55(3)∶ 585-597.
[14] JIANG J, LARKIN C, STEELE M, et al. Evaluation of universal preenrichment broth for the recovery of foodborne pathogens from milk and cheese[J]. J Dairy Sci, 1998, 81(11)∶ 2798-2803.
[15] 曾慶梅, 張冬冬, 韓抒, 等. 熱損傷腸炎沙門氏菌的修復方法研究[J].食品科學, 2009, 30(23)∶ 233-236.
[16] 索標, 汪月霞, 艾志錄. 食源性致病菌多重分子生物學檢測技術研究進展[J]. 微生物學雜志, 2010, 30(6)∶ 71-75.
[17] CHEN Jing, ZHANG Lida, PAOLI G C, et al. A real-time PCR method for the detection ofSalmonella entericafrom food using a target sequence identified by comparative genomic analysis[J]. Int J Food Microbiol,2010, 137(2/3)∶ 168-174.
Selective Enrichment and Real time PCR Detection of Thermal Injured Salmonella in Food
SUO Biao1,2,TENG Yao-hui1,SHI Xian-ming2,AI Zhi-lu1
(1. College of Food Science and Technology, Henan Agricultural University, Zhengzhou 450002, China;
2. School of Agriculture and Biology, Shanghai Jiao Tong University, Shanghai 200240, China)
A selective enrichment broth, SEL based real time PCR assay was established after treating a sublethal injuredSalmonellacells by heat-shock. The results showed that 1-2 CFU of injuredSalmonellacells in 5 mL SEL could be fully recovered and enriched to the level of 109CFU/mL after a 20 h enrichment step even without the nonselective recovery process. The amplification efficiency of real time PCR was 95.41% and the detection limit was 4 CFU/reaction forSalmonellagenomic DNA.The detection limit in artificially contaminated food sample was 3 CFU/10 g ground beef, and showed a high coincidence to the detection result by traditional culture-based assay. The overall recovery, selective enrichment and detection procedure of thermal injuredSalmonella could be accomplished in 24 h, which showed a high potential of application in the effective detection ofSalmonellain food.
thermal injury;Salmonella;selective enrichment;real time polymerase chain reaction (PCR);detection
TS254.1
A
1002-6630(2012)10-0223-05
2011-04-17
河南農業大學(人才引進/博士啟動)基金項目(30300168);河南省重點科技攻關計劃項目(082102320006)
索標(1982—),男,副教授,博士,研究方向為食品微生物分子生態與食品安全。E-mail:suobiao@gmail.com

