我國自身免疫性胰腺炎共識意見(草案 2012,上海)
《中華胰腺病雜志》編委會
·標準與討論·
我國自身免疫性胰腺炎共識意見(草案 2012,上海)
《中華胰腺病雜志》編委會
本共識意見(草案)依據我國自身免疫性胰腺炎的最近研究,并參考國際相關指南和研究進展,由《中華胰腺病雜志》編委會組織消化、內鏡、影像、風濕免疫、病理、檢驗、內分泌、外科等多學科專家集體討論形成。希望同道們參考并提出寶貴意見,以期提高我國自身免疫性胰腺炎的診治水平。
自身免疫性胰腺炎(autoimmune pancreatitis,AIP)是一種以梗阻性黃疸、腹部不適等為主要臨床表現的特殊類型的胰腺炎。AIP由自身免疫介導,以胰腺淋巴細胞及漿細胞浸潤并發生纖維化、影像學表現胰腺腫大和胰管不規則狹窄、血清IgG4水平升高、類固醇激素療效顯著為特征。AIP是IgG4相關性疾病(IgG4-related disease,IgG4-RD)在胰腺的局部表現,除胰腺受累外,還可累及膽管、淚腺、涎腺、腹膜后、腎、肺等,受累器官也可見大量淋巴細胞、漿細胞浸潤及IgG4陽性細胞。由于AIP易被誤診為胰腺癌而導致不必要的手術,近年來逐漸引起重視。此外,與IgG4無關的AIP亞型也漸得到公認,據此將AIP分為1型和2型。因我國2型AIP少見,本文如無特別說明,所述AIP均指1型AIP。
一、概述
歷經幾十年研究,對AIP的認識逐漸清晰。1961年Sarles等首次報道慢性胰腺炎(chronic pancreatitis,CP)患者合并高γ-球蛋白血癥,認為這種胰腺炎與自身免疫相關,并將其稱為原發性硬化性胰腺炎;上世紀70年代有研究者報道干燥綜合征(Sj?gren′s syndrome,SjS)合并的胰腺炎及胰腺腫塊經類固醇激素治療后好轉;1992年Toki等報道4例CP患者主胰管彌漫性不規則狹窄,與一般的CP胰管擴張不同;1995年Yoshida等正式提出AIP的命名,至今已被廣泛接受。近年來,AIP病例報道不斷增多,對AIP的認識逐漸深入,兩種AIP亞型的異同更加明確(表1),各國AIP診斷標準相繼問世,為AIP的臨床診治及基礎研究提供了重要依據。
二、流行病學
AIP在全球各地區散在分布,目前日本報道AIP最多,歐美、韓國也有較多報道。我國近年來關于AIP的報道逐漸增多,已有300余例,大陸、臺灣均見報道,香港、澳門迄今尚無報道。AIP在全球人群的發病率尚不清楚。2007年日本的全國調查估計其年發病率為0.9/10萬。目前全球所報道AIP以1型為主,亞洲2型AIP少見,歐美2型AIP相對多見(20%~30%)。國外報道的AIP病例數約占同期CP的2%~10%,我國報道的這一比例為3.6%~9.7%。AIP的男女患者比例約為2∶1,多見于老年人,大部分患者初次發病年齡超過50歲,但也可于青少年期發病。AIP易被誤診為胰腺癌,為因疑診胰腺癌而行手術切除最常見的良性病變,約占所有胰十二指腸切除術的2.5%左右。

表1 1、2型AIP的比較
三、發病機制
AIP患者常伴血清γ-球蛋白、IgG或IgG4水平升高,組織病理學可見胰管周圍大量淋巴細胞、漿細胞浸潤,激素治療有效,提示AIP的發生與自身免疫機制有關,但其病因及具體發病機制尚不清楚。
(一)體液免疫
AIP患者常出現胰腺外器官受累且病理所見相似,提示胰腺與這些器官(涎腺、膽管以及腎小管等)之間可能存在共同抗原。基于胰腺、涎腺、膽管以及遠端腎小管均有碳酸酐酶Ⅱ(carbonic anhydraseⅡ,CA-Ⅱ)及乳鐵蛋白(lactoferrin,LF)分布,且抗碳酸酐酶Ⅱ抗體(ACA-Ⅱ)和抗乳鐵蛋白抗體(ALF)在AIP患者中陽性率較高,有研究者認為CA-Ⅱ及LF是AIP可能的靶抗原。此外,部分患者抗核抗體(ANA)、類風濕因子(RF)等自身免疫抗體陽性,也提示AIP發病機制與體液免疫相關。
盡管AIP患者血清IgG4水平常升高且受累器官可見大量IgG4陽性漿細胞浸潤,但IgG4在AIP發病中的意義仍不清楚。現在普遍認為,持續、大量的IgG4陽性漿細胞浸潤可能是機體對AIP未知觸發因素的一種繼發性反應。
(二)細胞免疫
盡管AIP的效應細胞尚不清楚,但與酒精性CP及膽源性胰腺炎相比,AIP患者胰腺組織以及外周血中激活的、攜帶HLA-DR的CD4+及CD8+T細胞顯著增加。CD4+T細胞根據其分泌的細胞因子又可分為Th1及Th2細胞。Th1細胞分泌IL-2、TNF-α、γ干擾素以介導細胞免疫、巨噬細胞活化、細胞毒性及輔助B細胞產生補體;Th2細胞產生IL-4、5、6、10以促進體液免疫和過敏反應。在SjS和原發性硬化性膽管炎(primary sclerosing cholangitis,PSC)中,主要的浸潤細胞為CD4+HLA-DR+Th1細胞,而CD8+T細胞及B細胞較少,而某些AIP中的CD4+Th1細胞與SjS中發現的浸潤細胞類似,提示可能是由Th1細胞產生的細胞因子參與誘發AIP的發病和(或)疾病狀態的維持,而Th2細胞產生的細胞因子則與病程進展有關。一項動物實驗用CA-Ⅱ或LF免疫切除胸腺的BALB/c小鼠,結果發現CD4+Th1細胞在AIP的早期發病中起主要作用。
最近,Seleznik等報道了淋巴毒素(lymphotoxin,LT)β受體信號通路在AIP發病中的作用。與對照組相比,AIP患者胰腺組織中LTα和β的mRNA水平升高,胰腺和血清標本的趨化因子表達(CXCL13、CCL19、CCL21、CCL1和B細胞活化因子)增加,應用激素治療沒有影響上述因子的表達上調。腺泡特異性的過表達LTαβ導致小鼠(Ela1-LTab)胰腺呈AIP表現,并伴有系統性自身免疫疾病表現。淋巴細胞缺陷小鼠(Ela1-LTab/Rag1-/-)未表現腺泡特異性的LTαβ過表達;缺乏促炎單核細胞(Ela1-LTab/Ccr2-/-)不能阻止AIP發生,但可避免早期胰腺組織損傷。使用激素可降低胰腺炎癥程度,但不影響自身抗體的產生(如Ela1-LTab小鼠分泌型胰蛋白酶抑制物抗體)。相反,抑制LTβR信號通路可減少趨化因子表達、腎臟免疫復合物沉積以及Ela1-LTab小鼠的AIP表現。因此,研究者認為腺泡特異性地過表達LTαβ是AIP發病機制中的促進因素,中和LTβR配體可作為AIP潛在的治療方法。
(三)遺傳因素
目前有證據支持AIP與遺傳因素相關。有研究報道,主要組織相容性復合體Ⅱ抗原與人類的AIP易感性相關。AIP易感因素在不同種族、不同地域之間有所不同,這種多樣性提示可能存在某種內在抗原觸發了AIP易感者的發病。Kawa等報道了人類白細胞抗原HLA DRB1*0405-DQB1*0401單倍體基因型是日本人群AIP的易感基因。Umemura等報道Fc受體樣3基因(FCRL3)的多態性與日本人群的AIP發病有關。
(四)微生物感染
Guarneri等報道,幽門螺旋桿菌(Hp)感染可觸發AIP易感者的發病。該研究發現,人類CA-Ⅱ和Hp在胃內賴以生存及增殖的重要酶α-CA在分子結構上具有高度同源性,且兩者的同源片段均包含DRB1*0405的結合位點,提示Hp可能通過對宿主CA-Ⅱ結構的分子模擬,誘導宿主免疫細胞發生旁觀者激活,從而導致易感者發生AIP。
(五)補體系統
Muraki等發現活動期AIP患者血清中循環免疫復合物水平增高,經過激素治療后可顯著降低。這些AIP患者循環免疫復合物水平的增高與血清IgG1水平升高、補體C3及C4水平降低顯著相關,提示AIP患者高水平的循環免疫復合物可能通過激活補體系統而導致組織器官損傷。
四、組織病理學
(一)大體特征
肉眼觀察AIP胰腺腫脹增大、切面呈灰黃色、質硬,疾病后期由于胰腺實質廣泛纖維化從而導致胰腺萎縮和硬化。根據胰腺病變范圍可分為彌漫性增大與局灶性腫塊兩種(圖1)。彌漫性增大較常見,一般無鈣化或囊性病變;局灶性AIP腫塊多位于胰頭部,也可位于體尾部。切面呈灰黃色或黃白色,正常小葉結構消失,纖維化明顯,病變處胰管狹窄或阻塞。主胰管可呈彌漫性或節段性不規則狹窄,管腔橫斷面呈星形或不規則形。病程后期導管周圍顯著纖維化從而使管壁增厚、管腔狹窄甚至閉塞。如炎癥累及膽總管胰腺段,則可見此段膽總管壁纖維化,大量淋巴細胞、漿細胞浸潤使管壁增厚、管腔狹窄,上段膽總管擴張。與一般的CP不同,AIP少有胰腺鈣化、結石、假性囊腫及胰管擴張。少數病程較長患者可形成胰管結石,可能與主胰管不規則狹窄導致胰液積聚有關。
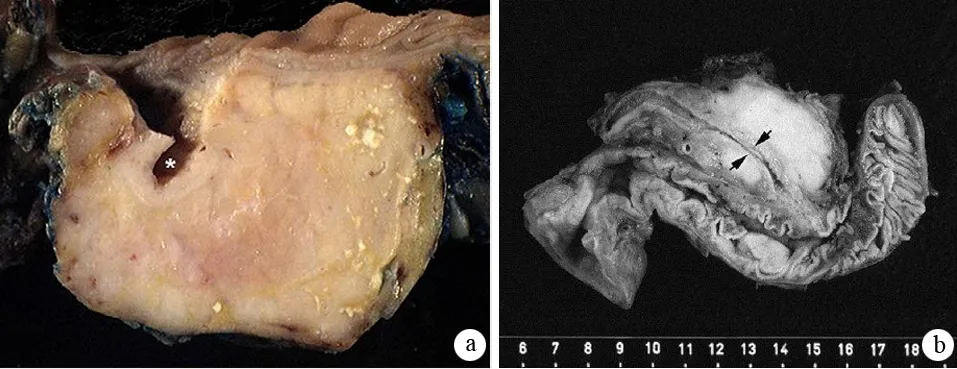
圖1a:彌漫性AIP,全胰彌漫性增大;b:胰頭部局灶性AIP,箭頭示狹窄胰管(Krasinskas AM, et al. Gastroenterol Clin North Am, 2007; Kl?ppel G, et al. Pancreas, 2003)
(二)組織學特征
根據組織病理學鏡下特征將AIP分為1、2兩型:(1)1型AIP,其病理特征為不伴有粒細胞性上皮損害(granulocyte epithelial lesion,GEL)的淋巴漿細胞硬化性胰腺炎(lymphoplasmacytic sclerosing pancreatitis,LPSP);(2)2型AIP,其病理特征為伴有GEL的特發性導管中心性胰腺炎(idiopathic duct-centric pancreatitis,IDCP)。這兩種亞型均有胰腺導管周圍淋巴細胞、漿細胞浸潤及纖維化,但又存在不同之處。LPSP的特征性表現包括以下4條(圖2):(1)胰管周圍彌漫性淋巴細胞、漿細胞浸潤,無粒細胞浸潤,炎癥細胞浸潤于導管上皮下,導管上皮未受浸潤及損害;(2)胰管及靜脈周圍彌漫性席紋狀纖維化(storiform fibrosis),尤其是胰周脂肪組織纖維化顯著;(3)靜脈周圍大量淋巴細胞、漿細胞浸潤導致閉塞性靜脈炎;(4)免疫組化顯示大量IgG4陽性漿細胞(>10個/高倍視野)。1型AIP在病程后期胰腺實質顯著纖維化,小葉結構破壞,腺泡萎縮,偶爾可見殘存的腺泡;小葉間隔增厚,受累胰腺導管狹窄或閉塞。1型AIP常可累及膽管、淚腺、涎腺、肺、腎等胰腺外器官,這些受累器官表現出與胰腺相似的炎癥改變,如顯著淋巴細胞及漿細胞浸潤、彌漫性纖維化、有大量IgG4陽性漿細胞等。與LPSP相比,IDCP的席紋狀纖維化和閉塞性靜脈炎少見,IDCP的特征性表現包括以下2條(圖3):(1)存在GEL,即中、小胰管的管腔及導管上皮內有大量粒細胞浸潤,導致導管上皮毀損、管腔閉塞,有時可見小葉內導管有微膿腫形成,腺泡內也可有粒細胞浸潤;(2)免疫組化顯示沒有或僅有少量IgG4陽性漿細胞(≤10個/高倍視野)。2型AIP部分合并炎癥性腸病,一般不累及胰腺外器官。
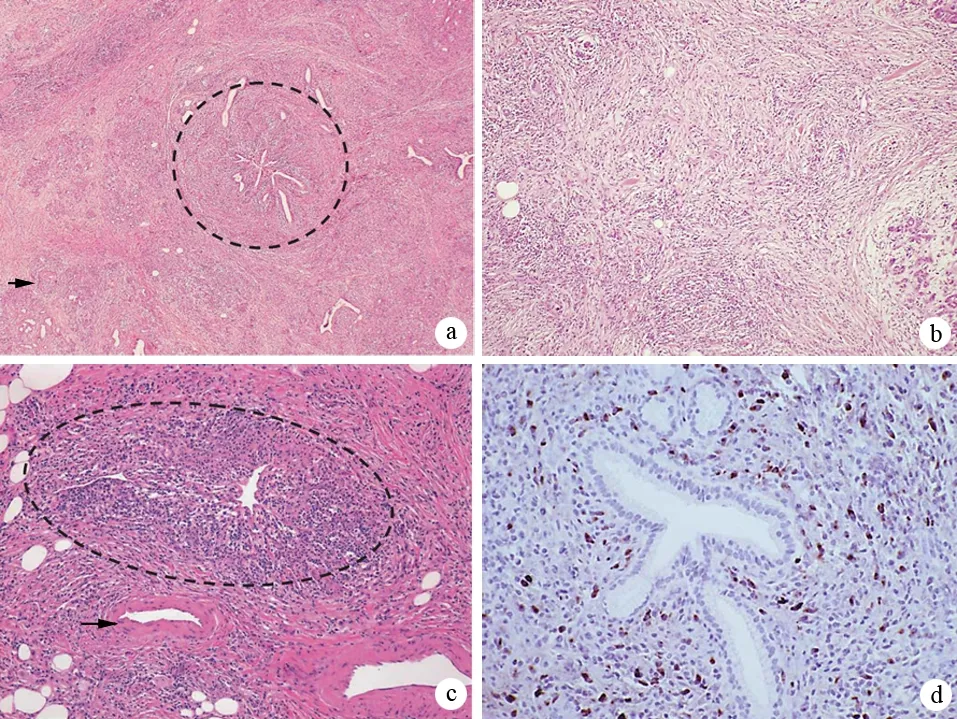
圖21型AIP典型的組織病理學所見 a:低倍鏡下示LPSP改變:胰腺導管周圍顯著淋巴細胞、漿細胞浸潤(圓圈所示),伴席紋樣纖維化和閉塞性靜脈炎(箭頭所示);b:席紋樣纖維化表現:較短的膠原纖維在各個方向隨機分布,填充炎性細胞和成纖維細胞;c:閉塞性靜脈炎(圓圈所示),而附近的動脈沒有受累(箭頭所示);d:免疫組化顯示導管周圍大量IgG4陽性漿細胞(>30個/高倍視野)(Chari ST, et al. Pancreas, 2010)
五、臨床表現
1型和2型AIP的臨床表現既有相似之處,也存在不同。
1型AIP多見于中老年男性,平均發病年齡60歲,起病隱匿,臨床表現多樣,包括胰腺表現及胰腺外表現。
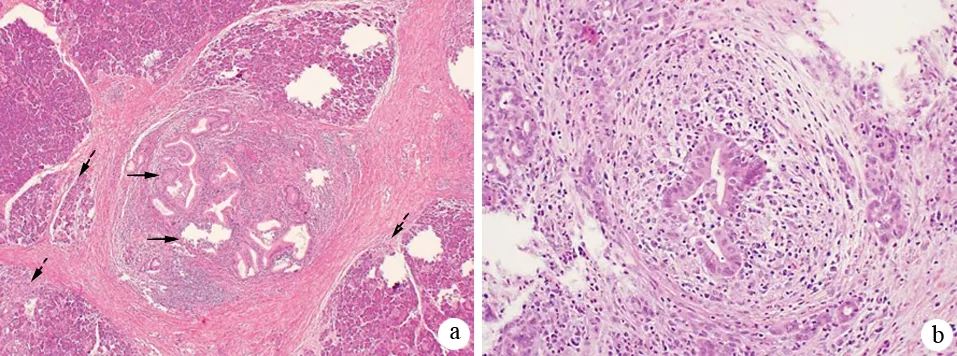
圖32型AIP典型的胰腺組織病理學所見 a:低倍鏡下顯示導管周圍淋巴細胞、漿細胞和中性粒細胞浸潤,伴有上皮內炎癥和小導管破壞(實箭頭)以及小葉內的淋巴細胞、漿細胞和中性粒細胞浸潤(虛箭頭),未見LPSP中顯著的席紋樣纖維化表現;b:粒細胞性上皮損害(GEL),導管周圍和上皮內中性粒細胞浸潤,破壞導管上皮,常形成微膿腫(Chari ST, et al. Pancreas, 2010)
(一)胰腺表現
約3/4患者出現梗阻性黃疸,多為輕中度,也可為重度,可呈進行性或間歇性;約1/3患者有體重減輕;約1/2患者可有糖尿病;約2/5患者有非特異性的輕度上腹痛或上腹不適,可向背部放射。這些臨床表現與胰腺癌相似。還有部分患者(約15%)表現為腹痛甚至是急性胰腺炎,或因體檢時發現胰腺腫大來就診。另外,患者可伴有腹瀉以及全身不適、乏力、惡心、嘔吐等非特異性癥狀,癥狀可持續數周至數月。體格檢查可有皮膚、鞏膜黃染,部分有上腹部輕壓痛,也可無陽性體征。
(二)胰腺外表現
AIP的胰腺外表現可與胰腺病變程度不平行,可在胰腺表現之前、同時或之后出現,患者可出現相應體征,體格檢查應予以重視。
1.硬化性膽管炎:即IgG4相關性膽管炎(IgG4-associated cholangitis,IAC)。膽管是最易受累的胰腺外器官,約60%~74%AIP患者伴有IAC,可出現梗阻性黃疸。膽總管胰腺段受累時,易被誤診為胰腺癌;肝門及肝內膽管受累時易被誤診為PSC。
2.涎腺炎和淚腺炎:亞洲人多見,可表現為涎腺或淚腺腫大,臨床癥狀與干燥綜合征相似。與干燥綜合征不同的是,AIP累及的涎腺或淚腺表現為大量IgG4陽性漿細胞浸潤,且很少出現血清抗SSA/SSB陽性,提示二者的發病機制不同。
3.腹膜后纖維化:AIP伴發腹膜后纖維化的比例為8%~16%。患者多無明顯臨床癥狀,少數患者因纖維組織壓迫大血管和輸尿管導致下肢水腫或腎積水。
4.淋巴結病:AIP可伴有腹腔、肺門及頸部等淋巴結腫大,表現為淋巴濾泡增生、免疫母細胞及漿細胞浸潤,IgG4+/IgG+比例高于其他原因引起的淋巴結腫大,但無典型的席紋狀纖維化及靜脈炎。該類患者血清血管緊張素轉化酶正常,沒有結節病的典型表現,大多數激素治療有效。
5.其他:AIP還可伴有間質性肺炎、腎小管間質性腎炎、眶周腫物、肝臟炎性假瘤等,表現相應臨床癥狀,激素療效明顯。
與1型AIP相比,2型AIP發病年齡更年輕(平均50歲左右)、男女比例無差異、腹痛及急性胰腺炎比例較高、胰腺外器官很少受累。20%~30%的2型AIP患者合并炎癥性腸病,尤其是潰瘍性結腸炎。
六、影像學
影像學檢查是診斷AIP的重要依據,常用檢查包括腹部超聲、計算機斷層掃描(CT)、核磁共振成像(MRI)、超聲內鏡(EUS)、內鏡下逆行性胰膽管造影術(ERCP)、正電子發射斷層顯像(PET)等。
(一)腹部超聲
彌漫性AIP的腹部超聲征象為胰腺彌漫性增大,呈“臘腸樣”,回聲減低,伴有散在斑點狀高回聲,胰腺周邊可伴有低回聲“包膜樣邊緣(capsule-like rim)”。局灶性AIP的腹部超聲征象為局部低回聲團塊,易與胰腺癌混淆。腹部超聲可作為AIP的初篩檢查,但診斷的敏感性不高。
(二)CT
彌漫性AIP的CT典型征象為胰腺彌漫性增大呈“臘腸樣”;胰腺實質密度降低,動態增強掃描可見均勻、延遲強化;部分患者胰周出現界限清晰、平整的低密度包膜樣邊緣,是AIP的特征性表現。局灶性AIP的典型征象為低密度腫塊,易與胰腺癌混淆;動態增強后腫塊可出現延遲、均質強化,有助于與胰腺癌鑒別。AIP少見胰管擴張、胰管結石和假性囊腫等一般CP的CT征象(圖4)。
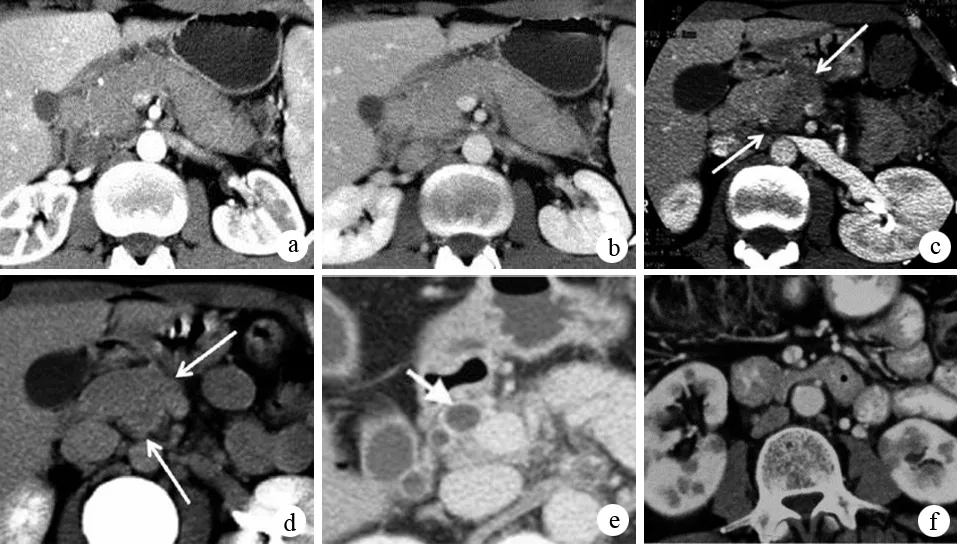
圖4AIP在CT征象 a、b:胰腺彌漫性增大,呈臘腸樣改變,增強早期僅輕度強化(a),延遲期明顯強化(b),胰周有低密度包膜樣邊緣;c、d:局灶性AIP表現為胰頭低密度腫塊,在增強早期僅輕度強化(c),延遲期明顯強化(d);e:膽總管擴張,管壁明顯增厚;f:兩腎皮質多發楔形低強化病灶,為AIP合并腎小管間質性腎炎表現(Takahashi N, et al. Radiology, 2007; Sahani DV, et al. Radiology, 2009)
(三)MRI和MRCP
MRI T1加權顯示胰腺彌漫增大或局灶性腫塊,呈略低信號,T2加權呈稍高信號,可見胰周低信號包膜樣邊緣;MRI動態增強掃描動脈期無強化或輕度強化,門脈期或延遲期出現強化(圖5)。典型MRCP征象為主胰管較長、多發的不規則狹窄,可伴有膽管狹窄,呈硬化性膽管炎表現。MRCP對胰管成像的準確性尚不及ERCP。有研究認為,MRI與CT對AIP胰腺形態改變具有同等價值,但對早期灌注降低、胰周包膜樣邊緣、胰管不規則狹窄、膽管受累等征象,MRI優于CT。
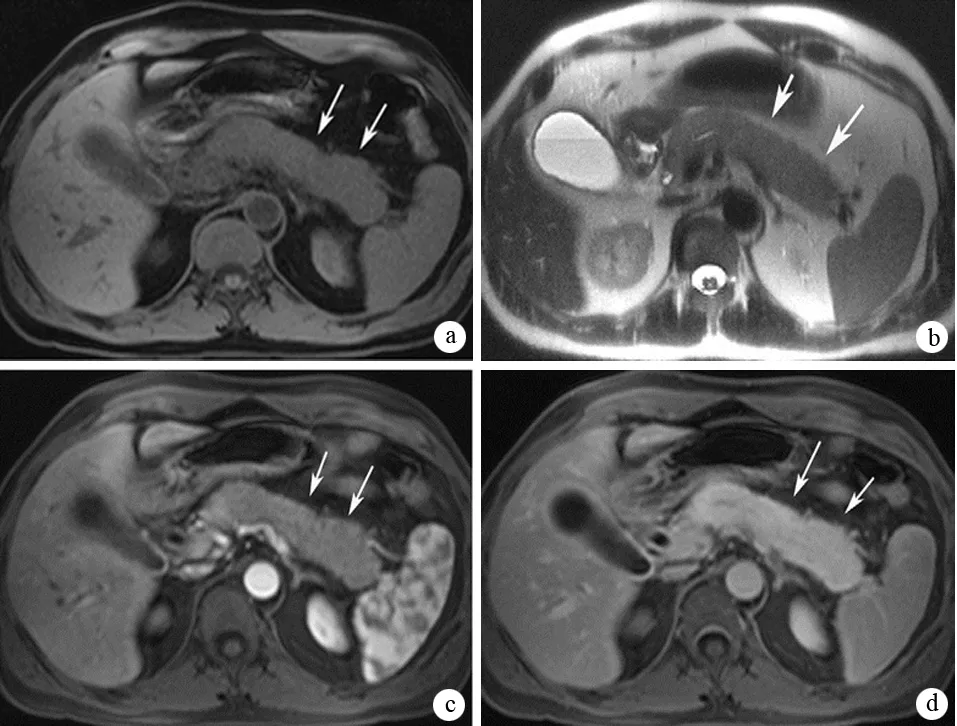
圖5AIP的MRI征象 a:T1加權見臘腸樣胰腺,較肝臟、脾臟呈低信號,正常小葉結構消失;b:T2加權見胰腺較肝臟高信號,與脾臟等信號;c、d:動態增強MRI顯示胰腺實質延遲增強(Manfredi R, et al. 2011, Radiology)
(四)EUS及IDUS
EUS可較好地觀察胰腺實質和胰、膽管,并可獲取細胞學或組織學標本,對AIP的診斷和鑒別診斷具有重要價值。EUS主要征象為胰腺彌漫性增大或局部腫塊,多呈低回聲伴內部高回聲光點,邊緣呈波浪樣改變,可見“導管穿透征”;膽管受累者呈管壁增厚、回聲減低,可有內外高回聲、中間低回聲的“三明治狀”征象;部分患者可見胰周淋巴結腫大(圖6)。近年來,造影增強EUS的應用逐漸廣泛,AIP患者注射聲學造影劑后可見胰腺腫塊均勻的血流信號增強,具有一定的診斷價值。EUS-FNA細胞學檢查有助于AIP與胰腺癌的鑒別診斷,但FNA所得標本量少,難以做出AIP的組織病理學診斷。Trucut針穿刺更有助于組織病理學診斷。IDUS主要征象為受累膽管壁呈均勻的、同心圓性增厚,外層光滑。
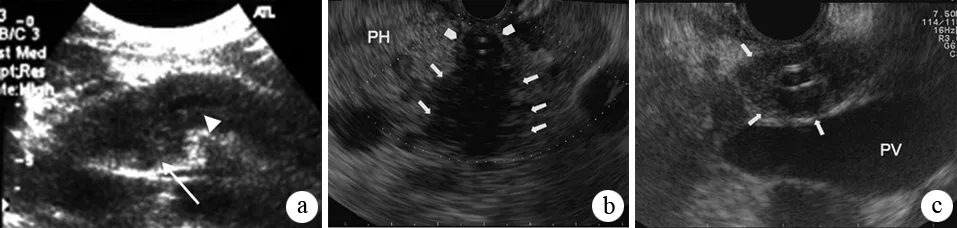
圖6AIP的典型EUS征象 a:長箭頭顯示胰頭低回聲腫塊,短箭頭顯示主胰管穿透腫塊;b:長箭頭顯示胰腺低回聲腫塊,短箭頭顯示增厚的膽總管;c:增厚的膽總管呈內外高回聲、中間低回聲的“三明治狀”(Ohtsubo K, et al. J Pancreas, 2008; Buscarini E, et al. Dig Liver Dis, 2010)
(五)ERCP
ERCP典型征象為胰管纖細和狹窄(>1/3全長)、狹窄胰管的近端(upstream)無顯著擴張(<5 mm)、胰管可呈多處狹窄、狹窄段可見分支胰管等(圖7)。累及膽管者可見膽管不同水平狹窄,少數患者呈PSC樣表現。
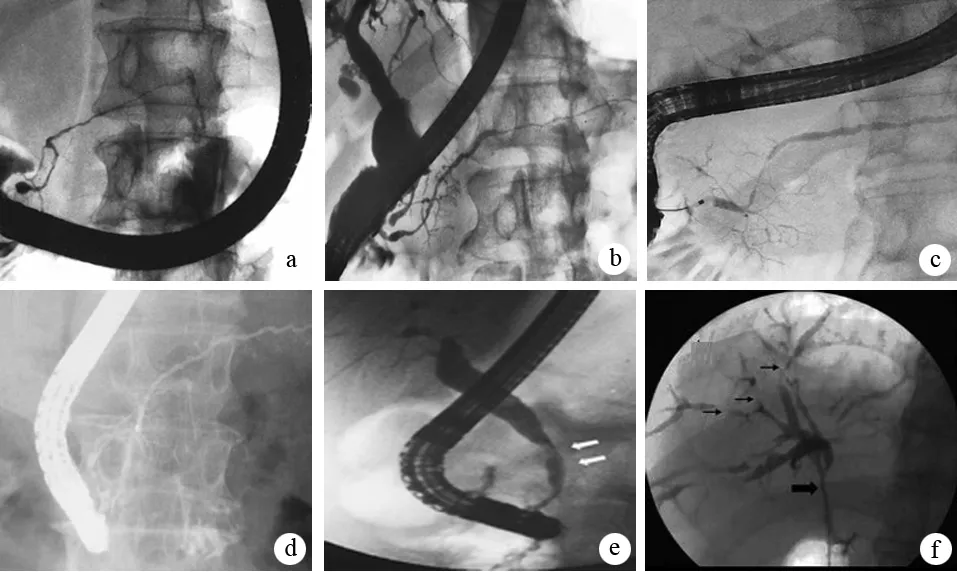
圖7AIP在ERCP下的表現 a:顯示典型的主胰管彌漫性、不規則狹窄;b:顯示主胰管多發性、節段性狹窄;c:顯示主胰管局灶性狹窄;d:顯示主胰管彌漫性狹窄及膽總管下段狹窄;e:膽總管中下段狹窄;f:粗箭頭顯示肝門部膽管狹窄,細箭頭顯示肝內膽管多發節段性狹窄 (Okazaki K, et al. J Gastroenterol, 2010;Buscarini E, et al. Dig Liver Dis, 2010;Law R, et al. Cleve Clin J Med, 2009.)
(六)PET
PET能夠反映病變器官的代謝情況,對AIP的診斷價值日益受到重視。AIP的典型代謝表現為胰腺彌漫性攝取增高(圖8),部分患者可見涎腺、下頜下腺、腎臟等胰腺外攝取增高病灶,有助于與胰腺癌鑒別。激素治療后,胰腺及胰腺外病灶的攝取程度顯著降低,與臨床癥狀和其他影像學表現一致。
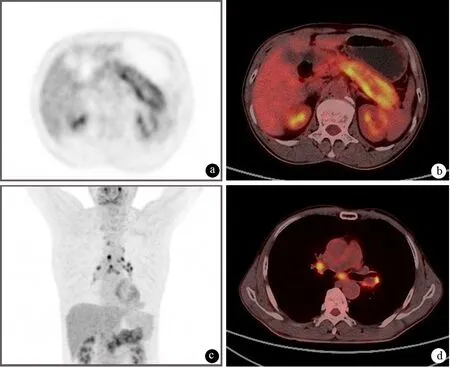
圖81型AIP的PET及PET-CT征象 a、b:可見胰腺彌漫性攝取增加;c、d:可見縱隔多發淋巴結攝取增高(上海長海醫院提供)
七、實驗室檢查
AIP的實驗室檢查主要包括以下幾方面:
(一)高γ-球蛋白血癥及高IgG4血癥
1型AIP患者常有血清γ-球蛋白、總IgG尤其是IgG4水平升高。血清IgG4升高是AIP患者的特征性表現,不同研究報道IgG4敏感性為50%~90%;以IgG4高于正常值上限2倍作為AIP診斷依據,其準確性>95%。但值得注意的是,IgG4升高并非AIP特有,約7%~10%胰腺癌患者和>10%膽管癌患者血清IgG4水平也可升高;且由于AIP發病率遠低于胰腺癌,血清IgG4對診斷AIP的陽性預測值很低,僅有血清IgG4水平升高不足以診斷AIP。
(二)自身抗體陽性
40%~50%的1型AIP患者自身抗體陽性,主要為抗轉鐵蛋白抗體(ALF)、抗碳酸酐酶Ⅱ抗體(ACA-Ⅱ)。這兩種抗體被認為具有一定的器官特異性,前者來源于胰腺腺泡細胞,后者來源于導管上皮,兩者診斷AIP的敏感性均超過50%,但目前尚未廣泛應用于臨床。此外,還可有抗核抗體(ANA)、類風濕因子(RF)陽性,而抗線粒體抗體(AMA)、抗SS-A抗體、抗SS-B抗體、抗平滑肌抗體(ASMA)等陽性率則很低。2型AIP患者自身免疫抗體多為陰性。
(三)肝功能異常
胰腺腫大壓迫膽管或伴有IAC時,可出現以直接膽紅素為主的血清總膽紅素升高,伴不同程度的轉氨酶升高。
(四)血清胰腺酶學改變
有報道66%患者血清脂肪酶升高,多為輕度,18.7%患者血淀粉酶一過性升高。
(五)胰腺內、外分泌功能異常
有報道18.6%AIP患者在發病前血糖升高,28.7%在發病時升高;72%患者BT-PABA降低。
(六)其他
部分患者出現血沉增快或CRP、IgE、CA19-9等指標升高,CA19-9甚至可高于1000 U/ml。激素治療后通常可下降。
八、診斷
AIP無特異性臨床表現,需與胰腺癌、CP鑒別,應結合影像學、實驗室檢查、胰腺外器官受累、病理學和激素療效做出診斷。2002年,日本胰腺學會首先提出AIP診斷標準,此后韓國、美國等也相繼推出診斷標準。2010年,國際胰腺學會整合各國對AIP的診斷意見,發布AIP診斷標準國際共識。診斷標準的變化反映了對AIP認識和研究的演變史,也為AIP的臨床診治提供了更為明確的依據。
AIP診斷標準國際共識中,診斷依據包括影像學(細分為胰腺實質影像學和胰管影像學)、血清學、胰腺外器官受累、組織病理學和診斷性激素治療等5個方面。這一共識最突出的特點是強調了胰腺實質影像學檢查(CT/MRI)在AIP診斷中的首要地位,其次是對各診斷依據進行分級和組合(診斷性激素治療除外)。該共識中實驗室檢查指標僅有IgG4一項,與之前部分指南有所區別;評價診斷性激素治療效果的指標主要依靠影像學,實驗室檢查指標不再作為監測指標(表2、3)。

表2 國際共識中1型AIP診斷證據分級
注:*:診斷性激素治療必須在包括EUS-FNA等手段除外胰腺癌的前提下謹慎實施;☆:部分AIP患者表現有低密度占位、胰管擴張或胰腺遠端萎縮,梗阻性黃疸和(或)胰腺占位患者有上述不典型表現高度提示胰腺癌,應先按照胰腺癌處理,除非有強烈提示AIP的其他征象并完全排除胰腺癌;★:內鏡下十二指腸乳頭活檢有一定診斷價值,壺腹常在AIP時受累

表3 國際共識中1型AIP的診斷標準
根據AIP診斷標準國際共識,對AIP的診斷應從影像學檢查開始。如患者有典型的影像學征象,且有實驗室檢查或胰腺外受累證據,即可診斷為AIP,可行激素治療。如影像學不典型,需除外胰腺癌,再結合實驗室檢查、組織病理學證據做出診斷。如行診斷性激素治療,必須除外胰腺癌,療程不長于2周;復查影像學提示胰腺或胰腺外病變明顯好轉者支持AIP診斷。診斷流程如圖9所示。
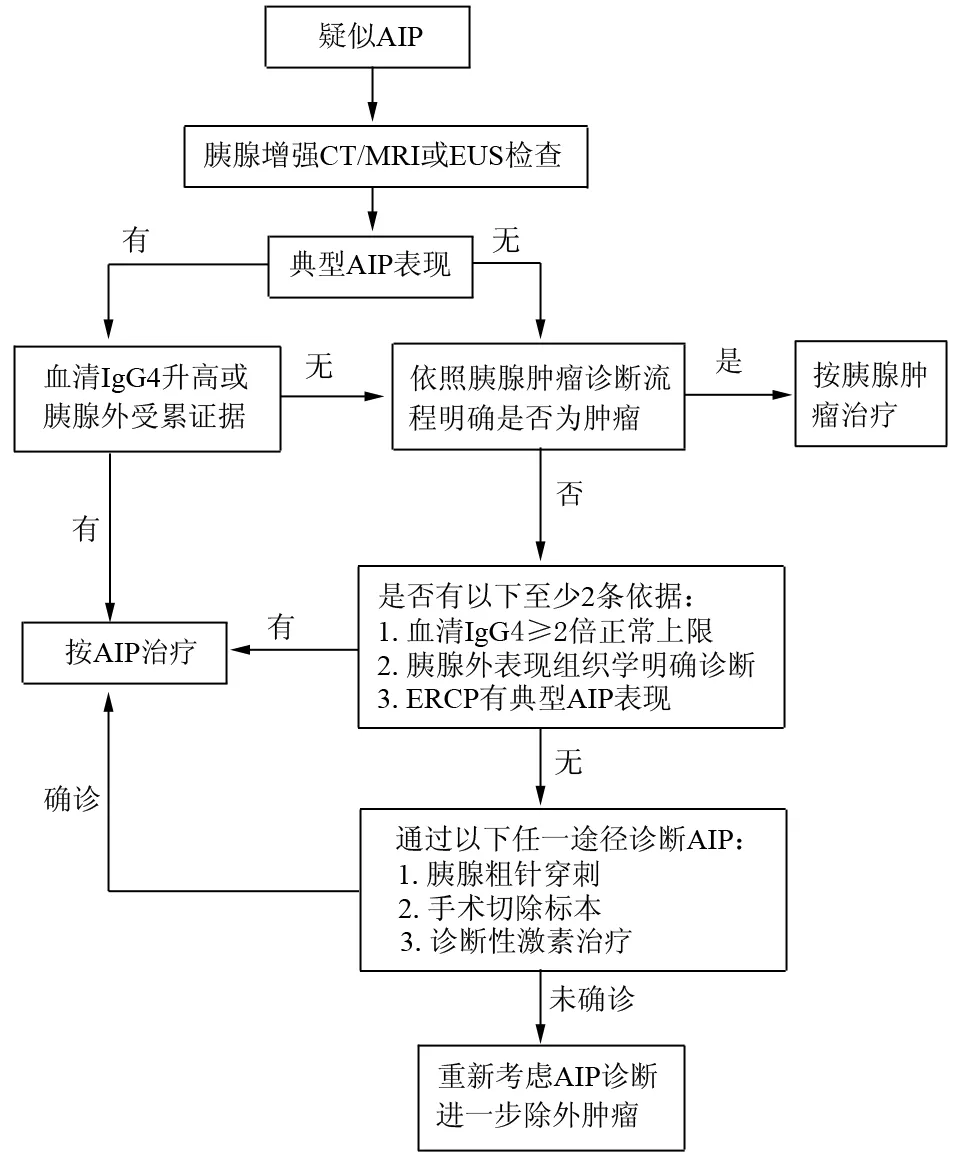
圖9 AIP診斷國際共識的診斷流程
九、鑒別診斷
(一)胰腺癌
AIP(尤其是局灶性AIP)與胰腺癌的臨床表現相似,均可出現梗阻性黃疸、體重下降、輕度腹部不適等,且AIP發病率遠低于胰腺癌,因此臨床診斷AIP需首先排除胰腺癌。兩者的鑒別需結合影像學、實驗室檢查、病理學及激素療效等。AIP可伴有胰腺外表現,如硬化性膽管炎、涎腺炎、淚腺炎等;AIP的CT和MRI典型征象為胰腺邊緣光滑、可有包膜樣邊緣,而胰腺癌一般輪廓不規則,無包膜樣邊緣;AIP的動態增強CT顯示胰腺病變延遲、均勻強化,而胰腺癌動態增強后多表現為不均勻、低強化腫塊;AIP的ERCP典型征象為主胰管彌漫性、節段性或局灶性纖細和狹窄,管壁不規則,狹窄段近端胰管無顯著擴張,而胰腺癌則表現為主胰管突然截斷伴近端胰管擴張;AIP血清IgG4水平的升高較胰腺癌更常見,尤其是IgG4高于正常上限2倍時。影像學表現不典型的患者,應考慮EUS-FNA等方法獲取病理學標本進一步鑒別。美國Mayo醫學中心提出AIP與胰腺癌的鑒別診斷流程(圖10),可作為兩種疾病臨床鑒別的參考。
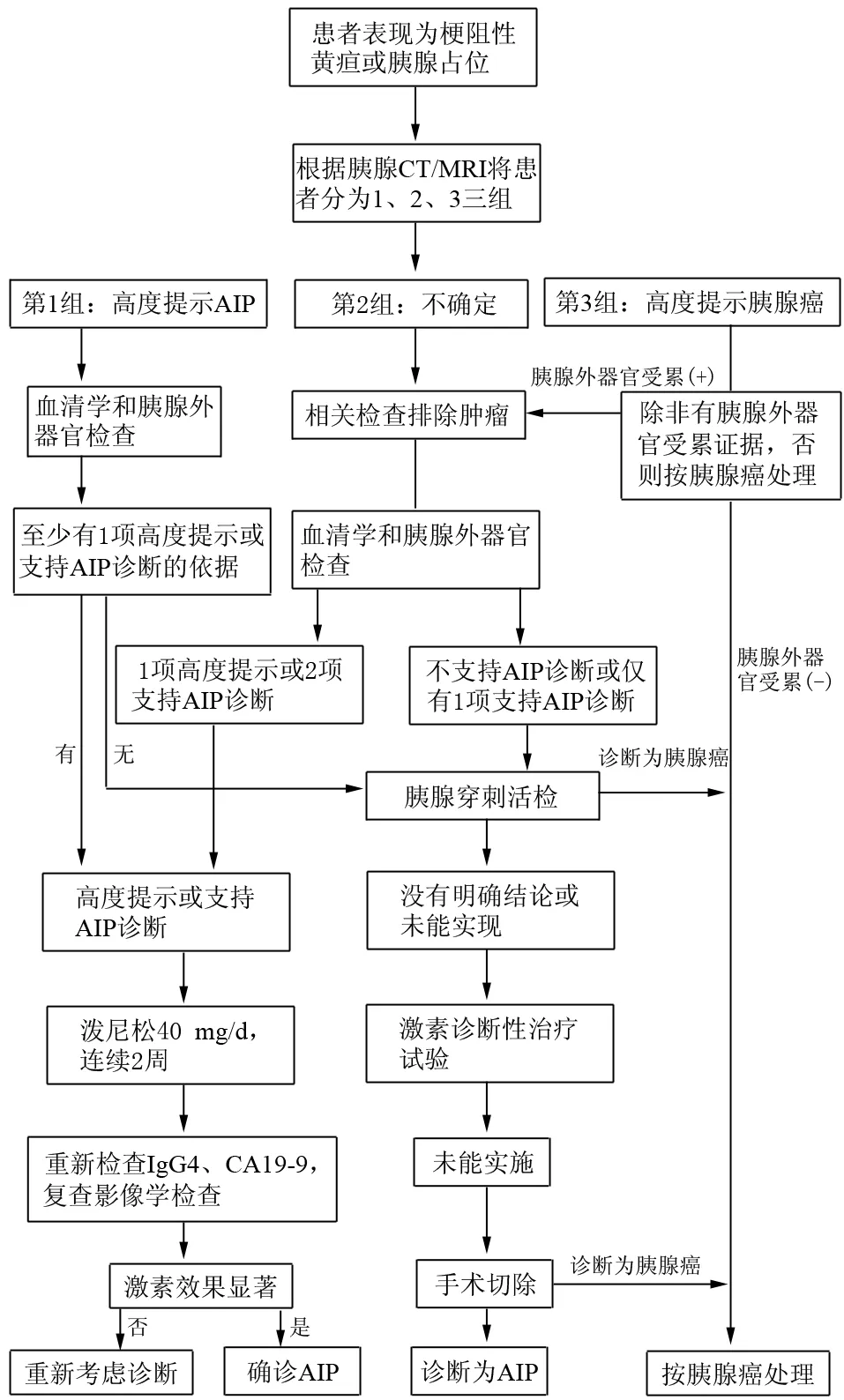
圖10 美國Mayo醫院AIP與胰腺癌鑒別診斷策略
(二)PSC
AIP伴發的IAC影像學表現與PSC相似,但PSC較常見膽管帶狀、串珠樣或截枝樣狹窄,而IAC較常見末端膽管狹窄、節段性、長型狹窄合并近段膽管擴張。且IAC患者一般年齡較大,激素治療效果好。
(三)膽管癌
部分AIP伴發的IAC需與膽管癌鑒別。膽管內超聲(intraductal ultrasonography,IDUS)在兩者的鑒別中具有重要作用,IAC的典型征象為膽管壁呈均勻、同心圓性增厚,而膽管癌則呈不均勻低回聲團塊。血清IgG4、自身抗體及腫瘤標記物檢測也有助于鑒別。
(四)酒精性慢性胰腺炎(alcohol chronic pancreatitis,ACP)
ACP患者一般年齡較輕,臨床癥狀較重,主胰管明顯擴張、胰腺實質萎縮,常伴胰腺鈣化、結石、假性囊腫,自身抗體多陰性,血清球蛋白、IgG4多正常。
(五)胰腺炎性假瘤
多發生于胰頭部,表現為胰頭部局灶性包塊,需與局灶性AIP相鑒別。炎性假瘤多見于中年男性,多有典型的胰腺炎癥狀,自身抗體陰性,CT常可發現假性囊腫或胰周滲出。
十、治療
AIP的治療以口服激素為主。如激素療效不佳,首先需要考慮診斷是否正確,然后可換用或聯用免疫調節劑乃至利妥昔單抗。對胰腺內、外分泌功能不全者應給予相應治療。已經確診的AIP患者無需常規進行ERCP,對診斷不明確或黃疸較重患者可考慮內鏡介入治療。
(一)口服激素治療
盡管有少部分AIP患者可自行緩解,但目前仍公認口服糖皮質激素是AIP的首選治療方法。激素治療可進一步證實診斷、緩解梗阻性黃疸等癥狀、改善組織結構異常、在急性期改善胰腺內外分泌功能。一般采取口服潑尼松30~40 mg/d,或按照0.6 mg·kg-1·d-1選擇劑量。起始劑量治療2~4周后,應結合臨床癥狀、影像學和實驗室檢查進行綜合評價,如效果較好可逐漸減量,以每1~2周減少5 mg為宜,再根據臨床表現采用5 mg/d劑量維持或停藥。小劑量激素維持治療可減少復發,但不能避免復發,有報道在維持治療或停藥后復發率為17%~24%。美國Mayo醫學中心對AIP激素治療后復發的處理流程見圖11。
(二)免疫調節劑和利妥昔單抗
硫唑嘌呤(AZA)、6-巰基嘌呤(6-MP)或霉酚酸酯(MMF)等免疫調節劑可用于激素治療無效的患者。初步研究表明,利妥昔單抗(RTX)對激素和免疫調節劑抵抗的AIP患者效果良好。
(三)熊去氧膽酸
國內外有研究報道給予熊去氧膽酸治療AIP患者,并發的糖尿病、肝功能損害明顯改善,胰腺體積減小。但其治療機制尚不明確,且臨床應用報道尚少,其價值需進一步研究。
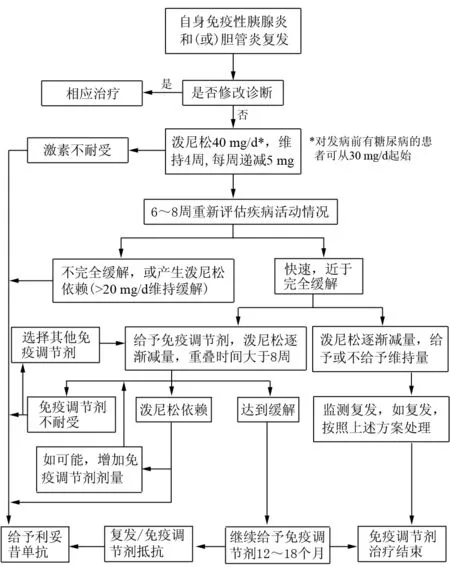
圖11 美國Mayo醫院對AIP激素治療后復發的處理原則
(四)內鏡介入治療
已經確診的AIP患者無需常規進行ERCP。診斷不明確或黃疸較重患者可考慮內鏡介入治療;也有觀點認為激素可迅速降低黃疸,無需積極行ERCP干預。對激素治療風險較大的患者,可首先行內鏡介入治療緩解黃疸。
(五)外科治療
AIP患者不建議手術治療,當臨床難以排除惡性腫瘤時可考慮手術。
十一、隨訪與預后
對AIP患者的隨訪應關注其臨床癥狀和影像學變化以及藥物不良反應。長期服用激素和聯用免疫調節劑者需監測血常規、血糖和肝功能。
1型AIP復發率較高,約20%~40%的患者初次激素治療停藥后可能復發,復發后仍可給予激素或聯用/換用免疫調節劑和單抗類藥物。2型AIP少有復發。部分AIP病程可呈自限性,病程反復者可形成結石。雖有進展或合并胰腺癌的個案報道,但AIP與胰腺癌之間的相關性還不明確。建議對病程較長的AIP患者按時隨訪。
參加本指南修訂的專家(按姓氏筆劃排序)
王興鵬(上海第一人民醫院消化科)
鄧安梅(第二軍醫大學長海醫院實驗檢驗科)
呂農華(南昌大學第一附屬醫院消化內科)
任 旭(黑龍江省醫院消化內科)
李兆申(第二軍醫大學長海醫院消化內科)
李 汛(蘭州大學第一醫院普外科)
楊愛明(北京協和醫院消化內科)
趙東寶(第二軍醫大學長海醫院風濕免疫科)
陸建平(第二軍醫大學長海醫院影像醫學科)
鄒多武(第二軍醫大學長海醫院消化內科)
金 鋼(第二軍醫大學長海醫院普外科)
金震東(第二軍醫大學長海醫院消化內科)
鄭建明(第二軍醫大學長海醫院病理科)
郭學剛(第四軍醫大學西京醫院消化內科)
袁耀宗(上海瑞金醫院消化內科)
錢家鳴(北京協和醫院消化內科)
麻樹人(沈陽軍區總醫院內窺鏡科)
屠振興(中華胰腺病雜志編輯部)
靳大勇(上海市中山醫院普外科)
廖 專(第二軍醫大學長海醫院消化內科)
[1] Shimosegawa T, Chari ST, Frulloni L, et al. International consensus diagnostic criteria for autoimmune pancreatitis: guidelines of the International Association of Pancreatology. Pancreas,2011,40:352-358.
[2] Chari ST, Kloeppel G, Zhang L, et al. Histopathologic and clinical subtypes of autoimmune pancreatitis: the Honolulu consensus document. Pancreatology, 2010,10:664-672.
[3] Chari ST. Diagnosis of autoimmune pancreatitis using its five cardinal features: introducing the Mayo Clinic′s HISORt criteria. J Gastroenterol, 2007,42 Suppl 18:39-41.
[4] Kim KP, Kim MH, Kim JC, et al. Diagnostic criteria for autoimmune chronic pancreatitis revisited. World J Gastroenterol, 2006, 12:2487-2496.
[5] Otsuki M, Chung JB, Okazaki K, et al. Asian diagnostic criteria for autoimmune pancreatitis: consensus of the Japan-Korea Symposium on Autoimmune Pancreatitis. J Gastroenterol, 2008,43:403-408.
[6] Sah RP, Chari ST, Pannala R, et al. Differences in clinical profile and relapse rate of type 1 versus type 2 autoimmune pancreatitis. Gastroenterology, 2010,139:140-148.
[7] Kanno A, Nishimori I, Masamune A, et al. Nationwide Epidemiological Survey of Autoimmune Pancreatitis in Japan. Pancreas, 2012,41:835-839.
[8] Kamisawa T, Shimosegawa T, Okazaki K, et al. Standard steroid treatment for autoimmune pancreatitis. Gut,2009,58:1504-1507.
[9] Finkelberg DL, Sahani D, Deshpande V, et al. Autoimmune pancreatitis. N Engl J Med, 2006, 355: 2670-2676.
[10] Seleznik GM, Reding T, Romrig F, et al. Lymphotoxin β receptor signaling promotes development of autoimmune pancreatitis. Gastroenterology, 2012, 143:1361-1374.
[11] Manfredi R, Frulloni L, Mantovani W, et al.Autoimmune pancreatitis: pancreatic and extrapancreatic MR imaging-MR cholangiopancreatography findings at diagnosis, after steroid therapy, and at recurrence. Radiology, 2011, 260: 428-436.
[12] Sahani DV, Sainani NI, Deshpande V, et al. Autoimmune pancreatitis: disease evolution, staging, response assessment, and CT features that predict response to corticosteroid therapy. Radiology, 2009, 250:118-129.
[13] 辛磊,彭國林,廖專,等.中國自身免疫性胰腺炎臨床特征分析:單中心81例總結.中華胰腺病學雜志,2012,12:294-298.
[14] Song Y, Liu QD, Zhou NX, et al. Diagnosis and management of autoimmune pancreatitis: experience from China. World J Gastroenterol, 2008,14:601-606.
[15] 丁輝, 錢家鳴, 呂紅, 等. 自身免疫性胰腺炎激素治療的療效及預后研究. 中華消化雜志, 2010, 30:721-724.
[16] Zhang X, Zhang X, Li W, et al. Clinical analysis of 36 cases of autoimmune pancreatitis in china. PLoS One, 2012,7:e44808.
[17] 吳晰, 楊愛明, 錢家鳴, 等. 自身免疫性胰腺炎的內鏡超聲表現. 中華消化內鏡雜志, 2008,25:134-137.
10.3760/cma.j.issn.1674-1935.2012.06.017
李兆申,上海第二軍醫大學長海醫院消化內科,200433
Email:zhsli81890.net
2012-10-28)
(本文編輯:呂芳萍)

