自制與進口鹽酸左西替利嗪片溶出度比較
李 鶯,吳 燕,劉麗平,郭雙艷
(中國人民解放軍空軍總醫院,北京 100142)
鹽酸左西替利嗪為口服選擇性組胺H1受體拮抗劑,主要用于緩解變態反應性疾病的過敏癥狀,臨床上用于治療變應性鼻炎、蕁麻疹、血管神經性水腫等皮膚黏膜過敏性疾病。目前,溶出度考察一般采用單點控制方法[1],很難真正控制藥品的內在質量。為了更好地考察自制片劑與進口片劑的質量一致性,本試驗通過 f2因子比較法評價鹽酸左西替利嗪自制片與進口片體外溶出度曲線的相似性,為處方工藝優化提供依據。
1 儀器與試藥
ZRS-8G型智能溶出試驗儀(天津天大天發科技有限公司);UV-2401型紫外分光光度計(日本島津);BT125D電子天平(北京賽多利斯儀器系統有限公司);KQ-300DE型數控超聲波清洗器(昆山市超聲儀器有限公司);Spin215微型高速離心機(北京東迅天地醫療儀器有限公司)。鹽酸左西替利嗪對照品(中國藥品生物制品檢定所,批號為100659-200401);鹽酸左西替利嗪自制咀嚼片(空軍總醫院藥學部制劑研究室,批號為20110901,20110903,20110905,規格5 mg);鹽酸左西替利嗪進口片(批號為8231,規格5 mg);鹽酸、冰醋酸、醋酸鈉、磷酸二氫鉀、磷酸氫二鈉、無水乙酸鈉、氫氧化鈉均為分析純,蒸餾水(空軍總醫院自制)。
2 方法與結果
2.1 溶出條件確定
依據2010年版《中華人民共和國藥典(二部)》標準及參照日本《醫療用藥品品質情報集》中溶出度試驗條件推薦使用的4種溶劑分別測定。取本品,照溶出度測定法[2010年版《中華人民共和國藥典(二部)》附錄ⅩC],方法為槳法,轉速為50 r/min,分別以水、0.1 mol/L的鹽酸、pH=4.0的醋酸鹽緩沖液、pH=6.8的磷酸鹽緩沖液為溶出介質,溫度為37℃,取樣點分別為5,10,15,20,30,45 min,取溶出液 10 mL,并立即補加同溫度溶出介質10 mL,溶出液用0.45μm微孔濾膜濾過,取續濾液作為供試品溶液;另精密稱取105℃干燥至恒重的鹽酸左西替利嗪對照品10 mg于200 mL量瓶中,加溶出介質溶解并定容至刻度,搖勻,作為對照品貯備液;另分別精密量取貯備液1 mL至10 mL量瓶中,加溶出介質稀釋至刻度,搖勻,制成質量濃度為5μg/mL的對照品溶液。
2.2 測定方法建立
取鹽酸左西替利嗪對照品適量,加溶出介質稀釋至刻度,搖勻,配制成鹽酸左西替利嗪質量濃度為5μg/mL的溶液,在200~400 nm波長范圍內進行全波長掃描,結果鹽酸左西替利嗪在各溶出介質下230 nm波長處有最大吸收;另稱取處方比例的輔料(采用4種溶劑分別制備),經紫外吸收圖譜掃描可看出,各溶出介質條件下輔料溶液在本品的最大吸收波長230 nm處無紫外吸收,對鹽酸左西替利嗪的定量測定無影響。
2.3 方法學考察
標準曲線制備:精密稱取105℃干燥至恒重的鹽酸左西替利嗪對照品10 mg,置200 mL容量瓶中,分別加溶出介質稀釋至刻度,搖勻,配制成質量濃度為50μg/mL的對照品貯備液,再分別用溶出介質逐級稀釋成 1.0,2.0,3.0,4.0,5.0,6.0,7.0 μg/mL的溶液,在230 nm波長處分別測定其吸光度值。結果見表1,表明各條件下線性關系均良好。

表1 標準曲線試驗結果
精密度試驗:量取用各溶出介質稀釋制成5μg/mL的對照品溶液,在230 nm波長處測定吸光度,平行測定6次。結果各條件下的 RSD分別為 0.65%(水),0.94%(0.1 mol/L鹽酸),0.13%(pH=4.0醋酸鹽緩沖液),0.56%(pH=6.8磷酸鹽緩沖液)。
加樣回收試驗:按處方比例稱取輔料量,分別加入該處方量對應的50%,80%,100%量的鹽酸左西替利嗪對照品,加溶出介質稀釋至刻度,搖勻,濾過,取續濾液作為供試品溶液;另精密稱取鹽酸左西替利嗪對照品適量,用溶出介質稀釋成5μg/mL的溶液作為對照品溶液。取供試品和對照品溶液分別進行測定。結果見表2,表明各溶出介質中回收率試驗結果均良好。
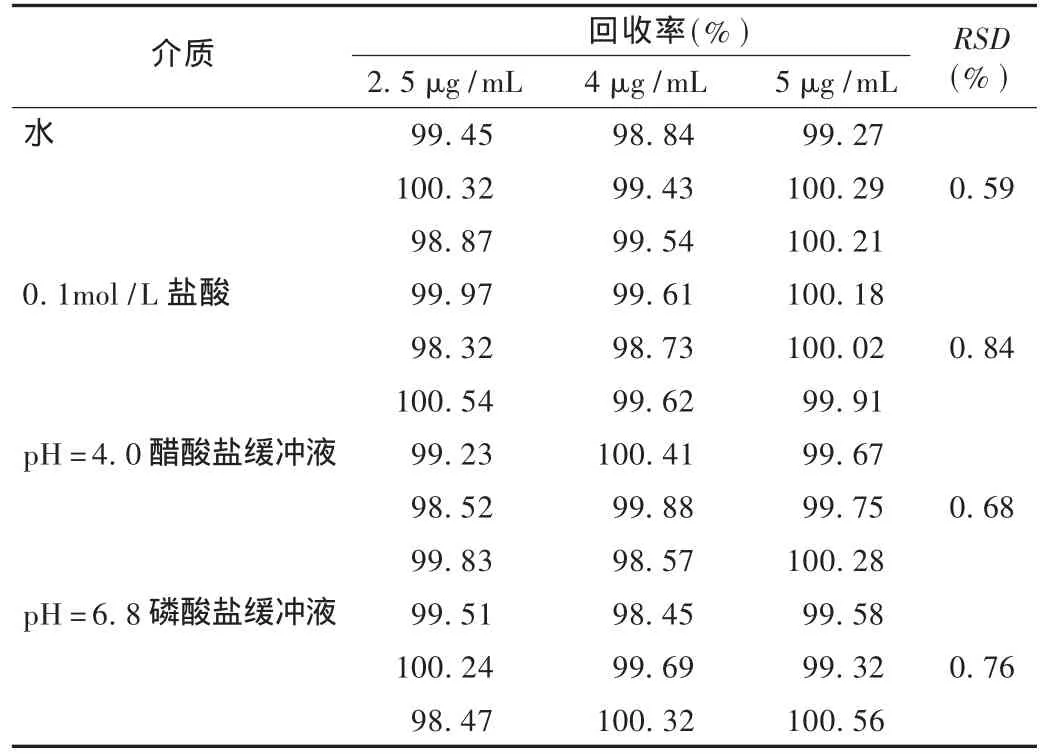
表2 鹽酸左西替利嗪在不同溶出介質中回收率試驗結果
2.4 樣品溶出度測定
取3批鹽酸左西替利嗪自制咀嚼片及進口片,分別測定4種溶出介質條件下不同時間的溶出百分率,溶出曲線見圖1。
2.5 溶出曲線相似性比較(f2因子法)
將鹽酸左西替利嗪咀嚼片自制片3個批號的溶出曲線與進口片溶出曲線按下列公式分別進行相似性比較。

其中 R t代表鹽酸左西替利嗪咀嚼片自制片在第t時間的平均累積釋放度,T t代表鹽酸左西替利嗪進口片在第t時間的平均累積釋放度,n代表測試點數(n=6)。結果見表3。可見,3個批號的自制片與進口片相比較,f2均大于50,溶出曲線相似,且3個批號之間相似性無明顯差異,表明處方工藝合理,生產工藝可靠。
3 討論

表3 鹽酸左西替利嗪咀嚼片自制片與進口片 f2因子比較
f2因子法是美國食品與藥物管理局(FDA)推薦使用定量比較試驗制劑與參比制劑溶出性質的差異的方法,描述制劑體外溶出曲線相似性的非模型依賴方法。該方法可判斷不同處方對藥物釋放的影響程度,從而篩選出與進口片溶出性能優異的產品的相似處方,為新藥申報注冊的生物等效性試驗做前瞻性預測。f2大于50時即可認為曲線相似,f2越大表明曲線越相似[2-4]。
本試驗結果表明,自制片與進口片溶出曲線具有一致性,在一定程度上反映了自制制劑與對照制劑的處方工藝的一致性。目前,我國藥品申報中仿制藥申請占據了較大比例,保證仿制藥品與上市藥品具有質量等同性,是仿制藥研究應該遵循的基本原則[5],仿制研究時應進行多層面的質量對比研究,其中溶出度對比研究是工藝處方篩選的重要依據之一。同時,本試驗還可為建立體內外相關性提供基礎數據。
[1]李 麗,周振旗.影響藥物制劑溶出度實驗的因素[J].西北藥學雜志,2010,25(6):479-480.
[2]裘國麗,黃 華,王 也.不同廠家阿莫西林膠囊實時溶出度的比較[J].中國醫院藥學雜志,2010,30(23):2 041-2 043.
[3]金 麗,張曉丹,古卓良,等.國產與進口尼莫地平片的溶出度考察[J].中國藥房,2011,22(17):1 602-1 603.
[4]蔣 晨,張先華,徐 霞,等.硫酸氫氯吡格雷片劑的體外溶出度測定[J].華西藥學雜志,2010,25(5):580-582.
[5]李芳美.影響片劑溶出度的因素探討[J].廣東藥學,2005,15(5):19.

