脂氧素A4抑制內毒素誘導的人支氣管上皮細胞環氧合酶2及前列腺素E2的表達*
朱天琦, 鄭聲星, 金勝威
(溫州醫學院1附屬第一醫院麻醉科,2附屬第二醫院麻醉科,3附屬第二醫院ICU,浙江 溫州 325000)
1000-4718(2012)03-0478-05
2011-07-09
2011-12-09
國家自然科學基金資助資助項目(No.81070061);浙江省自然科學基金項目(No.Y2100885);浙江省衛生高層次創新人才培養項目
△通訊作者 Tel: 0577-88879006; E-mail: jinshengwei69@yahoo.com.cn
脂氧素A4抑制內毒素誘導的人支氣管上皮細胞環氧合酶2及前列腺素E2的表達*
朱天琦1, 鄭聲星2, 金勝威3△
(溫州醫學院1附屬第一醫院麻醉科,2附屬第二醫院麻醉科,3附屬第二醫院ICU,浙江 溫州 325000)
目的探討脂氧素A4對人支氣管上皮細胞(HBECs)環氧合酶2(COX-2)表達的影響。方法應用不同濃度(0.1、1、10 mg/L)的內毒素(LPS)刺激HBECs 9 h,或者用1 mg/L LPS分別刺激HBECs不同時點(3 h、6 h、9 h)后,測定HBECs的COX-2 mRNA表達和細胞上清液前列腺素E2(PGE2)水平。應用不同濃度 (0、100、400 μmol/L) 的脂氧素A4作用于經過LPS(1 mg/L)刺激培養9 h的HBECs,采用酶聯免疫吸附法(ELISA)檢測細胞上清液PGE2的水平, 同時分別應用RT-PCR和Western blotting分別檢測HBECs COX-2 mRNA及蛋白的表達。結果LPS刺激培養條件下HBECs的COX-2 mRNA表達及其上清液PGE2水平增加,并呈時間、劑量依賴性。脂氧素A4能抑制LPS刺激培養HBECs COX-2蛋白和mRNA的表達及上清液PGE2的水平,并呈劑量依賴性。結論脂氧素A4能抑制LPS誘導的HBECs COX-2表達及上清液PGE2的水平。
脂氧素A4; 人支氣管上皮細胞; 環氧合酶2; 脂多糖類
急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)是臨床常見危重病,其病死率達35%~58%[1],內毒素血癥引起的ARDS極為常見。傳統觀念認為急性炎癥效應細胞主要有白細胞及巨噬細胞等,目前越來越多證據表明人支氣管上皮細胞(human bronchial epithelial cells, HBECs)不僅作為構成外部環境與機體內環境相互作用的一道屏障,也可以作為急性炎癥效應細胞[2]。在呼吸道炎癥疾病中人支氣管上皮細胞能分泌炎癥介質及細胞因子如前列腺素E2(prostaglandin E2,PGE2)、白細胞介素-8(interleukin-8,IL-8)等,同時能表達環氧合酶2(cyclooxygenase 2,COX-2)[3]。COX-2 是合成前列腺素的關鍵限速酶, 在急性炎癥時受多種炎癥介質(如細胞因子)刺激而大量表達[3-4]。脂氧素(lipoxins, LXs)是一類重要的內源性脂質抗炎介質,是花生四烯酸(arachidonic acid, AA)的脂加氧酶(lipoxygenase)代謝產物, 由5-脂加氧酶(5-lipoxygenase)與15-脂加氧酶(15-lipoxygenase)或者由5-脂加氧酶(5-lipoxygenase)與12-脂加氧酶(12-lipoxygenase)作用而形成[5],主要通過跨細胞途徑來合成 ,在炎癥反應中發揮廣泛的抗炎促炎癥消退作用[6]。本文通過對人支氣管上皮細胞在內毒素直接刺激下其環氧合酶-2及PGE2表達和脂氧素A4(LXA4)對人支氣管上皮細胞COX-2及PGE2表達的影響進行研究,闡明脂氧素A4在抑制支氣管上皮細胞炎癥反應中的機制和作用。
材 料 和 方 法
1材料
1.1細胞株 人支氣管上皮細胞(武漢大學保藏中心)。
1.2主要試劑 新生牛血清、DMEM培養基均購自Gibco,脂多糖(lipopolysaccharide,LPS,E.coliserotype O55∶B5)及瓊脂糖(Sigma), Trizol( Invitrogen),逆轉錄試劑盒(Fermentas),TAG酶及dNTP (Tiangen),二乙基焦碳酸酯 (DEPC,武漢博士德生物工程有限公司), COX-2引物及陽性對照GAPDH引物(上海賽百盛基因技術有限公司合成),兔抗人COX-2抗體(Abcam),辣根酶標記山羊抗兔IgG(北京中杉公司),PGE2ELISA試劑盒(R&D), BCA蛋白定量試劑盒(Pierce)。
2方法
2.1細胞培養及實驗分組 人支氣管上皮細胞株常規培養于10%新生牛血清、青霉素1×105IU/L、鏈霉素1×105IU/L的 DMEM培養基,待細胞呈融合狀態時,無血清 DMEM培養基繼續培養24 h。實驗分4組: (1)正常對照組:不給予任何處理;(2)9 h LPS處理組:同一時點(9 h)給予不同濃度 LPS(0.1 mg/L、1 mg/L、10 mg/L);(3)1 mg/L LPS處理組:不同時點(3 h、6 h、9 h)給予同一濃度LPS(1 mg/L)刺激(3 h、6 h、9 h);(4)脂氧素A4及LPS處理組:給予不同濃度(0 μmol/L、100 μmol/L、400 μmol/L)脂氧素A4加上LPS(1 mg/L)刺激9 h。
2.2ELISA法檢測細胞上清液中PGE2的含量 LPS及脂氧素A4作用結束后收集細胞上清液,2 000 r/min離心 5 min后待測。按照R&D公司ELISA試劑盒說明書操作,檢測細胞上清液中PGE2的含量。
2.3半定量 RT- PCR檢測 COX-2 mRNA的表達 取不同實驗組的人支氣管上皮細胞,采用Trizol試劑,參照說明書對各實驗組細胞的總 RNA進行提取。取1 μg RNA逆轉錄合成 cDNA,其中1 μL cDNA為模板,擴增 COX-2。反應條件:94 ℃ 預變性5 min, 94 ℃ 45 s,56 ℃ 40 s,72 ℃ 3 min,35個循環,最后72 ℃ 7 min。取 5 μL擴增產物用1.5%瓊脂糖凝膠電泳,溴化乙啶 (EB) 顯色,目的條帶用圖像分析系統做灰度值測定,以GAPDH為內參照,COX-2與GAPDH灰度值比值作為COX-2 mRNA的相對含量進行半定量分析。COX-2的引物序列:上游引物5’-AAGCTGGGAAGCCTTCTCTA-3’,下游引物5’-TTTCCATCCTTGAAAAGGCGC-3’ ,擴增片段長度為342 bp。GAPDH的引物序列:上游引物 5’-ACCAGCCCCAGCAAGAGCACAAG-3’,下游引物5’- TTCAAGGGGTCTACATGGCAACTG -3’,擴增片段長度為123 bp,反應條件: 94 ℃ 預變性5 min,94 ℃ 45 s,56 ℃ 40 s,72 ℃ 3 min。
2.4Western blotting檢測COX-2蛋白的表達 取1 mg/L LPS合并不同濃度LXA4誘導培養9 h后的支氣管上皮細胞,加入適量細胞裂解液,冰上孵育 40 min,12 000 r/min離心20 min,上清液即為總蛋白,參照BCA蛋白定量試劑盒說明書測蛋白濃度。將總蛋白進行SDS PAGE凝膠電泳,然后電轉移至NC膜上。用5%脫脂牛奶對膜室溫封閉1 h,加入兔抗人COX-2和小鼠抗人β-actin多克隆抗體(COX-2以 1∶500稀釋,β-actin以 1∶2 000稀釋 ) 4 ℃搖動過夜。第2 d用 TBST于室溫下洗膜3次,每次15 min,接著加入辣根酶標記山羊抗兔IgG抗體(1∶2 000稀釋 )及山羊抗小鼠IgG抗體(1∶2 000稀釋 ),在室溫下輕輕搖動1 h,然后用TBST室溫下洗膜 3次,每次15 min。最后用化學發光法曝光顯跡,按化學發光顯影試劑盒 (ECL)說明要求加入ECL試劑,室溫下溫育 2 min后對 X線片曝光。
3統計學處理
結 果
1LPS刺激下人支氣管上皮細胞COX-2mRNA的表達及其上清液PGE2含量呈劑量、時間依賴關系
通過RT-PCR檢測發現,正常人支氣管上皮細胞中COX-2 mRNA有微量表達,LPS誘導后支氣管上皮細胞COX-2 mRNA表達增加,與對照組相比有差異顯著(P< 0.01);用不同濃度 LPS(0.1、1和10 mg/L) 刺激細胞9 h后, COX-2 mRNA表達亦隨之增多,1 mg/L、10 mg/L組 LPS刺激COX-2 mRNA表達達到高峰,兩者間差異無統計學意義,與0.1 mg/L組相比差異有統計學意義(P<0.01),見圖1A,1B。用1 mg/L LPS刺激培養HBECs后,在不同時點(3 h、6 h、9 h)COX-2 mRNA表達亦增多, 并呈時間依賴關系,9 h組與3 h、6 h組相比顯著差異(P< 0.01),結果見圖1A、C。mRNA 表達的半定量結果以COX-2/β- actin吸光度的相對值計算。而且用LPS刺激HBECs能增加上清液PGE2(PGE2是COX-2主要產物之一)的含量,呈劑量、時間依賴關系。LPS誘導后,各組與對照組相比差異顯著(P< 0.01),1 mg/L、10 mg/L 組PGE2含量分別為(92.606±1.977)ng/L和(92.716±2.947)ng/L,與0.1 mg/L組[(46.332 ±1.609)ng/L相比有顯著差異(P<0.01),3 h和6 h組PGE2含量分別為(47.501±1.527)ng/L和(60.918±1.122)ng/L,與9 h組[(91.966±3.246)ng/L]相比有差異顯著(P<0.01),見圖2。
2脂氧素A4對LPS刺激的人支氣管上皮細胞COX-2mRNA及蛋白表達的影響
RT-PCR結果表明脂氧素A4能抑制LPS刺激的人支氣管上皮細胞COX-2 mRNA表達,并呈劑量依賴關系,無脂氧素A4組與對照組相比顯著差異(P<0.01),脂氧素A4組與無脂氧素A4組相比差異顯著(P<0.01),100 μmol/L與400 μmol/L脂氧素A4組相比差異有統計學意義(P<0.01),見圖3。 正常人支氣管上皮細胞中COX-2蛋白有微量表達,脂氧素A4抑制LPS刺激的人支氣管上皮細胞的COX-2蛋白表達,也呈濃度依賴關系,無脂氧素A4組與對照組相比差異有顯著(P<0.01),脂氧素A4組與無脂氧素A4組相比差異有顯著(P<0.01),100 μmol/L與400 μmol/L脂氧素A4組相比差異顯著(P<0.01),見圖 4。


圖1HBECs在不同濃度(0.1、1、10mg/L)LPS刺激9h后及在1mg/LLPS刺激不同時間(3h、6h、9h)后COX-2mRNA的表達

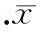
圖2HBECs在不同濃度(0.1、1、10mg/L)LPS刺激9h和1mg/LLPS刺激不同時點(3、6、9h)后上清液PGE2的水平

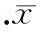
圖3脂氧素A4對LPS刺激的人支氣管上皮細胞COX-2mRNA的影響

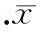
圖4脂氧素A4對LPS刺激人支氣管上皮細胞COX2蛋白表達的影響
3脂氧素A4對于LPS刺激的人支氣管上皮細胞上清液PGE2含量的影響
脂氧素A4能抑制HBECs COX-2表達,PG因此我們推測脂氧素A4是否也能抑制其產物前列腺素E2的表達。HBECs上清 ELISA檢測發現,脂氧素A4能抑制LPS刺激后人支氣管上皮細胞上清中 PGE2的含量,并呈劑量依賴關系。無脂氧素A4組與對照組相比差異顯著(P<0.01),人支氣管上皮細胞上清液PGE2從無脂氧素A4組的(97.019±1.425)ng/L降至100 μmol/L脂氧素A4組的(54.077±3.141)ng/L 以及400 μmol/L脂氧素A4組的(39.187±0.775)ng/L (P<0.01)。100 μmol/L與400 μmol/L脂氧素A4組相比差異顯著(P<0.01),見圖5。

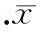
圖5不同濃度脂氧素A4對HBECsPGE2表達影響
4相關性分析
Pearson相關分析結果表明脂氧素A4抑制LPS誘導的COX-2蛋白表達與前列腺素E2水平呈相關性(r=0.99,P<0.01)。
討 論
急性肺損傷及ARDS是臨床常見急危重癥,病死率極高[7]。目前從針對內毒素性肺損傷的治療中,我們不難發現抑制炎癥啟動階段的促炎介質釋放是主旋律[8]。新近研究發現炎癥是一個從啟動到消退的程序化過程,機體還存在一整套的炎癥自限機制來精密調控炎癥的發展和消退[9]。在此基礎上提出的“促炎癥消退”的炎癥治療新策略已成為新的研究熱點。
在呼吸系統炎癥中前列腺素類物質如PGE2作為主要的炎癥介質,起到關鍵作用[10]。前列腺素類物質屬于類花生酸家族,是花生四烯酸經過COX催化而產生[10]。COX是花生四烯酸轉化成類花生酸類物質途徑中重要的限速酶[4]。機體中主要有2種COX異構體:COX-1及COX-2[11]。COX-1屬于管家酶,在大多數組織和細胞中均有表達,其表達相對恒定[12]。 COX-2 在多數情況下處于靜息狀態或低表達,只有在炎癥反應或其它病理條件下才大量表達[13]。在肺部炎癥中也存在COX-2 以及PGE2的高表達[4]。
在炎癥刺激下,人肺上皮細胞COX-2表達增加[3]。另外,COX-2基因敲除的小鼠炎癥反應性增加[14]。由于人支氣管上皮細胞表達Toll樣受體4并能分泌PGE2[15],因此本研究應用LPS刺激體外培養的人支氣管上皮細胞,并且利用MTT法(結果省略)發現1 mg/L LPS刺激細胞可以建立體外炎癥模型。目前的研究中,我們也發現人支氣管上皮細胞在LPS直接刺激下COX-2 mRNA及PGE2的表達增加(與MTT結果相符),而且我們更進一步的研究結果表明COX-2表達呈時間、劑量依賴關系。
脂氧素是調節炎癥消退的重要抗炎介質,在對肺部疾病(如哮喘)體外及體內研究都表明脂氧素具有抗炎作用[16-17]。有研究報道預先給予脂氧素類似物能減輕內毒素所致的小鼠急性肺損傷程度[18]。Medeiros等[19]報道脂氧素A4同樣能抑制內毒素所致大鼠眼葡萄膜炎的環氧合酶表達及其活性。另外據報道脂氧素能抑制人肺上皮細胞損傷后的炎癥反應并促進其向穩態表型轉化[15]。本研究發現脂氧素能抑制LPS刺激培養下人支氣管上皮細胞COX-2 mRNA及蛋白的表達,也同時能抑制其上清液PGE2水平,且存在劑量依賴關系。數據相關性分析結果表明脂氧素A4抑制LPS誘導的COX-2表達與PGE2產物具有相關性。因此脂氧素能抑制LPS PGE2產物可能是由于其抑制LPS誘導COX-2表達所致。綜上所述我們認為脂氧素A4可能部分通過依賴COX-2的方式促進肺部炎癥消退,為急性肺損傷的治療提供一個新的治療靶點。
[1] Udobi KF, Childs E, Touijer K. Acute respiratory distress syndrome[J]. Am Fam Physician, 2003, 67(2): 315-322.
[2] Martin LD, Rochelle LG, Fischer BM, et al. Airway epithelium as an effector of inflammation:molecular regulation of secondary mediators[J]. Eur Respir J, 1997,10(9): 2139-2146.
[3] Bonnans C, Fukunaga K, Levy MA, et al. Lipoxin A4regulates bronchial epithelial cell responses to acid injury[J]. Am J Pathol, 2006, 168(4):1064-1072.
[4] Ricciotti E, Fitzgerald GA. Prostaglandins and inflammation[J]. Arterioscler Thromb Vasc Biol, 2011, 31(5):986-1000.
[5] Kühn H, O’Donnell VB. Inflammation and immune regulation by 12/15-lipoxygenases[J]. Prog Lipid Res, 2006, 45(4):334-356.
[6] Romano M. Lipoxin and aspirin-triggered lipoxins[J]. Scientific World J, 2010, 10: 1048-1064.
[7] Sen S, Sen S, Sentürk E, et al. Postresectional lung injury in thoracic surgery pre and intraoperative risk factors: a retrospective clinical study of a hundred forty-three cases[J]. J Cardiothorac Surg, 2010, 5:62.
[8] Scher JU, Pillinger MH. The anti-inflammatory effects of prostaglandins[J]. J Investig Med, 2009, 57(6):703-708.
[9] Spite M, Serhan CN. Novel lipid mediators promote resolution of acute inflammation impact of aspirin and statins[J]. Circ Res, 2010, 107(10):1170-1184.
[10]Park JY, Pillinger MH, Abramson SB. Prostaglandin E2synthesis and secretion: the role of PGE2synthases[J]. Clin Immunol, 2006, 119(3):229-240.
[11]Morita I. Distinct functions of COX-1 and COX-2[J]. Prostaglandins Other Lipid Mediat, 2002, 68-69:165-175.
[12]Turini ME, DuBois RN. Cyclooxygenase-2: a therapeutic target[J]. Annu Rev Med, 2002, 53:35-57.
[13]Fortier MA, Krishnaswamy K, Danyod G, et al. A postgenomic integrated view of prostaglandins in reproduction:implications for other body systems[J]. J Physiol Pharmacol, 2008, 59(Suppl 1):65-89.
[14]Bonner JC, Rice AB, Ingram JL, et al. Susceptibility of cyclooxygenase-2-deficient mice to pulmonary fibrogenesis[J]. Am J Pathol, 2002, 161(2):459-470.
[15]Bonnans C, Gras D, Chavis C, et al. Synthesis and anti-inflammatory effect of lipoxins in human airway epithelial cells[J]. Biomed Pharmacother, 2007, 61(5):261-267.
[16]Levy BD, De Sanctis GT, Devchand PR, et al. Multi-pronged inhibition of airway hyper-responsiveness and inflammation by lipoxin A4[J]. Nat Med, 2002, 8(9):1018-1023.
[17]Planaguma A,Kazani1 S, Marigowda1 G, et al. Airway lipoxin A4generation and lipoxin A4receptor expression are decreased in severe asthma[J]. Am J Respir Crit Care Med, 2008,178(6): 574-582.
[18]Jin SW, Zhang L, Lian QQ, et al. Posttreatment with aspirin-triggered lipoxin A4analog attenuates lipopolysaccharide-induced acute lung injury in mice: the role of heme oxygenase-1[J]. Anesth Analg, 2007, 104(2):369-377.
[19]Medeiros R, Rodrigues GB, Figueiredo CP, et al. Molecular mechanisms of topical anti-inflammatory effects of lipoxin A4in endotoxin-induced uveitis[J]. Mol Pharmacol, 2008, 74(1): 154-161.
LipoxinA4reduceslipopolysaccharide-inducedexpressionofcyclooxygenase2andprostaglandinE2inhumanbronchialepithelialcells
ZHU Tian-qi1, ZHENG Sheng-xing2, JIN Sheng-wei3
(1DepartmentofAnesthesia,TheFirstAffiliatedHospitalofWenzhouMedicalCollege,2DepartmentofAnesthesia,3IntensiveCareUnit,TheSecondAffiliatedHospitalofWenzhouMedicalCollege,Wenzhou325000,China.E-mail:jinshengwei69@yahoo.com.cn)
AIM: To explore the effects of lipoxin A4on the expression of cyclooxygenase 2 (COX-2) in human bronchial epithelial cells (HBECs).METHODSHBECs were incubated with various concentrations (0.1, 1 and 10 mg/L) of lipopolysaccharide(LPS) for 9 h, or 1 mg/L LPS for different time (3 h, 6 h and 9 h). The levels of COX-2 mRNA in HBECs and prostaglandin E2(PGE2) in the culture supernatant were measured. In addition, the HBECs were exposed to lipoxin A4at concentration of 0, 100 and 400 μmol/L after stimulated with LPS at concentration of 1 mg/L for 9 h, and the supernatant of the culture cells was collected for determining the content of PGE2by ELISA. The cells were also harvested, and the mRNA and protein levels of COX-2 were analyzed by RT-PCR and Western blotting, respectively.RESULTSLPS increased the mRNA expression of COX-2 and production of PGE2in a dose and time dependent manners in HBECs. Induction of COX-2 mRNA and protein by LPS were inhibited by lipoxin A4in a dose-dependent manner. Lipoxin A4also significantly decreased LPS-induced production of PGE2.CONCLUSIONLipoxin A4down-regulates LPS-induced expression of COX-2 and consequently inhibits the production of PGE2in HBECs.
Lipoxin A4; Human bronchial epithelial cells; Cyclooxygenase 2; Lipopolysaccharides
R332.2
A
10.3969/j.issn.1000-4718.2012.03.016

