胰高血糖素樣肽-1對大鼠心肌缺血再灌注/細胞缺氧復氧損傷的保護作用及機制
郭 佳, 邊云飛, 王 麗, 楊慧宇, 肖傳實
(1山西醫(yī)科大學,2山西醫(yī)科大學第二醫(yī)院心內(nèi)科,3山西醫(yī)科大學第一醫(yī)院,山西 太原 030001)
1000-4718(2012)05-0858-07
2011-03-12
2012-03-16
△ 通訊作者 Tel:0351-3362132;E-mail: ganxibaozhongxin@sina.com
胰高血糖素樣肽-1對大鼠心肌缺血再灌注/細胞缺氧復氧損傷的保護作用及機制
郭 佳1, 邊云飛2, 王 麗2, 楊慧宇2, 肖傳實3△
(1山西醫(yī)科大學,2山西醫(yī)科大學第二醫(yī)院心內(nèi)科,3山西醫(yī)科大學第一醫(yī)院,山西 太原 030001)
目的觀察胰高血糖素樣肽-1(GLP-1)對大鼠心肌缺血再灌注/細胞缺氧復氧損傷的作用并探討其機制。方法建立大鼠缺血再灌注模型,分別設假手術(shù)組(sham)、缺血再灌注組(IR)和IR + GLP-1(0.030 nmol/L、0.16 nmol/L和0.30 nmol/L)組,缺血30 min后再灌注3 h,Evan’s blue-TTC法檢測心肌梗死范圍;取左心室游離壁心肌組織,TUNEL法檢測心肌細胞凋亡,同時測定心肌組織中氧化-抗氧化物質(zhì)超氧化物歧化酶(SOD)活性及丙二醛(MDA)含量;培養(yǎng)乳鼠心肌細胞,隨機分為正常對照組(control)、單純?nèi)毖鯊脱踅M(HR)、HR + GLP-1(1 μmol/L、5 μmol/L和10 μmol/L)組,電鏡下觀察心肌細胞形態(tài)的變化,流式細胞術(shù)檢測心肌細胞的凋亡,測定乳酸脫氫酶(LDH)釋放、SOD活性、MDA含量、活性氧簇(ROS)水平以及線粒體膜電位(MMP)。結(jié)果與IR組相比,IR+GLP-1(0.03 nmol/L、0.16 nmol/L和0.30 nmol/L)組劑量依賴性地減小心肌梗死面積,減輕線粒體超微結(jié)構(gòu)改變及細胞凋亡,增加SOD活性,減少MDA含量(P<0.05 或P<0.01);與HR組相比,HR+GLP-1(1 μmol/L、5 μmol/L和10 μmol/L)組劑量依賴性地逆轉(zhuǎn)HR誘導的細胞損傷,增加SOD活性,減少MDA含量,降低ROS水平,減輕HR誘導的MMP降低(P<0.05或P<0.01)。結(jié)論GLP-1可以減輕大鼠心肌缺血再灌注/細胞缺氧復氧損傷;其作用機制可能與增強心肌抗氧化能力及保護線粒體結(jié)構(gòu)和功能有關(guān)。
胰高血糖素樣肽-1; 缺血再灌注損傷; 缺氧復氧; 心肌細胞; 抗氧化; 線粒體膜電位
胰高血糖素樣肽-1(glucagon-like peptide-1,GLP-1)又稱為腸促胰島素、類胰升血糖素-1或胰升血糖素樣肽-1。人們對GLP-1的研究多集中于它在糖尿病的發(fā)生、發(fā)展以及治療領(lǐng)域的作用上,新近國外研究提出GLP-1對心肌損傷具有一定的保護作用。Nikolaidis等[1]研究發(fā)現(xiàn)給予擴張性心肌病狗GLP-1后,心肌細胞對葡萄糖的攝取和左心室的收縮功能均有明顯的改善。此外對心肌梗死病人給予GLP-1也可以改善患者的心功能以及血管成形術(shù)后嚴重的左心室收縮功能不良[2]。心肌缺血/再灌注損傷(myocardial ischemia-reperfusion injury, MIRI)是臨床上最為常見的損傷心肌的病理生理過程之一[3-4]。但是目前國內(nèi)關(guān)于GLP-1對心肌缺血再灌注損傷作用的研究還相對較少,其相關(guān)機制仍尚未闡明。
本實驗以在體大鼠和體外培養(yǎng)乳鼠心肌細胞為模型,觀察GPL-1對心肌細胞損傷的影響,并初步探討其作用機制,為心肌缺血再灌注損傷的治療提供新的線索和思路。
材 料 和 方 法
1主要儀器和試劑
健康雄性Sprague-Dawley (SD)大鼠及 1~3日齡SD 乳鼠均由山西醫(yī)科大學實驗動物中心提供。胰高血糖素樣肽-1(Sigma);兔抗鼠α-肌動蛋白Ⅰ抗(北京博奧森);RBITC-羊抗兔Ⅱ抗(solarbio,Spain);超氧化物歧化酶(superoxide dismutase,SOD)測試盒和丙二醛(malondialdehyde,MDA)測定試劑盒(南京建成生物工程研究所);膜聯(lián)蛋白V-異硫氰酸熒光素/碘化丙啶(Annexin V-FITC/PI)雙染色試劑盒(晶美生物工程有限公司);細胞凋亡原位檢測試劑盒(Roche);二氯熒光素二乙酯(DCF-DA,Sigma);線粒體膜電位檢測試劑(JC-1,凱基生物科技發(fā)展有限公司)。倒置顯微鏡(Nikon TS100);動物人工呼吸機(成都泰盟科技有限公司,HX-100E);多道生理信號采集處理系統(tǒng)(RM6240BD,成都儀器廠);激光掃描共焦顯微鏡(Olympus FV1000);透射電鏡(JEM-CX100)。
2缺血再灌注模型建立
戊巴比妥鈉麻醉,仰臥固定。記錄Ⅱ?qū)?lián)心電圖,氣管插管,小動物呼吸機輔助呼吸,經(jīng)胸骨左緣第2~3肋間打開胸腔暴露心臟,于左心耳根部下方2 mm處用5 /0線結(jié)扎冠狀動脈前降支,將絲線兩端穿過1根聚乙烯小管,止血鉗夾持細管,結(jié)扎線以下心肌組織顏色變暗,在Ⅱ?qū)?lián)心電圖見R波明顯增大伴ST 段即刻抬高,說明心肌已缺血。30 min后予以再灌注,以缺血區(qū)轉(zhuǎn)紅,相關(guān)導聯(lián)ST段明顯回落為再通標志,并持續(xù)3 h。
3乳鼠心肌細胞的培養(yǎng)
取1~3 d齡SD大鼠,雌雄不限,開胸取心室肌作原代細胞培養(yǎng),差速貼壁法分離純化心肌細胞,48 h后更換培養(yǎng)基。培養(yǎng)3~4 d后,倒置顯微鏡下觀察細胞自發(fā)搏動情況。針對胞漿中α-actin,采用抗α-actinⅠ抗與FITC標記的熒光Ⅱ抗,免疫熒光法鑒定心肌細胞。
4心肌細胞缺氧/復氧模型的建立
采用Koyama等[5]的方法,配制缺氧液和復氧液。缺氧液(NaH2PO40.9 mmol/L,NaHCO36.0 mmol/L,CaCl21.0 mmol/L,MgSO41.2 mmol/L,乳酸鈉40 mmol/L,HEPES 20 mmol/L,NaCl 98.5 mmol/L,KCl 10.0 mmol/L,pH 6.8,37 ℃),預先用高濃度氮氣飽和(>99.9%,1 L/min×30 min),測血氣PO2≤4.0 kPa;復氧液(NaH2PO40.9 mmol/L,NaHCO320 mmol/L,CaCl21.0 mmol/L,MgSO41.2 mmol/L,葡萄糖5.5 mmol/L,HEPES 20 mmol/L,NaCl 129.5 mmol/L,KCl 5.0 mmol/L,pH 7.4,37 ℃),預先用純氧飽和(1 L/ min×30 min)。實驗時棄去原培養(yǎng)液,用缺氧液漂洗細胞2次,換預先經(jīng)高濃度N2飽和的缺氧液,培養(yǎng)板置純N2持續(xù)通氣的密閉容器中(37 ℃)3 h,再換預先經(jīng)純氧飽和的復氧液,以純O2復氧孵育1 h(37 ℃)。
5實驗分組
實驗動物隨機分為5組,每組16只。假手術(shù)組:穿線但不行冠脈結(jié)扎;IR組:開胸結(jié)扎冠狀動脈左前降支30 min,松解結(jié)扎后再灌注3 h;IR+GLP-1組:于缺血再灌注前30 min經(jīng)舌靜脈緩慢注入GLP-1(0.03 nmol/L、0.16 nmol/L和0.30 nmol/L),隨后處理同IR。
乳鼠心肌細胞培養(yǎng)3 d后,給予缺氧復氧處理,實驗分為5組:正常對照組; HR組;HR + GLP-1(1 μmol/L、5 μmol/L和10 μmol/L)組:GLP-1預孵育24 h后給予缺氧復氧處理。
6心肌梗死面積的測定
大鼠經(jīng)再灌注3 h后再次原位結(jié)扎左冠狀動脈,經(jīng)頸動脈注入伊文氏藍。取出心臟,切片,TTC染色,藍色為未缺血區(qū)域、紅色為缺血區(qū)域。將紅色的缺血心肌片置于TTC磷酸緩沖液染色。缺血但未梗死心肌染成紅色,梗死心肌則為灰白色,稱量缺血未梗死心肌和梗死心肌濕重。心肌缺血范圍=缺血心肌面積/左心室面積(area at risk/left ventricular area,AAR/LV);心肌梗死范圍=壞死區(qū)面積/危險區(qū)面積(necrotic area/area at risk,NEC/AAR)。
7心肌超微結(jié)構(gòu)觀察
迅速取下心尖部心肌組織切成1 mm×1 mm×1 mm,戊二醛磷酸鹽緩沖液、鋨酸各固定2 h,脫水、包埋、切片、醋酸雙氧鈾、枸櫞酸雙重染色,透射電鏡下觀察心肌細胞超微結(jié)構(gòu)。
8心肌細胞凋亡測定
采用TUNEL凋亡試劑盒檢測各組心肌組織中的凋亡細胞,激光掃描共焦顯微鏡下觀察,TUNEL陽性細胞核呈綠色熒光。
9流式細胞儀檢測心室肌細胞的凋亡率
0.125%胰蛋白酶制備單細胞懸液,用Annexin V-FITC/PI雙染色標記法進行流式細胞儀檢測細胞凋亡率。
10心肌氧化、抗氧化物質(zhì)檢測
再灌注3 h結(jié)束后取左心室前壁心肌組織,-70 ℃冰箱凍存,制備組織勻漿,按試劑盒說明書操作檢測SOD活性和MDA含量。復氧1 h后收集各組心室肌細胞培養(yǎng)液,按照乳酸脫氫酶(lactate dehydrogenase,LDH)、 MDA、SOD試劑盒的操作說明測定各實驗組心肌細胞培養(yǎng)液中LDH、MDA的含量及SOD活性。
11細胞內(nèi)ROS含量檢測
心肌細胞內(nèi)ROS產(chǎn)生水平通過使用ROS敏感的熒光探針DCF-DA測定。細胞爬片,給予相應處理后,DCF-DA染液37 ℃孵育30 min。熒光顯微鏡下隨機采集5個不重復區(qū)。用ImageJ軟件進行熒光強度分析。
12線粒體膜電位檢測
收集細胞,加入JC-1溶液(10 mg/L),37 ℃、5%CO2培養(yǎng)箱孵育15 min,清洗,重懸細胞,在熒光顯微鏡下觀察,正常細胞線粒體發(fā)射紅色熒光,同一濾光鏡下呈橙色,細胞凋亡時紅色熒光強度減弱,綠色熒光增強,同一濾光鏡下呈綠色。圖像結(jié)果用ImageJ軟件分析計算綠色和紅色熒光強度平均值,綠色與紅色熒光強度的比值代表心肌細胞去極化程度。
13統(tǒng)計學處理

結(jié) 果
1心肌梗死面積
假手術(shù)組心肌缺血范圍為0,IR組與GLP-1+ IR組AAR/LV差異無顯著(P>0.05),說明實驗操作手法基本一致,排除了由此而造成的誤差。與IR組比較, IR+GLP-1組NEC/AAR明顯下降(P<0.05),見表1。
表1心肌梗死面積


GroupAAR/LVNEC/AARSham00IR0.65±0.060.44±0.07IR+GLP-1(0.03nmol/L)0.62±0.090.40±0.08*IR+GLP-1(0.16nmol/L)0.63±0.060.39±0.08*IR+GLP-1(0.30nmol/L)0.63±0.070.36±0.09*
*P<0.05vsIR group.
2心肌細胞超微結(jié)構(gòu)觀察
假手術(shù)組線粒體沿肌絲長軸排列整齊,外膜完整, 嵴密集, 基質(zhì)致密, 內(nèi)有電子致密顆粒。胞核呈橢園形, 異染色質(zhì)分布均勻。IR組出現(xiàn)廣泛的線粒體損傷,表現(xiàn)為線粒體腫脹,基質(zhì)明顯變淡,嵴排列紊亂。核皺縮,染色質(zhì)凝集。GLP-1預處理組除部分區(qū)域線粒體有改變外, 與對照無明顯區(qū)別,見圖1。

Figure 1. The ultrastructural changes of the myocardial tissues in different groups(×12 000).A: sham group; B: IR group; C: IR + GLP-1(0.03 nmol/L); D: IR+GLP-1 (0.16 nmol/L); E: IR+GLP-1 (0.30 nmol/L).
圖1心肌組織電鏡下形態(tài)
3各組心肌組織中的細胞凋亡情況
TUNEL染色結(jié)果顯示:與sham 組相比,IR 組心肌組織可見大量凋亡細胞,IR+GLP-1(0.03 nmol/L、0.16 nmol/L和0.30 nmol/L)組凋亡細胞較 IR 組明顯減少,見圖2。
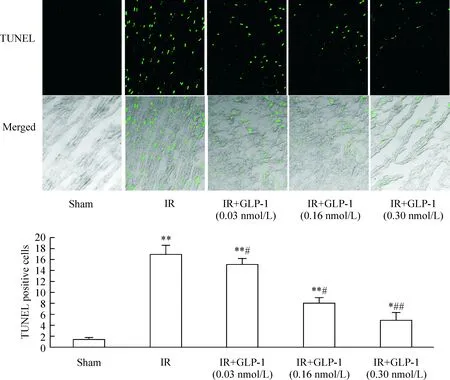

圖2TUNEL法檢測各組心肌組織中細胞凋亡情況
4心肌氧化、抗氧化物質(zhì)檢測
與IR組相比,IR+GLP-1(0.03 nmol/L、0.16 nmol/L和0.30 nmol/L)組再灌注末心肌組織中抗氧化酶SOD含量明顯高于IR組,而MDA含量則明顯降低(P<0.05),見表2。
表2GLP-1對心肌氧化-抗氧化系統(tǒng)的作用

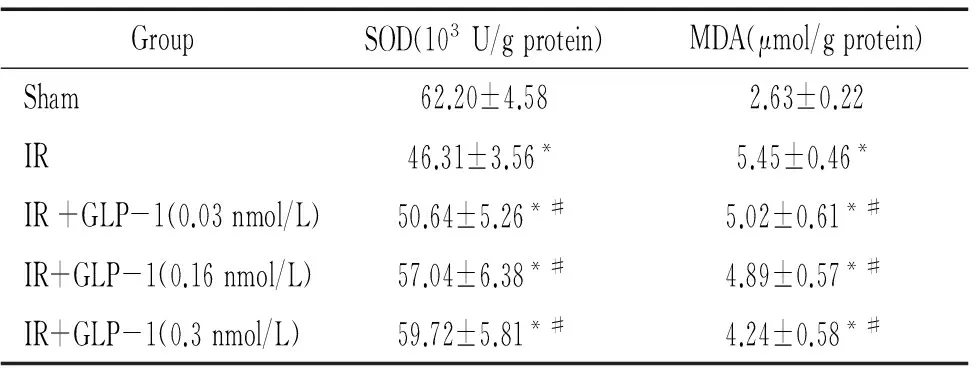
GroupSOD(103U/gprotein)MDA(μmol/gprotein)Sham62.20±4.582.63±0.22IR46.31±3.56*5.45±0.46*IR+GLP-1(0.03nmol/L)50.64±5.26*#5.02±0.61*#IR+GLP-1(0.16nmol/L)57.04±6.38*#4.89±0.57*#IR+GLP-1(0.3nmol/L)59.72±5.81*#4.24±0.58*#
*P<0.05vssham group;#P<0.05vsIR group.
5乳鼠心室肌細胞的培養(yǎng)與鑒定
倒置相差顯微鏡下可見原代乳鼠心肌細胞成簇生長,伸出偽足,折光性強,且搏動明顯,見圖3A。免疫熒光法鑒定:熒光倒置顯微鏡下可見細胞呈扁平多角形,胞漿呈紅熒光陽性表達的細胞達95%,可用于實驗,而非心肌細胞胞漿無陽性表達,見圖3B。

Figure 3. Morphology and identification of primary normal cardiomyocytes(×200).A: morphologial characteristics of primary neonatal rat cardiomyocytes; B: the indentification of cardiomyocytes (immunofluorescent staining of α-actin).
圖3原代培養(yǎng)的正常乳鼠心室肌細胞的形態(tài)及鑒定
6心肌細胞培養(yǎng)液中LDH活性測定
HR組LDH活性較對照組明顯升高(83.76±12.21vs16.84±4.43,P<0.05),說明在HR過程中造成了細胞損傷;與HR組相比,不同濃度GLP-1顯著降低LDH活性,見表3。

表3 各組心肌細胞培養(yǎng)液LDH含量、SOD活性和MDA含量的比較
*P<0.05vscontrol group;#P<0.05vsHR group.
7心肌細胞凋亡率和壞死率
對照組細胞生長良好,HR組出現(xiàn)大量凋亡細胞,并有部分壞死細胞。給予不同濃度GLP-1預孵育減少了缺氧復氧損傷造成的的凋亡和壞死,凋亡率均較HR組減低,見圖4。


圖4流式細胞儀檢測各組心肌細胞凋亡率和壞死率的變化情況
8心肌細胞培養(yǎng)液中MDA含量、SOD活性和ROS測定
與對照組相比,HR組SOD活性明顯下降(20.00±4.74vs64.52±6.47,P<0.05),而MDA含量明顯升高(53.74±8.41vs3.90±0.90,P<0.05),HR使ROS生成升高2倍,GLP-1明顯逆轉(zhuǎn)這種改變(P<0.05或P<0.01),提示GLP-1能減少MDA含量,增加抗氧化物質(zhì)SOD活力,減少ROS生成,見表3、圖5。
9線粒體膜電位檢測結(jié)果
圖6結(jié)果顯示,對照組線粒體JC-1綠色/紅色熒光比值為1.00±0.11,HR組綠色熒光明顯增強(1.54±0.33,P<0.05),不同濃度GLP-1明顯減輕線粒體膜電位降低(P<0.05),見圖6。
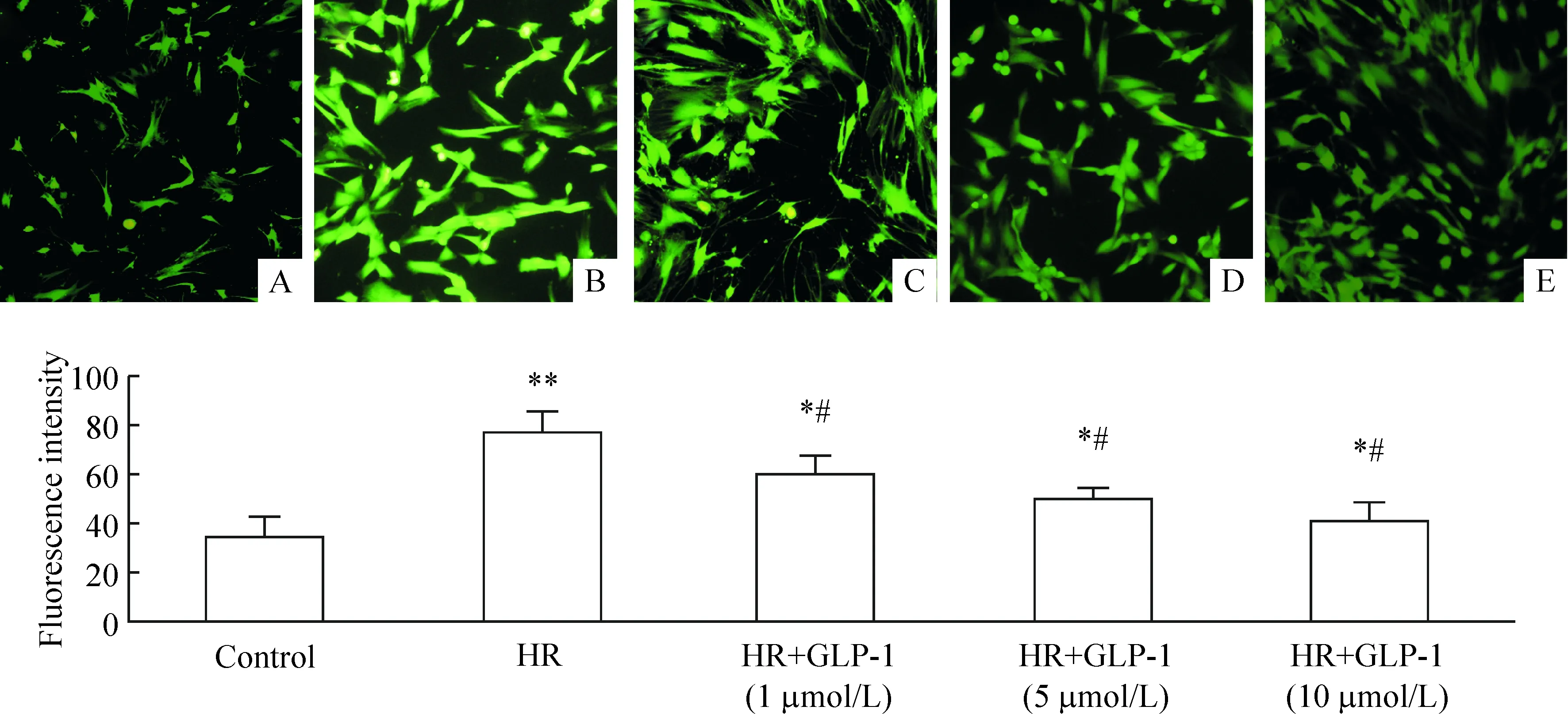

圖5GLP-1抑制HR對ROS生成的促進作用


圖6各組線粒體膜電位變化
討 論
GLP-1作為一種腸促胰島素,具有促進葡萄糖依賴的胰島素分泌、抑制胰高血糖素升高、抑制胃排空及胃動力、增加飽食感、抗胰島β細胞功能紊亂、刺激胰島細胞增殖等作用。國外研究發(fā)現(xiàn)GLP-1及其類似物可以抑制胰島β細胞凋亡。Hui等[6]研究表明,GLP-1可以保護小鼠胰島β細胞瘤株Min6細胞免受過氧化氫誘導的凋亡;GLP-1對包括胰腺β細胞在內(nèi)的多種靶細胞均有抑制其凋亡的保護作用,而GLP-1受體也存在于心肌細胞,并且GLP-1抑制胰島β細胞凋亡的途徑與心肌細胞的凋亡也有關(guān),因此推測GLP-1對心肌細胞也有類似的保護作用,而且這種保護作用與其抑制心肌細胞凋亡有關(guān)[7-9]。
然而Kavianipour等[10]報道在豬心肌梗死模型的研究中,GLP-1對心臟動力學和梗死面積并無影響,因此,關(guān)于GLP-1對心肌是否存在保護作用及具體的機制仍有待于進一步研究。本實驗采用心肌缺血再灌注模型和體外缺氧復氧模型,給予GLP-1預處理。結(jié)果發(fā)現(xiàn)與假手術(shù)組相比,心肌缺血再灌注組發(fā)生心肌梗死,心肌細胞凋亡顯著增加;體外實驗結(jié)果顯示與正常對照組相比,缺氧復氧后,LDH活性明顯增強,心肌細胞凋亡率顯著增加,而體內(nèi)或體外給予GLP-1預處理,上述指標均發(fā)生明顯逆轉(zhuǎn),證實GLP-1對缺血再灌注/缺氧復氧造成的心肌細胞損傷具有保護作用。同時我們發(fā)現(xiàn),缺血再灌注/缺氧復氧誘導的心肌MDA含量增加,而抗氧化物質(zhì)SOD活性下降,GLP-1預處理可顯著逆轉(zhuǎn)這一變化。已有研究表明氧化應激是心肌缺血再灌注損傷的重要機制[11],氧化應激是指活性分子例如活性氧簇以及活性氮簇等的過度生成和/或清除減少,從而造成體內(nèi)活性氧類生成與抗氧化防御功能之間平衡的紊亂[12]。SOD 對機體的氧化與抗氧化平衡起著至關(guān)重要的作用,是體內(nèi)主要的抗氧化酶,SOD活力的高低能反映機體抗氧化防御水平。MDA 是脂質(zhì)過氧化反應的產(chǎn)物,其含量可反映組織損傷的程度。本實驗結(jié)果提示,GLP-1對缺血再灌注/缺氧復氧所致心肌損傷的保護作用,可能與其抗氧化作用有關(guān)。
線粒體是細胞生死的最終主宰者,研究發(fā)現(xiàn)線粒體膜電勢能反映電子傳遞鏈的性能。動物缺血時線粒體膜電位降低啟動細胞凋亡的級聯(lián)反應,是細胞凋亡的一個早期特征。本研究通過對線粒體超微結(jié)構(gòu)和線粒體膜電位觀察發(fā)現(xiàn),GLP-1能減輕IR/HR誘導的線粒體結(jié)構(gòu)和功能變化。
綜上所述,GLP-1能夠減輕心肌缺血再灌注/缺氧復氧損傷,可能與其抗氧化作用及線粒體結(jié)構(gòu)功能保護作用有關(guān),這為心臟缺血再灌注的細胞保護治療提供了新的方向。
[1] Nikolaidis LA,Mankad S,Sokos GG,et al. Effects of glucagon-like peptide-1 in patients with acute myocardial infarction and left ventricular dysfunction after successful reperfusion[J].Circulation,2004,109(8):962-965.
[2] Nikolaidis LA, Elahi D,Hentosz T,et al. Recombinant glucagon-like peptide-1 increased myocardial glucose uptake and improved left ventricular performance in conscious dogs with pacing induced dilated cardiomyopathy[J]. Circulation, 2004, 110(8):955-961.
[3] 李 健,馮義柏,郎明健.吡格列酮預處理對大鼠心臟缺血再灌注/缺氧再復氧線粒體結(jié)構(gòu)及膜電勢的影響[J]. 中國病理生理雜志,2008,24(4):720-724.
[4] 鄧宇珺,符永恒,譚 寧,等. 大鼠活體心肌缺血再灌注損傷模型的建立與綜合評估[J]. 中國病理生理雜志,2011,27(2):412-416.
[5] Koyama T, Temma K, Akera T. Reperfusion-induced contracture develops with a decreasing [Ca2+]iin single heart cells[J].Am J Physiol,1991, 261(4 Pt 2):H1115-H1122.
[6] Hui H,Nourparvar A,Zao X,et al. Glucagon-like peptide-1 inhibits apoptosis of insulin-secreting cells via a cyclic 5’-adenosine monophosphate-dependent protein kinase A and a phosphatidylinositol 3-kinase-dependent pathway[J]. Endocrinology, 2003,144(4):1444-1455.
[7] Bose AK,Mocanu MM,Carr RD,et al. Glucagon-like peptide 1 can directly protect the heart against ischemia/reperfusion injury[J]. Diabetes,2005,54(1): 146-151.
[8] Poornima I,Brown SB,Bhashyam S,et al. Chronic glucagon-like peptide-1 infusion sustains left ventricular systolic function and prolongs survival in the spontaneously hypertensive, heart failure-prone rat [J]. Circ Heart Fail, 2008, 1(3): 153-160.
[9] Mafong DD, Henry RR. The role of incretins in cardiovascular control[J]. Curr Hypertens Rep, 2009, 11(1):18-22.
[10]Kavianipour M, Ehlers MR, Malmberg K, et al. Glucagon-like peptide-1 (7-36) amide prevents the accumulation of pyruvate and lactate in the ischemic and non-ischemic porcine myocardium[J]. Peptides,2003, 24(4): 569-578.
[11]徐少東,馬禮坤,屈朝法,等. 犬急性心肌梗死晚期再灌注對心肌Fas/FasL系統(tǒng)的影響及其可能的氧化應激機制[J]. 中國病理生理雜志,2007,23(2):307-310.
[12]Heistad DD. Oxidative stress and vascular disease[J].Arterioscler Thromb Vase Biol, 2006,26(4):689-695.
Effectsofglucagon-likepeptide-1onmyocardialischemia-reperfusion/hypoxia-reoxygenationinjuryinrats
GUO Jia1, BIAN Yun-fei2, WANG Li2, YANG Hui-yu2, XIAO Chuan-shi3
(1ShanxiMedicalUniversity;2DepartmentofCardiology,TheSecondHospitalofShanxiMedicalUniversity;3DepartmentofCardiology,TheFirstHospitalofShanxiMedicalUniversity,Taiyuan030001,China.E-mail:ganxibaozhongxin@sina.com)
AIM: To investigate the effects of glucagon-like peptide-1 (GLP-1) on myocardial ischemia-reperfusion (IR)/hypoxia-reoxygenation (HR) injury in rats.METHODSSprague-Dawley rats were randomly divided into 5 groups: sham group, IR group and IR+GLP-1 (0.03 nmol/L, 0.16 nmol/L and 0.30 nmol/L) groups. IR group and IR+GLP-1 group were subject to 30 min of ischemia and 3 h of reperfusion. The myocardial infarct size, the ultrastructural changes of the myocardial tissues, the apoptosis of the cardiomyocytes, the activity of superoxide dismutase (SOD) and the concentration of malondialdehyde (MDA) were detected. Primarily cultured cardiomyocytes were divided into 5 groups at random: control group, HR group and HR+GLP-1 (1 μmol/L, 5 μmol/L and 10 μmol/L) groups. The morphology and apoptosis of the cardiomyocytes were observed. The levels of lactate dehydrogenase (LDH),MDA,SOD,reactive oxygen species (ROS) and mitochondrial membrane potential (MMP) in different groups were detected.RESULTSCompared with IR group, the myocardial infarct size and cardiomyocyte apoptosis were remarkably reduced, mitochondrial ultrastructures were improved, the activity of SOD was increased and the concentration of MDA was decreased in IR+GLP-1 (0.03 nmol/L, 0.16 nmol/L and 0.30 nmol/L) groups. Compared with HR group, GLP-1 (1 μmol/L, 5 μmol/L and 10 μmol/L) preconditioning significantly decreased the myocardial injury, increased SOD activity, decreased MDA concentration and ROS production, and heightened MMP in a dose-dependent manner.CONCLUSIONGLP-1 protects cardiomyocytes from IR/HR injury, which may be partially due to the effects of anti-oxidative mechanism and the function of mitochondrial protection.
Glucagon-like peptide-1; Ischemia-reperfusion injury; Hypoxia reoxygenation; Cardiomyocytes; Anti-oxidation; Mitochondrial membrance potential
R363
A
10.3969/j.issn.1000-4718.2012.05.016

