殼聚糖凝膠的制備及應用研究進展
陳世蘭,陳 勇,周小濤,吳 瑤 (重慶科技學院化學與生物工程學院,重慶 401331)
殼聚糖凝膠的制備及應用研究進展
陳世蘭,陳 勇,周小濤,吳 瑤 (重慶科技學院化學與生物工程學院,重慶 401331)
介紹了殼聚糖凝膠的制備方法,闡述了殼聚糖微凝膠和殼聚大塊凝膠的類型及其性能研究進展,并對相關研究進行了評價。
殼聚糖;微凝膠;復合凝膠;藥物釋放
殼聚糖具有生物相容性、生物降解性,且降解產物無毒等特性,使其在生物醫學研究領域備受關注,其中有關藥物控制釋放體系的研究較多,根據不同功能需求,研究者們采用不同的方法制備了不同尺寸的殼聚糖凝膠和殼聚糖復合凝膠。在用作藥物控制釋放載體材料的研究早期,主要制備僅以殼聚糖為原料對環境pH值響應的凝膠體系,隨著生物醫學對載體材料的功能化要求的提高及研究者對載體材料的深入研究,殼聚糖復合凝膠應運而生,隨之產生的還有對環境pH值、溫度、鹽(或鹽濃度)、磁場、光等產生響應的多功能殼聚糖復合凝膠。為此,筆者闡述了殼聚糖凝膠的制備方法,總結分析研究現狀,為殼聚糖凝膠的研究提供參考。
1 殼聚糖凝膠的制備方法
1.1化學交聯法
用化學交聯法合成凝膠通常需要加入化學交聯劑,而殼聚糖的化學交聯是利用其分子骨架上的C2位氨基和C6位羥基(見圖1),因而殼聚糖的化學交聯劑有醛類(如甲醛,戊二醛,乙二醛等)、京尼平(一種中藥成分,見圖2)[1]、乙二醇縮水甘油醚、聚乙二醇、異氰酸酯類[2]及環氧氯丙烷等。此外,還可將殼聚糖改性,使其帶有不飽和雙鍵,再與其他物質發生化學反應生成交聯型聚合物。
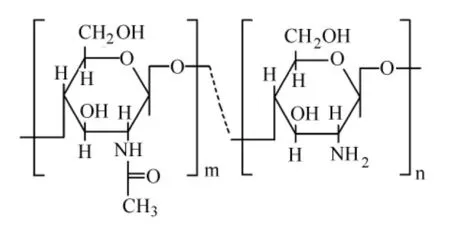
圖1 殼聚糖結構式
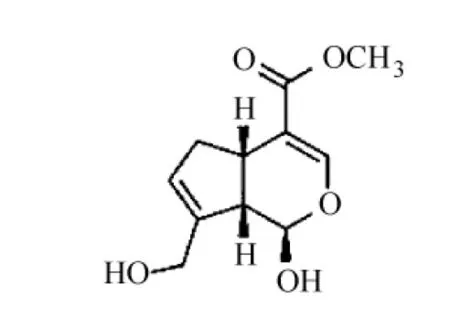
圖2 京尼平結構式
殼聚糖衍生物大多是利用殼聚糖分子骨架上的活性基團經過化學改性后的產物,由于改性過程中活性基團不可能完全參與反應,因而制備殼聚糖衍生物凝膠也可選用相應交聯劑,如N-羥丙基十二烷基二甲基氯化銨改性殼聚糖可用環氧氯丙烷交聯,羧甲基化殼聚糖、羥丙基化殼聚糖等可用戊二醛交聯。此外,還可以根據改性時新引入基團的性質選擇相應的交聯劑。迄今,大多殼聚糖的化學交聯劑為毒性較高的醛類,若殼聚糖用作生物醫用材料,需探索交聯性能較好且無毒或低毒副作用的新型化學交聯劑。
1.2物理交聯法
物理交聯法主要包括離子交聯法和輻射交聯法。離子交聯法形成的凝膠中無共價交聯鍵橋,而輻射交聯法形成的凝膠中大多是共價交聯鍵橋。離子交聯型殼聚糖凝膠僅在極酸或極堿的條件下才解離,表現出更顯著的pH值響應性。常見離子交聯劑有多元酐、多元酸和多元酸鹽等。易文清等[3]采用三聚磷酸鈉和六偏磷酸鈉為復合交聯劑,制備了離子交聯的殼聚糖微球,其對環境離子強度和pH值的改變產生響應,在酸性介質中溶脹度可達到357%,且凝膠沒有任何破碎。Dambies等[4]以鉬酸鹽為交聯劑, 制備出具有薄的外層和含有小孔內層的微球結構,為核殼結構殼聚糖微球的合成提供了新的思路。筆者[5]曾采用檸檬酸三鈉為離子型交聯劑制備了具有核-殼結構的殼聚糖凝膠粒。
殼聚糖為陽離子型聚電解質,可與陰離子聚電解質通過靜電作用形成物理交聯型凝膠。筆者[6]考察了水溶液中殼聚糖與聚甲基丙烯酸的復合作用,發現兩者之間的作用本質主要為庫倫引力,并初步確定了大分子間的復合結構模型。利用2種聚電解質間的靜電作用合成酸性或堿性條件下均能溶脹的凝膠,有望拓展凝膠的應用范圍。
輻射交聯法是從聚合物或單體出發合成凝膠的方法,該方法無需添加化學引發劑或其他助交聯的化學物質,輻射能量高且輻射劑量可控,因而該方法具有產物純凈、反應易激發、反應溫度低、反應易控、操作簡便的優點。常用的輻射方法有60Co衰變產生的γ-射線、高能電子束及紫外光等。
2 殼聚糖微凝膠的類型
2.1僅以殼聚糖為基質的微凝膠
隨著殼聚糖在生物醫藥領域的廣泛應用,越來越多的人進行微膠囊及納米微球的研究,發明了許多制備殼聚糖微球的方法。何強芳等[7]以殼聚糖為載體, 以真空泵油和石蠟油相混合為油相,以span-80和硬脂酸鎂為復合乳化劑,通過乳液-化學交聯法制備了5-氟脲嘧啶(5-Fu)殼聚糖微球,所得微球的藥物包封率達43.6%~84.8%。在pH分別為7.4和3.9的緩沖溶液中進行的藥物釋放試驗表明,5-Fu與殼聚糖質量比、交聯劑用量及釋藥介質的pH值均對微球的釋藥速率產生影響,且殼聚糖與5-Fu之間有較強的分子間作用力,微球球形規整,分散性好。藥物分子除在合成時包埋于材料中,還可以通過被動吸附方式擔載,避免藥物接觸有機試劑引起活性損失。Filipovic等[8]采用噴霧干燥法制備了卡馬西平/殼聚糖-羥丙基纖維素聚合物微球,發現微球對藥物的包封率和釋放特征依賴于所制備微球的聚合物組成、聚合物分子量和藥物與聚合物的比例,藥物包封率低的微球較包封率高的微球能更好地控制藥物釋放。但噴霧干燥時溫度較高,不宜用于制備載藥體系。施曉文等[9]用反相懸浮交聯法制得了多孔改性殼聚糖微球,發現交聯劑濃度、殼聚糖與聚乙二醇(PEG2000)的重量比對微球的粒徑和孔徑有明顯影響,PEG2000用量越大則微球的粒徑和孔徑越大,但對陰離子交換容量影響不大。與牛血清蛋白(BSA)的吸附表明,交聯密度對吸附率有較大影響。Fujita等[10]將不同的肝磷脂(非抗凝血劑,HA)加入含有乳糖的殼聚糖(殼聚糖-LA)水溶液中制得注射型殼聚糖-LA/HA微凝膠,研究了殼聚糖-LA/ HA對纖維原細胞增長素(FGF-2)的固定作用,發現該微凝膠在皮下(老鼠體內)注射后20d后可生物降解,且在注射部位附近有新血管和含纖維組織形成。
2.2殼聚糖復合微凝膠
為改善殼聚糖微凝膠的性能(如強度、載藥性、響應性等),可將其他物質引入殼聚糖微凝膠形成殼聚糖復合微凝膠。王宏麗等[11]利用海藻酸鈉(SA)聚陰離子及殼聚糖聚陽離子電解質的性質,以順鉑(DDP)為模型藥,采用乳化交聯法制備SA-DDP緩釋微凝膠,根據靜電吸附原理合成SA/DDP/殼聚糖復合載藥微凝膠,微凝膠圓整,載藥微凝膠表面致密且分散性好,微凝膠粒徑在11.0~58.8μm之間,采用原子吸收分光光度計對載藥微凝膠的載藥率、藥物包封率和藥物體外釋放性質進行測試,發現使用該載藥微凝膠可減少藥物的投放量和投放次數,降低了毒副作用。謝宇等[12]采用磁性Fe3O4納米顆粒為磁核,用反相懸浮聚合法制備了磁性殼聚糖復合微凝膠,考察了殼聚糖濃度、乳化劑用量、交聯劑濃度、攪拌速度等參數對殼聚糖成球的影響,并在特定試驗條件下制得形貌光滑、粒徑為0.5~2μm的磁性殼聚糖復合微凝膠。Yan等[13]利用帶有相反電荷的殼聚糖和聚L-谷氨酸,通過層層自組裝制備聚電解質中空微膠囊,其對疏水抗癌藥物的負載率較高且對藥物持續緩慢釋放,因而在生物醫藥領域具有較好的應用前景。Chellat等[14]合成了殼聚糖/黃原膠聚電解質微凝膠,在模擬生理介質中考察了該微凝膠的降解行為,用高精密液相色譜以氨基葡萄糖和N-乙基-氨基葡萄糖為參比測定殼聚糖的降解程度,發現在培養時間(15d)內降解產物為殼聚糖低聚物。
3 殼聚糖大塊凝膠的類型
殼聚糖微凝膠可包覆藥劑,用于特定區域的藥物釋放,但大多藥物釋放速率較快,而殼聚糖大塊凝膠則主要用于藥物的長效釋放,可避免藥物快速釋放對人體造成傷害。
3.1殼聚糖/合成大分子復合凝膠
天然高分子組成的凝膠在生物相容性、細胞控制降解、應用安全上有潛在優勢,然而該材料穩定性較差,而合成大分子凝膠能精確控制其功能,可供選擇的品種較多。與天然材料相比,合成材料必須嚴格控制材料中混雜的未反應單體、小分子副產物等,以避免可能由此產生的生物不相容性和藥物的不良相互作用等問題。Torre等[15]研究了羥氨芐青霉素三水化合物及羥氨芐青霉素鈉從殼聚糖/聚丙烯酸(PAA)凝膠中釋放的釋放行為,發現殼聚糖與PAA間的相互作用以及聚合物與藥物間的相互作用影響了藥物的釋放,且羥氨芐青霉素三水化合物僅隨凝膠的溶脹和消溶脹而釋放,而羥氨芐青霉素鈉與聚合物間存在離子鍵相互作用,延緩了藥物的釋放。Swami等[16]用光聚合技術(不含任何光引發劑和交聯劑)合成了殼聚糖/聚N-乙烯基吡咯烷酮(PVP)及殼聚糖/聚(N-乙烯基吡咯烷酮-co-甲基丙烯酸羥乙酯)(P(NVP-co-HEMA))的IPN凝膠,研究發現殼聚糖/PVP凝膠較殼聚糖/P(NVP-co-HEMA)凝膠表現出較高的溶脹能力及較快的藥物(茶堿)釋放速率。通過細胞增殖試驗可知,上述凝膠具有良好的生物相容性。El-Sherbiny等[17]以2,2-二甲氧基-2-苯基苯乙酮為光引發劑,通過輻射N-丙烯酰甘氨酸和殼聚糖的混合物制備溫度/pH雙重敏感的IPN凝膠,考察了凝膠在pH值為2.1和7.4的緩沖溶液中的溶脹行為(不同溫度下),并以5-Fu為模型藥物,測定上述pH環境中的釋放行為,結果顯示酸性介質中藥物釋放速率較快。殼聚糖與合成大分子復合凝膠的性能較好,但其生物相容性及相容本質、降解性及降解本質商待明確。
3.2殼聚糖/天然高分子復合凝膠
用天然多糖作為藥物載體,具有生物相容性好、制備條件溫和及免疫原性低等優點,因而備受關注。劉群等[18]以乳化內部凝膠化法制備了海藻酸鈉-殼聚糖微膠囊(ACM微膠囊),考察了成膜反應過程中影響微膠囊膜強度的幾個主要參數,初步探討了海藻酸鈉與殼聚糖2種高分子間發生聚電解質絡合反應的機制。李沙等[19]采用乳化膠凝法制備ACM微膠囊,通過差示掃描量熱法探討其成型機理,并以BSA為模型藥來研究微膠囊對大分子藥物的包載能力及釋藥特性,發現隨藥載比增加、殼聚糖濃度升高,微囊中載藥量也明顯增加。Das等[20]利用天然大分子果膠與殼聚糖形成凝膠,研究發現當交聯環境pH值為1.5、殼聚糖濃度為1%、果膠與藥物用量比為3∶1時,殼聚糖/果膠中藥物可于腸部定位釋放。盡管由天然高分子化合物制得的載藥體系無毒副作用,但載藥體系的強度還有待改善。
4 結 語
殼聚糖凝膠的制備方法中,化學交聯法和物理交聯法各有優缺點,因此,可開發能結合2種交聯方法優勢的新型交聯體系。殼聚糖微凝膠用于載藥體系的前景較好,但其載藥量及載藥效率較低,對藥物的緩慢控制釋放能力較差,而殼聚糖與合成大分子形成載體材料的性能較好,但需明確其生物相容性及降解本質。同時,殼聚糖與天然高分子形成的載藥體系強度還需提高。此外,對控制藥物釋放的載體材料的多功能化、生理毒副作用等相關問題是今后需要重點研究的內容。
[1]Harris R, Lecumberri E, Heras A. Chitosan-Genipin Microspheres for the Controlled Release of Drugs: Clarithromycin, Tramadol and Heparin[J].Marine Drugs 2010,8(6):1750-1762.
[2] 楊媛,李立華,容建華,等. 新型生物降解交聯劑的制備及其在殼聚糖交聯膜中的應用[J].材料科學與工程學報,2004,22(2):292-295.
[3]易文清,李新法,陳金周,等.殼聚糖水凝膠微球的制備與溶脹性能[J].功能高分子學報,2010, 23(4): 396-399.
[4]Dambies L, Vincent T, Domard A, et al. Preparation of chitosan gel beads by ionotropic molybdate gelation [J].Biomacromolecules, 2001,2(4):1198-1112.
[5]Chen S L, Liu M Z, Jin S P, et al. Preparation of ionic-crosslinked chitosan-based gel beads and effect of reaction conditions on drug release behaviors[J]. Int J Pharm, 2008, 308:180-187.
[6]Chen S L, Liu M Z, Jin S P, et al. Structure and properties of the polyelectrolyte complex of chitosan with poly(methacrylic acid) [J]. Polym Int, 2007, 56: 1305-1312.
[7]何強芳,李國明,巫海珍,等. 5-氟尿嘧啶殼聚糖微球的制備及其釋藥性能[J].應用化學,2004,21(2):192-196.
[8]Filipovi-Grci J,Perissutti B,Moneghini M,et al. Spray-dried carbamazepine-loaded chitosan and HPMC microspheres: preparation and characterisation[J].J Pharm Pharmacol,2003,55(7): 921-931.
[9]施曉文,肖玲,杜予民,等.球形改性殼聚糖的制備及吸附牛血清蛋白性能的研究[J].武漢大學學報(理學版), 2002,48(2):188-192.
[10] Fujita M,Ishihara M,Simizu M, et al. Vascularization in vivo caused by the controlled release of fibroblast growth factor-2 from an injectable chitosan/non-anticoagulant heparin hydrogel[J].Biomaterials 2004, 25:699-706.
[11]王宏麗,陳風雷,陳濤,等.海藻酸鈉/殼聚糖緩釋微球的制備及性能[J].云南大學學報(自然科學版),2010,32 (4): 469-472.
[12]謝宇,魏婭,李明俊,等.磁性殼聚糖復合微球的制備及表征[J].機械工程材料, 2009(12):59-62.
[13]Yan S,Zhu J,Wang Z,et al. Layer-by-layer assembly of poly(L-glutamic acid)/chitosan microcapsules for high loading and sustained release of 5-fluorouracil[J]. Eur J Pharm Biopharm, 2011,78(3): 336-345.
[14]Chellat F, Tabrizian M, Dumitriu S, et al. Study of biodegradation behavior of chitosan-xanthan microspheres in simulated physiological media[J]. J Biomed Mater Res 2000, 53:592-599.
[15] Torre P M, Enobakhare Y, Torrado G, et al. Release of amoxicillin from polyionic complexes of chitosan and poly(acrylic acid). Study of polymer/polymer and polymer/drug interactions within the network structure[J]. Biomaterials, 2003,24:1499-1506.
[16] Ng L T, Swami S. IPNs based on chitosan with NVP and NVP/HEMA synthesized through photoinitiator-free photopolymerisation technique for biomedical applications[J].Carbohyd Polym, 2005,60:523-528.
[17]El-Sherbiny I M, Lins R J, Abdel-Bary E M, et al. Preparation, characterization, swelling and in vitro drug release behaviour of poly[N-acryloylglycine-chitosan] nterpolymeric pH and thermally-responsive hydrogels[J]. Eur Polym J,2005,41:2584-2591.
[18]劉群,薛偉明,于煒婷,等. 海藻酸鈉-殼聚糖微膠囊膜強度的研究[J].高等學校化學學報,2002, 23(7):1417-1420.
[19]李沙,侯新樸. 海藻酸鈉-殼聚糖微囊成型機理及其對大分子藥物的載藥、釋藥研究[J].藥學學報 2003, 38(5):380-383.
[20] Das S, Chaudhury A, Ng K Y. Preparation and evaluation of zinc-pectin-chitosan composite particles for drug delivery to the colon: Role of chitosan in modifying in vitro and in vivo drug release[J].Int J Pharm, 2011, 406:11-20.
[編輯] 李啟棟
10.3969/j.issn.1673-1409(N).2012.04.005
O636.1
A
1673-1409(2012)04-N013-04
2012-02-16
重慶市教委科學技術研究項目(KJ111412);重慶市自然科學基金項目(CSTC,2008BB4358)。
陳世蘭(1980-),女,2003年大學畢業,博士,講師,現主要從事智能高分子材料方面的教學與研究工作。

