高糖和脂多糖對腹膜間皮細胞中骨橋蛋白的表達及其所致纖維化的影響
霍愛晶,馬健飛,李程程,鄧文艷,王力寧
(中國醫科大學附屬第一醫院腎內科,沈陽 1 1 0 0 0 1)
腹膜纖維化已成為多數慢性腎衰患者退出腹膜透析的一個主要因素。腹膜間皮細胞(peritoneal mesothelial cell,PMC)在腹膜纖維化中起關鍵作用。當暴露在透析相關性腹膜炎環境下時,PMC的形態、結構及功能發生變化,導致其最終進入不可逆性腹膜纖維化階段。本研究通過觀察高糖透析液及炎性因子脂多糖(lipopolysaccharide,LPS)單獨及聯合作用下骨橋蛋白(osteopontin,OPN)及纖維化因子轉化生長因子 β1(transforming growth factor β1,TGF-β1)表達的變化,進一步揭示腹膜纖維化的發生及阻斷機制。
1 材料與方法
1.1 材料
1.1.1 實驗動物:健康雄性SD大鼠,體質量160~200 g,普通級,由中國醫科大學實驗動物中心提供。
1.1.2 主要試劑:DMEM/F12干粉培養基、胎牛血清(天津灝陽);LPS粉劑(美國Sigma公司);0.25%胰酶(沈陽博爾美公司);Trizol試劑(美國Invitrogen公司);OPN多克隆抗體、DAB顯色液、SABC試劑盒(武漢博士德公司);Real-time RT-PCR試劑盒(大連TaKaRa公司);PCR引物由北京華大基因公司合成。
1.2 方法
1.2.1 大鼠PMC(RPMC)的培養、傳代與鑒定:具體方法參照文獻[1]。
1.2.2 免疫組織化學法檢測OPN的表達:采用24孔板培養細胞無菌爬片24 h后,無血清同步化12 h,分組并作用 24 h:(1)正常對照組:培養基中葡萄糖濃度 0.1%;(2)2.5%高糖組;(3)LPS(50 μmol/L)組;(4)2.5%高糖+LPS(50 μmol/L)聯合作用組。4%多聚甲醛固定,0.5%Trix X-100打孔,3%H2O2甲醇室溫孵育,滅活內源性過氧化物酶,血清封閉孵育,分別滴加1︰150稀釋的OPN一抗試劑,4℃過夜(PBS代替一抗做陰性對照),滴加羊抗兔IgG孵育,DAB顯色。OPN以胞質及胞核染色為陽性,選取不同視野(×100)計算單位面積陽性染色區域平均積分光密度(A)。計數OPN染色陽性細胞數占1個視野總細胞數的百分比。比較各組均值。
1.2.3 Real-time RT-PCR 檢測 OPN、TGF-β1mRNA表達:實驗分組如下:(1)正常對照組:只加1%胎牛血清的DMEM/F12培養基作用24 h;(2)LPS組:a亞組:不同濃度 LPS(1,50,100 μg/mL)分別作用 24 h;b亞組:50 μg/mL LPS分別作用不同時間(8,12,24,34,48h);(3)高糖組:a亞組:不同濃度高糖(1.5%,2.5%,4.25%)分別作用24 h;b亞組:2.5%高糖作用不同時間(8,12,24,34,48 h)。Trizol提取細胞總RNA,逆轉錄合成cDNA。PCR反應條件為:95℃30 s,60 ℃ 34 s,60 ℃ 60 s,共 42 個循環。OPN 引物序列:上游:5′GCAGGACTGAAGGAGC3′;下游:5′GAGACAGGAGGCAAGG3′(145 bp);TGF-β1 引物序列:上游:5′GGTGGACCGCAACAACG3′;下游:5′TGAGCACTGAAGCGAAAGC3′(327 bp);β-actin 引物序列:上游:5′CGTGCGTGACATTAAAGAG3′;下游:5′TTGCCGATAGTGATGACCT 3′(132 bp)。
1.3 統計學分析
采用SPSS 16.0統計軟件進行統計學處理。計量資料用x±s表示,組間比較采用單因素方差分析。P<0.05為差異有統計學意義。
2 結果
2.1 RPMC的培養和鑒定
培養的RPMC呈多邊形、菱形、橢圓形,大小不等。細胞融合后,呈典型的鋪路石或鵝卵石樣外觀。傳代后用抗大鼠keratin和抗Ⅷ因子抗體檢測相關抗原,結果顯示:抗大鼠keratin陽性(圖1),抗Ⅷ因子相關抗原陰性(圖2)。
2.2 細胞免疫組化結果
2.2.1 OPN蛋白的表達:正常組細胞形態呈多邊形外觀,細胞貼壁生長狀態良好;LPS組及高糖組細胞形態逐漸由多邊形、鋪路石樣外觀向梭形轉變,細胞生長狀態欠佳,細胞貼壁減少。高糖及LPS聯合作用組細胞生長狀態較前更差,貼壁細胞減少。OPN在正常對照組細胞質中可見少量表達,在高糖或LPS單獨及聯合作用組細胞胞質中的表達則逐漸增強,3組積分光密度均值(高糖組:6.420 0±0.565 6,LPS組:8.416 7±1.758 9,高糖+LPS聯合作用組:20.430 0±1.630 0)與正常組(0.986 7±0.227 0)比較,差異有統計學意義(P<0.01);高糖與LPS單獨作用組間無統計學差異(P>0.05);2者聯合作用組與高糖或LPS單獨作用組比較,差異有統計學意義(P<0.01)。
2.3 Real-time RT-PCR結果
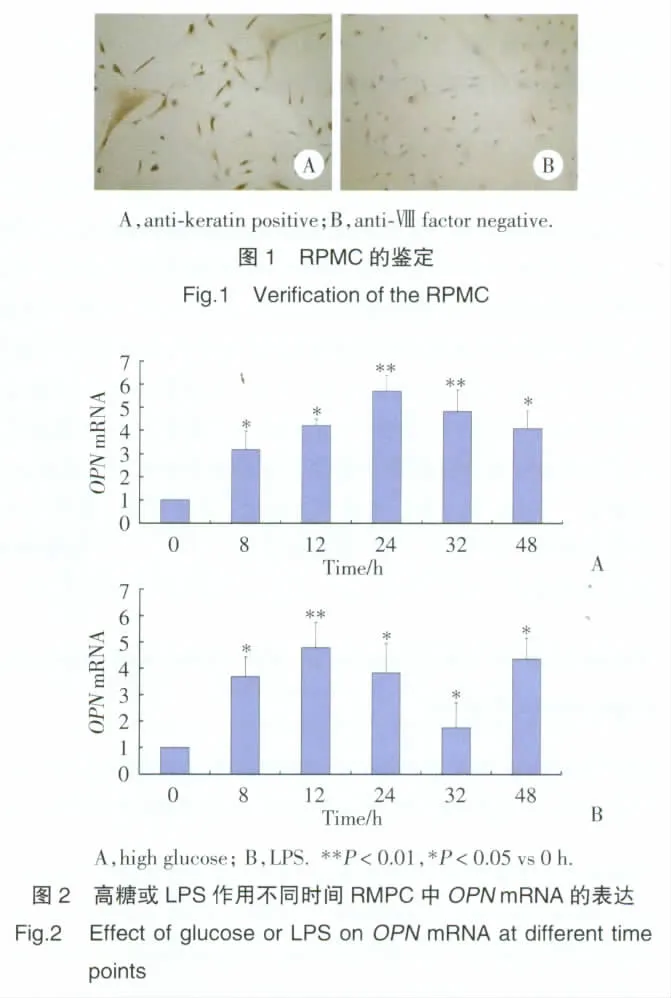
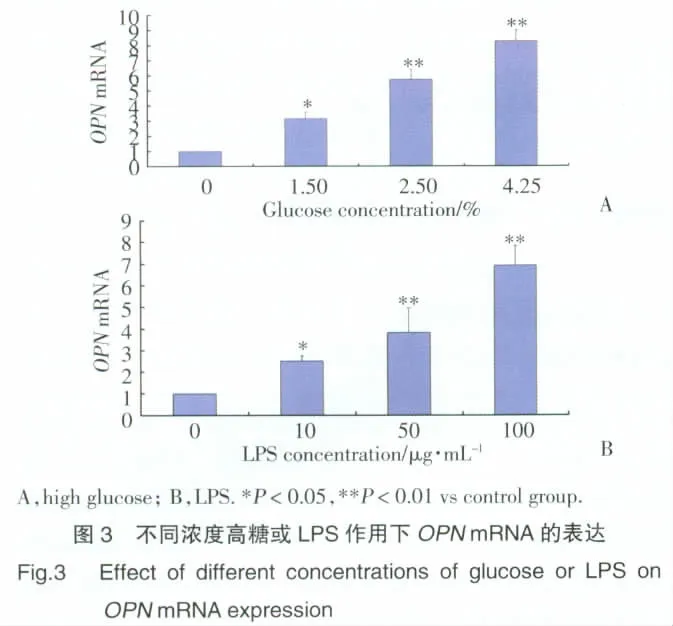
2.3.1 高糖或LPS單獨作用下OPNmRNA表達:(1)不同作用時間:高糖或50 μg/mL LPS單獨作用8~48 h組RPMC中OPNmRNA表達顯著增加,組間比較或與0h組比較,差異有統計學意義(P<0.01,P<0.05),見圖 2。(2)不同作用濃度:1.5%,2.5%,4.25%高糖作用24 h,RPMC中OPNmRNA表達量顯著增高,呈劑量依賴性,組間比較或與正常對照組比較,差異有統計學意義(P<0.05,P<0.01)。0,10,50,100 μg/mL LPS 作用 24 h,RPMC 中 OPNmRNA表達量較正常對照組顯著增高,呈劑量依賴性,差異有統計學意義(P<0.05);10 μg/mL LPS組與 50 μg/mL LPS 組間無統計學差異,50 μg/mL LPS 組與100 μg/mL LPS組間差異有統計學意義(P<0.01)。見圖3。
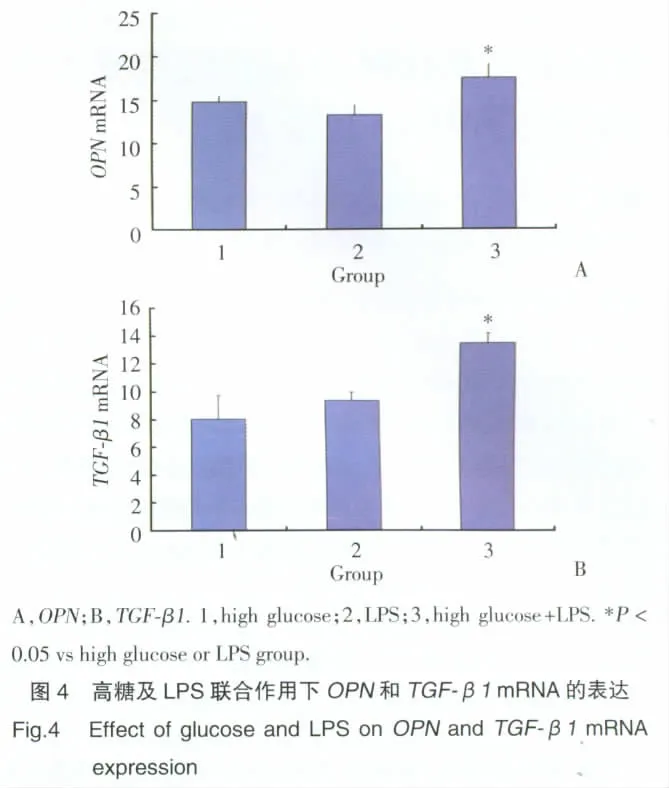
2.3.2 高糖及LPS聯合作用:高糖+LPS聯合作用組RPMC 中,OPN、TGF-β1mRNA 表達較高糖或 LPS單獨作用組顯著增加,差異有統計學意義(P<0.05),單獨作用組間比較無統計學差異。見圖4。
3 討論
腹膜透析是終末期腎衰患者主要替代治療之一。目前應用于臨床的透析液均為非生理適受濃度的高糖腹透液,加之透析過程中常合并革蘭陰性桿菌性腹膜炎,導致腹膜功能不良,加速了腹膜纖維化過程,使患者最終退出治療,限制了腹膜透析在臨床中的應用[2,3]。LPS 是革蘭陰性桿菌的主要成分,PMC作為腹膜的主要構成細胞,在炎癥導致的腹膜纖維化過程中起關鍵作用,研究LPS對PMC的影響是闡明透析致纖維化的病理生理機制中的重要部分。OPN是一種帶負電的分泌性磷酸化糖蛋白,由成骨細胞、破骨細胞、巨噬細胞、T細胞、血管平滑肌細胞、成纖維細胞等細胞分泌,與細胞表面多種整合素受體或CD44異構體結合,介導細胞—細胞、細胞—基質的相互作用,與炎性細胞浸潤及實體組織纖維化等病理過程有關[4~6]。
本研究通過觀察高糖及LPS作用下RPMC中OPN表達的時間關系和量效曲線,發現在高糖、LPS的作用下,RPMC細胞質中OPN表達顯著增加,同時,RPMC的形態逐漸由鋪路石狀向長梭形轉變。目前,已證實MAPK超家族等多條信號通路參與了OPN的調控過程,我們推斷LPS可能是通過上調IL-1β在細胞中的表達,高糖則通過激活MAPK、NF-κB等通路,使OPN表達增強,從而啟動下游纖維化過程。
在細胞纖維化變性過程中,TGF-β1的激活被認為是病程進展的標志點。本研究結果顯示:在高糖、LPS作用下,TGF-β1呈上調趨勢。既往研究發現,OPN大量表達促進了巨噬細胞的趨化聚集,而活化的巨噬細胞通過產生TGF-β、血小板源性生長因子、IL-1、成纖維細胞生長因子等促進成纖維細胞增殖活化,從而導致細胞間質纖維化[7]。文獻報道,TGF-β1下游信號蛋白Smad3與OPN基因啟動子結合,Smad4與阻遏蛋白結合并使之移位,從而促使OPN mRNA轉錄,OPN可能是TGF-β的下游分子,參與TGF 介導的病變[6]。
綜上所述,OPN是腹透相關性纖維化進程中重要的參與者,腹透相關性腹膜炎過程中高糖及LPS可能通過同一通路疊加作用,加速細胞基質纖維化過程。OPN與TGF-β1形成網絡,互相促進,加速了纖維化進程。因此,阻斷OPN在腹膜的表達可能對腹膜纖維化具有潛在的治療價值。
[1]李志明,馬健飛,趙鋼.高糖和脂多糖對腹膜間皮細胞己糖激酶活性的調節作用[J].中國醫科大學學報,2007,36(2):206-208.
[2]Davies SJ,Phillips L,Naish PF,et al.Peritoneal glucose exposure and changes in membrane solute transport with time on peritoneal dialysis[J].J Am Soc Nephrol,2001,12(5):1046-1051.
[3]Jiang F,Parsons CJ,Stefanovic B.Gene expression profile of quiescen and activated rat hepatic stellate cells implicates Wnt signaling pathway in activation[J].J Hepatol,2006,45(3):401-409.
[4]張宏華,鄧春燕,黃偉玉,等.骨橋蛋白在肺纖維化患者的表達及醋酸潑尼松對其影響[J].臨床肺科雜志,2011,16(5):116-118.
[5]何遠橋,林其玲,劉慶,等.坎地沙坦對單側輸尿管梗阻大鼠腎間質纖維化及腎臟骨橋蛋白表達的影響[J].中華實驗外科雜志,2010,12(10):1504-1506.
[6]苗靜,王鵬,李榮芬.骨橋蛋白與腎間質纖維化[J].中國中西醫結合腎病雜志,2007,8(1):60-62.
[7]Henke C,Marineili W,Jessurun J,et al.Macrophage production of basic fibroblast growth factor in the fibroproliferative disorder of alveolar fibrosis after lung injury[J].Am J Pathol,1993,143(4):1189-1199.

