響應面法優(yōu)化富馬酸喹硫平緩釋片處方
沈艷,任麗莉,王丞,陳建龍,陳國廣(南京工業(yè)大學藥學院,南京2 1 1 8 1 6)
響應面法優(yōu)化富馬酸喹硫平緩釋片處方
沈艷*,任麗莉,王丞,陳建龍,陳國廣#(南京工業(yè)大學藥學院,南京2 1 1 8 1 6)
目的:優(yōu)化富馬酸喹硫平緩釋片處方。方法:以累積釋放度綜合評分作為響應值,采用3因素3水平的響應面法,確定富馬酸喹硫平緩釋片處方中羥丙甲纖維素(HPMC)的黏度、用量與枸櫞酸鈉、乳糖的用量,并探討其體外釋藥機制。結果:骨架材料選擇HPMC K1 5 M,考慮到實際操作便利確定其用量為1 3.5%,枸櫞酸鈉用量為9.5%,乳糖用量為1 4%。緩釋片體外釋放符合Higuchi方程,釋藥機制為擴散和溶蝕并存的雙重機制。結論:篩選所得的富馬酸喹硫平緩釋片處方工藝穩(wěn)定可行,有一定的緩釋作用。
富馬酸喹硫平;緩釋片;制備;響應面法;累積釋放度
富馬酸喹硫平是一種新型的非典型抗精神病藥,與傳統的抗精神病藥物相比,不但對精神分裂癥的陽性癥狀有效,對陰性癥狀和重度抑郁癥也同樣有效;同時富馬酸喹硫平還具有改善認知功能的作用,且錐體外系不良反應(EPS)發(fā)生率低[1],是治療精神分裂癥的臨床一線用藥。富馬酸喹硫平是一種弱酸性藥物,在冰醋酸中易溶,在甲醇或乙醇中微溶,在水中幾乎不溶,溶解度隨著pH增加而降低,半衰期約7 h[2];普通片每日需給藥2~3次,易造成血藥濃度的波動并增加不良反應的發(fā)生。因此,為了提高富馬酸喹硫平的生物利用度,延長給藥時間,平穩(wěn)血藥濃度,增加患者順從性,有必要將其制成緩釋制劑。目前,國外已有富馬酸喹硫平緩釋片(Seroquel XR,思瑞康XR)上市,但國內外均尚未見其緩釋制劑制備工藝方面的報道。本研究以羥丙基甲基纖維素(HPMC)為基本骨架材料,結合其他輔料制備日服1次的富馬酸喹硫平緩釋片,并對其累積釋放度進行考察。
1 儀器與試藥
DP3 0單沖壓片機(北京國藥龍立科技有限公司);7 5 4型紫外-可見分光光度計(上海恒平科技有限公司);YD-2 0片劑硬度儀(天津市天大天發(fā)科技有限公司);ZRS-8 G智能溶出實驗儀(天津大學無線電廠);PH0 3 0恒溫干燥箱(上海實驗儀器廠有限公司)。
富馬酸喹硫平原料藥(江蘇恩華藥業(yè)股份有限公司,批號:2 0 1 0 0 3 0 4,含量:9 8%);富馬酸喹硫平對照品(蘇州醫(yī)藥集團有限公司,批號:0 4 1 0 1 5,純度:9 9.9%);富馬酸喹硫平緩釋片(進口,英國AstraZeneca公司,商品名:思瑞康,規(guī)格:每片3 0 0 mg);富馬酸喹硫平緩釋片(南京工業(yè)大學藥物研究所自制,批號:2 0 1 1 0 6 0 7、2 0 1 1 0 6 1 2、2 0 1 1 0 6 1 7,規(guī)格:每片8 0 0mg,含富馬酸喹硫平3 0 0 mg);HPMC(K4 M、K1 5 M、K1 0 0 M,美國Dow公司);乳糖(中國惠興生化試劑有限公司);枸櫞酸鈉(中國醫(yī)藥上海化學試劑公司);微晶纖維素、硬脂酸鎂等輔料試劑均為國產藥用級。
2 方法與結果
2.1 分析方法的建立
2.1.1 檢測波長的選擇。取富馬酸喹硫平對照品適量,用脫氣蒸餾水溶解并稀釋成2 0 μg·mL-1的溶液,在2 0 0~4 0 0 nm波長范圍內掃描,結果顯示在2 1 0 nm處有最強吸收峰,次強吸收峰出現在2 5 0 nm和2 9 0 nm處。考慮到2 1 0 nm處屬于末端吸收,作為檢測波長易受其他雜質光的干擾,且測定結果極不穩(wěn)定,而2 9 0 nm作為檢測波長時,靈敏度較差,故選擇2 5 0 nm作為檢測波長。參照主藥的測定濃度,按處方比例制備輔料溶液,濾過,取續(xù)濾液在上述波長范圍內掃描,結果輔料在檢測波長附近無吸收,不干擾主藥。
2.1.2 標準曲線的制備。精密稱取富馬酸喹硫平對照品1 0 mg,置于1 0 0mL量瓶中,加脫氣蒸餾水溶解并稀釋至刻度。分別取0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、5.0 mL,置于1 0 mL量瓶中,加脫氣蒸餾水稀釋至刻度,在2 5 0 nm波長處測定吸光度。結果,以吸光度(Y)對濃度(X)進行線性回歸,得回歸方程:Y=0.0 3 3 X+0.0 1 4 2(r=0.9 9 9 9),表明富馬酸喹硫平在5~5 0 μg·mL-1檢測濃度范圍內線性關系良好。
2.1.3 精密度試驗。按照“2.1.5”項下方法,制備低、中、高濃度(1 6、2 0、2 4 μg·mL-1)的富馬酸喹硫平溶液,在2 5 0 nm波長處測定吸光度,同日內測5次及每天測1次、連續(xù)測5 d。結果日內和日間的平均RSD均<2%,表明本方法精密度好。
2.1.4 穩(wěn)定性試驗。取富馬酸喹硫平對照品適量及處方量輔料,用脫氣蒸餾水制備成2 0 μg·mL-1的樣品溶液,3 7℃放置,0、2、4、8、1 2、1 6、2 4 h取樣,測定溶液的吸光度。結果,在各取樣時間點的吸光度RSD=0.1 1%,表明供試品溶液在2 4 h內基本穩(wěn)定。
2.1.5 回收率試驗。精密稱取富馬酸喹硫平對照品8、1 0、1 2 mg各3份,同時按處方比例稱取輔料,分別置于1 0 0 mL量瓶中,加脫氣蒸餾水溶解并稀釋至刻度,搖勻,濾過。精密量取續(xù)濾液2 mL,置于1 0 mL量瓶中,加脫氣蒸餾水溶解并稀釋至刻度,制成相當于含量測定濃度8 0%、1 0 0%、1 2 0%的3種溶液,在2 5 0 nm的波長處分別測定吸光度,按對照品比較法計算富馬酸喹硫平的含量。結果低、中、高濃度的RSD分別為0.8 5%、0.9 3%、0.9 5%(n=6),表明方法準確度良好,片劑中的輔料不影響主藥的測定。
2.1.6 釋放介質的選擇。分別以水、0.1 mol·L-1鹽酸溶液、pH 6.8磷酸鹽緩沖液作為釋放介質,采用2 0 1 0年版《中國藥典》二部附錄ⅩC第一法籃法[3]。取本品,分別以水、0.1 mol·L-1鹽酸溶液、pH 6.8磷酸鹽緩沖液9 0 0 mL作為釋放介質,溫度3 7℃,轉速1 0 0 r·min-1,依法操作,于第1、2、4、6、8、1 2、2 4 h分別取樣5 mL,同時補充5 mL介質,過濾,稀釋,用紫外分光光度法測定其吸光度,并代入標準曲線計算累積釋放度。結果,富馬酸喹硫平緩釋片在水、0.1 mol·L-1鹽酸溶液、pH 6.8磷酸鹽緩沖液中的累積釋放度基本無差別;鑒于水能更好地滿足漏槽條件,故選擇水為釋放介質。
2.1.7 轉速的選擇。以水為釋放介質,參照“2.1.6”項下方法,分別選擇轉速5 0、1 0 0、1 5 0 r·min-1,于1、2、4、6、8、1 2、2 4 h分別取樣,測定緩釋片的累積釋放度。結果表明,轉速為5 0 r·min-1時釋放速度最慢,而1 0 0 r·min-1和1 5 0 r·min-1時藥物釋放速度差異不大,且均能滿足累積釋放度測定的要求。參考思瑞康XR的累積釋放度測定條件,因此選擇1 0 0 r·min-1作為測定本品累積釋放度的轉速。
2.2 緩釋片的制備
取處方量的富馬酸喹硫平原料藥、HPMC、枸櫞酸鈉、乳糖、微晶纖維素,過8 0目篩,混勻。采用7 5%乙醇溶液制備軟材,2 0目篩制粒,6 0℃干燥2 h,1 6目篩整粒,加硬脂酸鎂作潤滑劑,壓片。富馬酸喹硫平含量為3 0 0 mg,片重為8 0 0 mg。
2.3 處方篩選及制備工藝
2.3.1 制粒方式的選擇。分別以濕法制粒壓片與粉末直接壓片2種工藝制備緩釋片,其中濕法制粒壓片參見“2.2”項,粉末直接壓片工藝為:按處方取已過篩的富馬酸喹硫平原料藥與輔料混勻,壓制即得。結果顯示,濕法制粒壓片釋放平穩(wěn),重現性好;粉末直接壓片,骨架破裂快,釋放過快,緩釋效果不佳,而且在壓片過程當中,粉塵較多,給生產帶來不便,且制得的片劑表面不夠平滑。因此選擇濕法制粒壓片。
2.3.2 片劑硬度對體外釋放的影響。調節(jié)壓片機的壓力,照“2.2”項下方法制備,所得緩釋片硬度分別為8、1 0、1 2 kgf。考察上述片劑的累積釋放度,結果表明片劑硬度在8~1 2 kgf范圍內對藥物釋放無顯著影響,因此選擇片劑硬度為8~1 2 kgf。
2.3.3 不同黏度的HPMC對體外釋放的影響。選用不同規(guī)格的HPMC,即K4 M、K1 5 M、K1 0 0 M,用量均為片質量的2 0%,其他輔料均相同,測定制得的富馬酸喹硫平緩釋片在不同時間的累積釋放度。結果表明,HPMC黏度不同對緩釋片累積釋放度影響較大,隨著HPMC黏度增加釋放速度逐漸降低,其釋放速度為K4 M>K1 5 M>K1 0 0 M,K1 5 M的釋放行為與設計釋放行為較為接近,但釋放行為仍需進一步調整。
2.3.4 HPMC的用量對體外釋放的影響。分別以片重1 0%、2 0%、3 0%的HPMC K1 5 M為骨架材料,乳糖1 5%,枸櫞酸鈉1 0%,硬脂酸鎂2%,保持含藥量和片重不變,缺少質量以微晶纖維素補足,照“2.2”項下方法制備緩釋片,考察各片在不同時間的累積釋放度。結果表明,不同用量的HPMC對緩釋片中藥物的釋放影響較大,當固定處方中其他因素,隨著HPMC K1 5 M的用量的增大,片劑的釋放速度逐漸變慢。
2.3.5 pH調節(jié)劑枸櫞酸鈉對體外釋放的影響。分別以片重5%、1 0%、1 5%的枸櫞酸鈉作為pH調節(jié)劑,HPMC K1 5 M 2 0%,乳糖1 5%,硬脂酸鎂2%,保持含藥量和片重不變,缺少質量以微晶纖維素補足,照“2.2”項下方法制備緩釋片,考察各片不同時間的累積釋放度。結果表明,不同用量的枸櫞酸鈉對藥物釋放影響較大,可能富馬酸喹硫平在酸性溶液中溶解度較大,加入枸櫞酸鈉則增大了片劑片芯的pH,因而降低了片芯的溶解性以及降低了擴散釋放。
2.3.6 不同用量乳糖對體外釋放的影響。以2 0%的HPMC(K1 5 M)作為骨架材料,以乳糖為致孔劑使其占片重的5%、1 5%、2 5%,枸櫞酸鈉1 0%,硬脂酸鎂2%,保持含藥量和片重不變,缺少質量以微晶纖維素補足,照“2.2”項下方法制備緩釋片,考察各片不同時間的累積釋放度。結果表明,選用不同用量乳糖對緩釋片前期累積釋放度有明顯影響。
2.3.7 響應面試驗及設計。在上述單因素考察基礎上,采用響應面法對處方作進一步篩選,以優(yōu)化處方。確定影響富馬酸喹硫平緩釋片制備的主要因素為HPMC K1 5 M的用量(A)、枸櫞酸鈉的用量(B)、乳糖的用量(C)。上述3個因素分別選擇3個水平,根據Box-Benhnken中心組合試驗設計原理[4],按照制備工藝制備緩釋片,依照釋放度測定方法測定緩釋片于1、6、1 2、2 4 h的累積釋放度。因素水平見表1。

表1 因素水平表Tab 1 Factors and levels
為準確、詳細地反映各因素的不同水平對藥物釋放行為的影響,本文以國外同類產品的累積釋放度作為參考標準[5],采用綜合評分法,對各處方1、6、1 2、2 4 h的釋放度進行評分,將評分結果進行加權相加后得出總分,最后結合響應面法進行分析。評價指標如下:(1)藥物1 h的累積釋放度F1;(2)藥物6 h的累積釋放度F6;(3)藥物1 2 h的累積釋放度F12;(4)藥物2 4 h的累積釋放度F24;其中1、6、1 2、2 4 h的累積釋放度分別是1 0%、5 8%、8 0%、1 0 0%,將各指標的權重系數定為1,得計算公式:L=│F1-0.1│×1×1 0 0+│F6-0.5 8│×1×1 0 0+│F12-0.8 0│×1×1 0 0+│F24-1.0 0│×1×1 0 0。其中,L值越小,結果越佳[6,7]。同時考察片劑的外觀,優(yōu)選處方。試驗設計見表2。
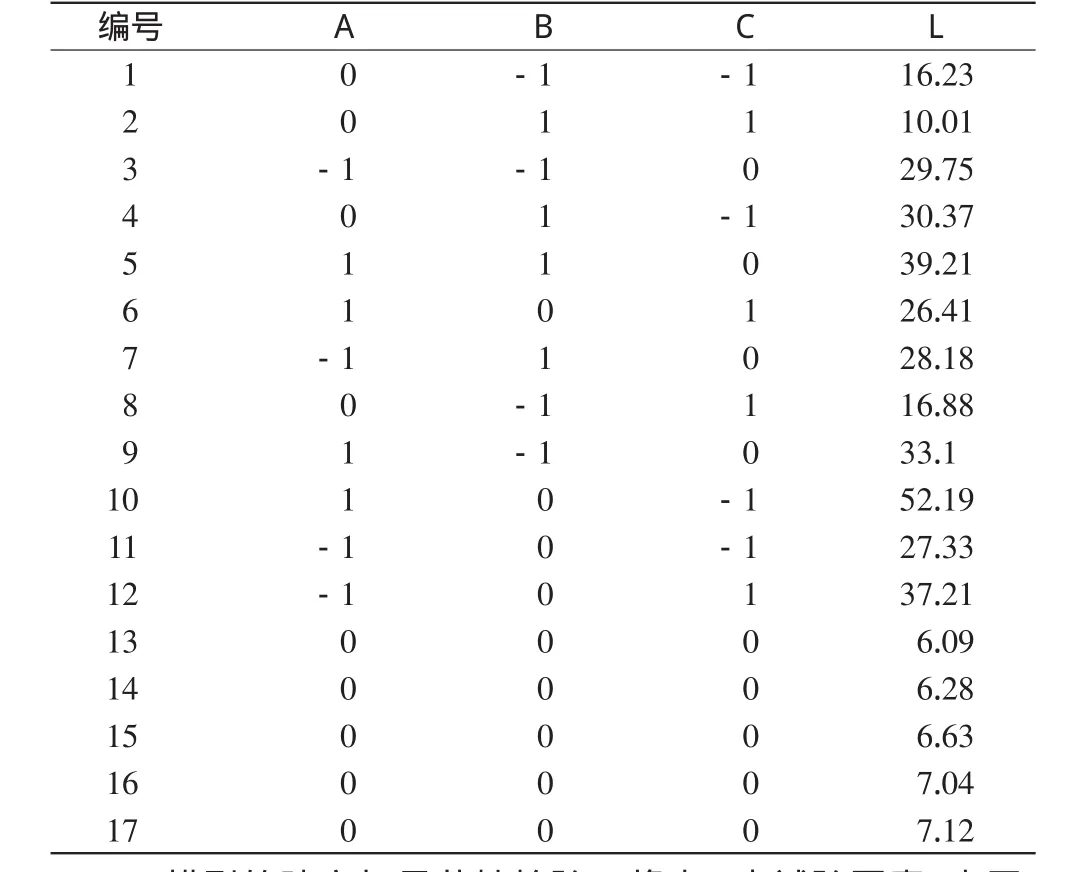
表2 中心組合試驗設計及響應值表Tab 2 Central composite design and response value
2.3.8 模型的建立與顯著性檢驗。將表2中試驗因素、水平、試驗結果用Design expert 8.0統計軟件進行處理,以綜合評分指標對A、B、C的各水平進行多元線性擬合,回歸方程方差分析見表3。
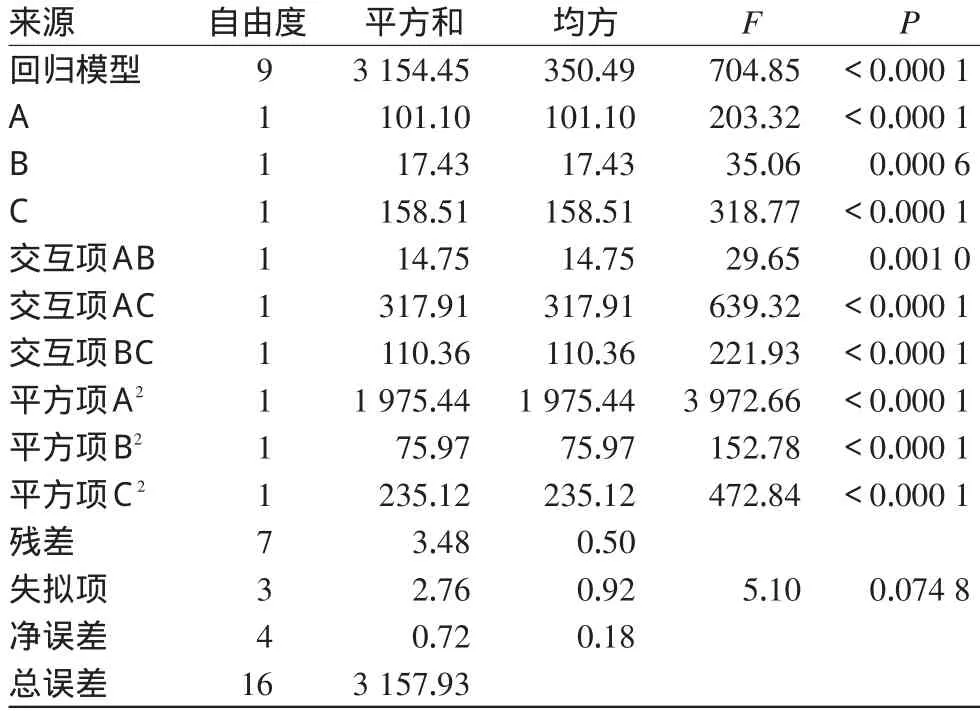
表3 回歸方程方差分析Tab 3 Variance analysis of regression equation
由表3結果表明,一次項、二次項及各交互項影響均達極顯著水平。擬合方程為:L=6.6 5+3.5 6 A+1.4 8 B-4.4 5 C+1.9 2 AB-8.9 2 AC-5.2 5 BC+2 1.6 6 A2+4.2 5 B2+7.4 7 C2。
該方程相關系數r=0.9 9 8 9,修正相關系數為0.9 9 7 5,表明該模型擬合良好,實測值與方程預測值有高度相關性;失擬項(P=0.0 7 4 8)不顯著,說明該模型選擇合理,因此可以用回歸方程對處方工藝進行預測和分析。
2.3.9 響應面分析與最優(yōu)水平的確定。根據回歸方程,運用Design expert 8.0統計軟件作出響應面分析立體圖,見圖1。
結合響應面模型分析可知,富馬酸喹硫平緩釋片的最佳處方工藝為:HPMC K1 5 M質量分數為片重的1 3.5 3%,枸櫞酸鈉為9.4 7%,乳糖為1 3.7 3%。考慮到實際操作的便利性,確定處方工藝為:HPMC K1 5 M質量分數為片重的1 3.5%,枸櫞酸鈉為9.5%,乳糖為1 4%,由回歸方程預測綜合評分L為7.0 1。
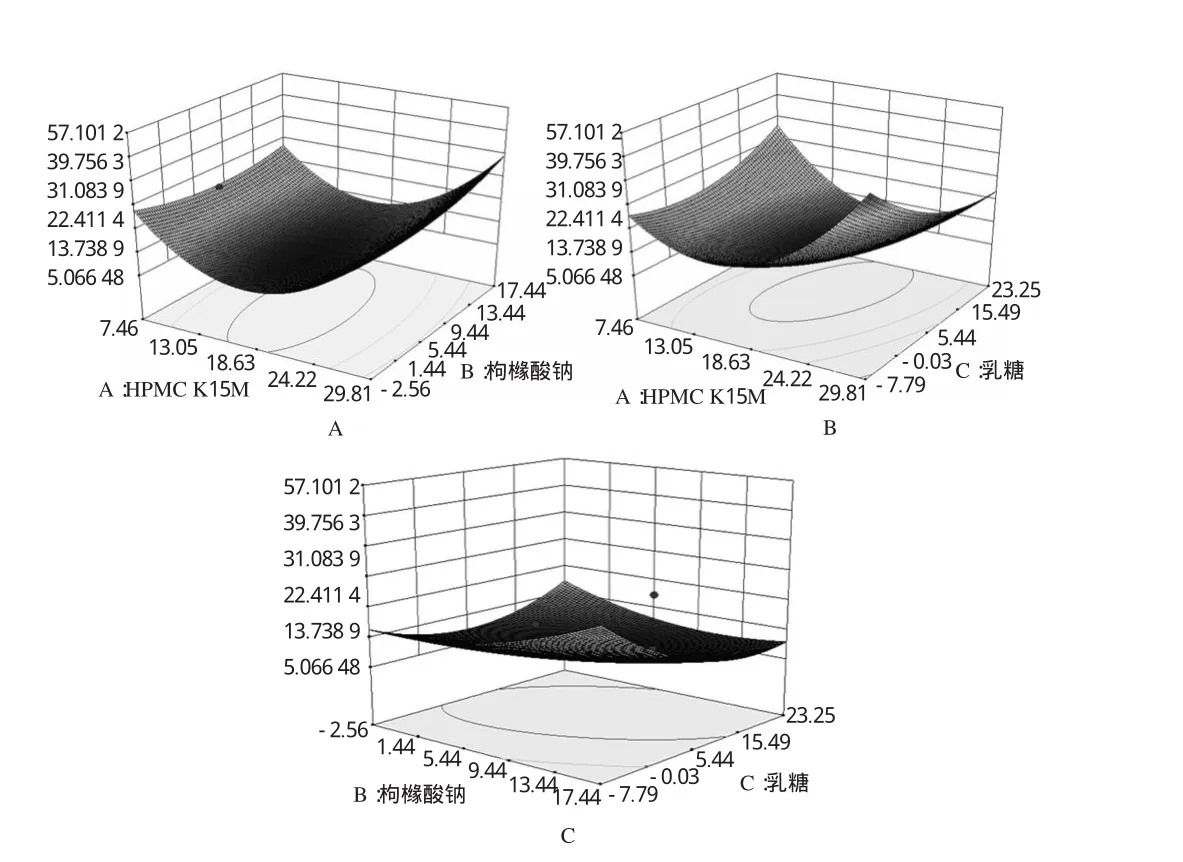
圖1 響應面圖A.HPMC K1 5 M用量;B.枸櫞酸鈉用量;C.乳糖用量Fig 1 Response surface plot A.HPMC K1 5 M amount;B.natrium citricum amount;C.lactose amount
2.3.1 0 驗證試驗。采用上述優(yōu)化處方條件,制備3批緩釋片,分別在水、0.1 mol·L-1鹽酸溶液、pH 6.8磷酸鹽緩沖液中測定釋放度,以相似因子法f2=5 0 lgRt-T)t2]-0.5×1 0 0}(式中,f2是擬合因子;Rt為t時間參比樣品的釋藥量;Tt為t時間受檢樣品的釋藥量;n為取樣點個數;Wt為權重因子)考察3批樣品與進口緩釋片釋放曲線的相似性。自制樣品與進口緩釋片在不同釋放介質中的釋放曲線見圖2。
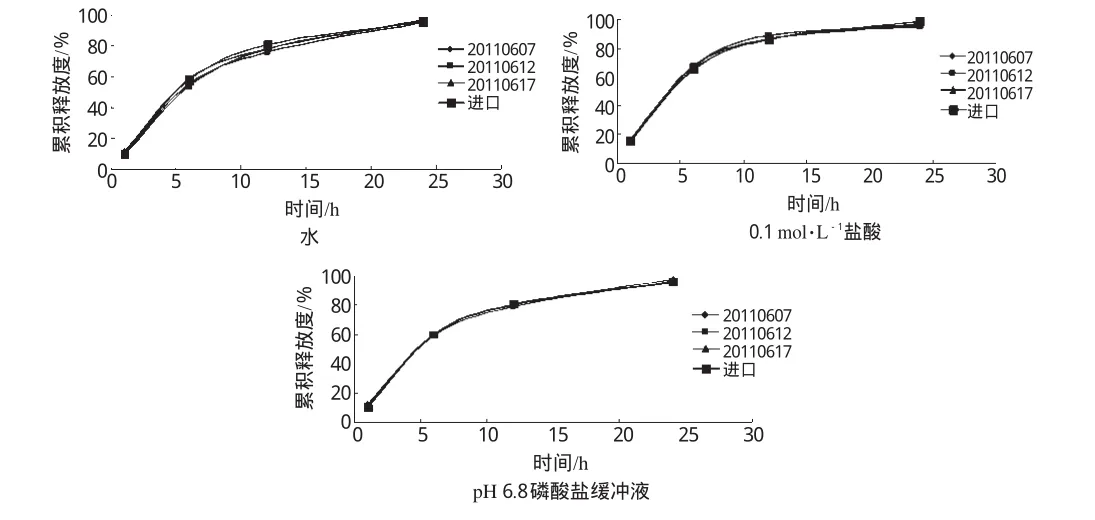
圖2 自制樣品與進口緩釋片在不同釋放介質中的釋放曲線Fig 2 Drug release profiles of sustained-release tablets and self-made tablets in different release media
由圖2結果顯示,按照響應面法優(yōu)化的處方制備的緩釋片與進口緩釋片在水、0.1 mol·L-1鹽酸溶液、pH 6.8磷酸鹽緩沖液3種釋放介質中釋放曲線之間f2值均>5 0,表明擬合性方程預測性良好,自制緩釋片與進口緩釋片無顯著差異,工藝重現性好。
2.3.1 1 富馬酸喹硫平緩釋片的釋放行為。對“2.3.1 0”項下制得的3批富馬酸喹硫平緩釋片測定累積釋放度,并對其進行釋放模型擬合,結果見表4。

表4 釋放行為擬合釋藥方程(n=3)Tab 4Fitted release equation of drug release behavior(n=3)
由表4結果表明,富馬酸喹硫平緩釋片的釋放行為較好地符合Higuchi方程。半經驗方程(Ritger-Peppas)為Q=0.7 7 7 9 t-0.9 5 0 7(r=0.9 8 5 8),對于圓柱形制劑,當方程系數>0.4 5且<0.8 9時,藥物的釋放為非Fick擴散的原理,即擴散與溶蝕并存[8],故本制劑的體外釋放行為是藥物擴散與骨架溶蝕雙重機制。
3 討論
本試驗中采用的黏合劑和潤滑劑用量相對較少,所以對釋放度影響不大。通過對單因素確定的顯著影響因素進行響應面試驗及分析可知,HPMC K1 5 M用量、枸櫞酸鈉用量、乳糖用量及各因素的交互作用對釋放度綜合評分影響顯著。通過試驗驗證優(yōu)化所得處方,釋放度綜合評分符合要求,說明該方法直觀、精密、預測性良好。
[1] McConville BJ,Arvanitis LA,Thyrum PT,et al.Pharmacokinetics,tolerability,and clinical effectiveness of quetiapine fumarate:an open-label trial in psychotic disorders[J].J Clin Psychiatry,2 0 0 0,6 1(4):2 5 2.
[2] Nemeroff CB,Kinkead B,Goldstein J.Quetiapine:preclinical studies,pharmacokinetics,drug interactions,and dosing[J].J Clin Psychiatry,2 0 0 2,6 3(Suppl 1 3):5.
[3] 國家藥典委員會.中華人民共和國藥典(二部)[S].2 0 1 0年版.北京:中國醫(yī)藥科技出版社,2 0 1 0:附錄ⅩC.
[4] 謝 捷,李紅娟,鄭興宗,等.響應面法優(yōu)化厚樸酚及和厚樸酚的閃式提取工藝的研究[J].林產化學與工業(yè),2 0 1 0,3 0(4):2 0.
[5] 丹尼爾·布朗唐娜·卡斯特,布賴恩·克拉克桑德拉·霍普金斯,詹妮弗·盧埃林莉薩·馬丁,等.包含喹硫平的延釋組合物及其制備方法[P].中國:1 0 1 7 5 4 7 5 2 A,2 0 1 0-0 6-2 3.
[7] 龍明立,賀麗平,曾建國.復方阿侖膦酸鈉緩釋片的制備及體外釋放度考察[J].中國藥房,2 0 0 8,1 9(3 4):2 6 9 0.
[8] 梁文權.生物藥劑學與藥物動力學[M].第4版.北京:人民衛(wèi)生出版社,2 0 0 8:3 8.
Optimization of the Formulation of Fumarate Quetiapine Sustained-release Tablets by Response Surface Methodology
SHEN Yan,REN Li-li,WANG Cheng,CHEN Jian-long,CHEN Guo-guang
(School of Pharmacuetical Science,Nanjing University of Technology,Nanjing 2 1 1 8 1 6,China)
OBJECTIVE:To optimize the formulation of Fumarate quetiapine sustained-release tablets.METHODS:Using comprehensive score of the cumulate release rate behavior as response value,response surface methodology of 3factors and 3levels was used to determine the viscosity and dosage of HPMC and the dose of natrium citricum and lactose,and to explore drug release mechanism in vitro.RESULTS:HPMC K1 5 M was selected as framework material,and the dosage of it was 1 3.5%;the doses of sodium citrate and lactose were 9.5%and 1 4%.Sustained-release tablets in vitro release fitted to the Higuchi equation,the release behavior in vitro is diffusion combined with corrosion.CONCLUSION:The optimized preparation process of Fumarate quetiapine sustained-release tablet is stable,feasible and the tablets have sustained-release behavior.
Fumarate quetiapine;Sustained-release tablets;Preparation;Response surface methodology;Cumulate release rate
R9 7 1+.4 1;R9 4 4.4
A
1 0 0 1-0 4 0 8(2 0 1 2)3 3-3 1 0 8-0 4
DOI1 0.6 0 3 9/j.issn.1 0 0 1-0 4 0 8.2 0 1 2.3 3.1 4
*碩士研究生。研究方向:藥物制劑。E-mail:fenghuayan4 2 3 5 1 0@1 6 3.com
#通訊作者:教授。研究方向:藥劑學、新劑型和新技術。電話:0 2 5-5 8 1 3 9 4 1 6。E-mail:guoguangchen@1 6 3.com
2 0 1 1-0 9-2 6
2 0 1 1-1 0-1 9)
*副教授,博士。研究方向:藥物新劑型研究與開發(fā)。電話:0 2 8-6 8 2 8 9 1 9 2。E-mail:xoxoho@1 6 3.com

