1991-2010年26個撤市藥品分析
馮柳,曹晨,于元元,胡元佳,王一濤(澳門大學中華醫藥研究院/中藥質量控制國家重點實驗室,澳門)
1991-2010年26個撤市藥品分析
馮柳*,曹晨,于元元,胡元佳,王一濤#(澳門大學中華醫藥研究院/中藥質量控制國家重點實驗室,澳門)
目的:分析撤市藥品,為制藥企業保證產品在市場的穩定性提供參考。方法:對由艾美仕市場研究公司及美國FDA 1991-2010年公布的26個撤市藥品進行治療類別,藥品研發過程中的合作、并購、專利情況,不同時間撤市藥品的數量,退市時間與替代藥品注冊時間的分析。結果與結論:治療類別對撤市藥品的影響并不明顯,專利與合作經營已經不再能保證產品在市場的穩定性。嚴格的藥品安全監管體制、副作用小且療效較好的替代藥品是影響藥品撤市的主要原因。
撤市藥品;監管;藥品替代;原因分析
2010年,湯姆森路透社旗下國際醫藥研究公司(CMR)國際研究中心公布的數據顯示,過去10年間,新藥研發費用每年呈6.3%的增長,5年內上市的新藥的銷售占比跌至7%[1]。可見,新藥的研發費用越來越高,而實際產出水平卻在下降。與此同時,撤市藥品的數量卻與之呈現相反的逐年遞增的趨勢。根據醫藥行業權威數據公司艾美仕市場研究公司(IMS Health Inc)及美國FDA公布的數據,1991-2010年全球共有26個藥品撤市。盡管撤市藥品數量并不龐大,然而,近年來的撤市藥品數量相較于往年已經有明顯的提升。僅2010年,被強制撤市的藥品數量已經高達5個。2009年輝瑞制藥推出的藥品Exubera僅上市1年就被強制撤出市場[2]。藥品撤市不僅難以實現制藥企業預期的利潤收入,更難以負擔研發過程中的高昂費用,給制藥企業帶來了巨大的損失。
盡管藥品被強制撤市的原因均是由于藥品安全性等問題,但是所有藥品在上市之前,均已在Ⅰ、Ⅱ、Ⅲ期臨床試驗中對其安全性進行了監測。換句話說,也就是藥品在上市時已經將副作用控制在一定范圍內,但是卻由于同樣的原因遭到強制撤市。為此,本文深入分析撤市藥品,以期幫助制藥企業在藥品研發過程中明確研究方向、把握研究節奏、避免研究風險,為制藥企業保證產品在市場的穩定性提供參考。
1 數據來源
為保證數據的準確性,本文所用數據來源于IMS Health Inc及FDA所公布的官方信息。
2 研究方法
本文對1991-2010年26個撤市藥品進行分析,包括藥品的治療類別,藥品研發過程中的合作、專利和并購情況,不同時間撤市藥品的數量,以及退出時間與替代藥品注冊時間的關系。
3 結果
3.1 藥品的治療類別情況
對26個撤市藥品的治療類別進行統計分析,結果見圖1。
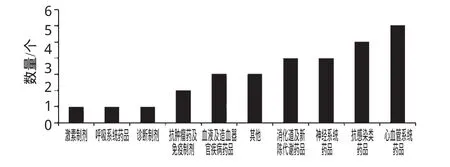
圖1 26個撤市藥品治療類別情況Fig 1 Classification of 26kinds of drugs for withdrawal therapeutic areas
由圖1可知,26個撤市藥品的治療類別呈現一定的集中趨勢。消化道及新陳代謝類藥品、神經系統藥品分別占總數的15%,抗感染類藥品占總數的19.2%,心血管系統藥品排名第1,占總數的23.1%。這4個主要治療類別的藥品占總數的72.3%。
為深入探討治療類別對藥品撤市的影響,本文另外對2001-2010年通過審批的226個新藥的治療類別進行統計分析,結果見圖2。

圖2 2001-2010年通過審批的新藥治療類別情況Fig 2Classification of approved new drugs for therapeutic areas during 2001-2010
由圖2可知,226個新藥的治療類別呈現與撤市藥品相同的趨勢,主要類別為抗感染類藥品、抗腫瘤藥及免疫制劑、神經系統藥品、消化道及新陳代謝藥品,這4大類別藥品占總數的57.52%。
3.2 藥品研發過程中合作、專利和并購情況
為探討是否由于研發過程中的產品維護缺陷造成藥品在上市后缺乏競爭力,從而導致藥品撤市,本文進一步對26個撤市藥品在研發過程中的合作、專利和并購情況進行了分析,結果見圖3。

圖3 26個撤市藥品在研發過程中的合作、并購和專利情況Fig 3 Cooperation,M&A and patents situation during the R&D process of 26kinds of withdrawal drugs
由圖3可知,69.2%的撤市藥品在研發過程中選擇了與其他企業合作,即采取授權的方式進行藥品銷售;84.6%的撤市藥品擁有專利權;只有19.2%撤市藥品的制藥企業在產品上市之后發生過并購行為。
3.3 不同時間撤市藥品的數量
為探討藥品退市時間與撤市藥品數量之間的關系,對26個撤市藥品退市時間進行分析,除藥品TECZEM的退市時間無法確定之外,另外25個撤市藥品在1991-2010年的退市時間分布情況見圖4。
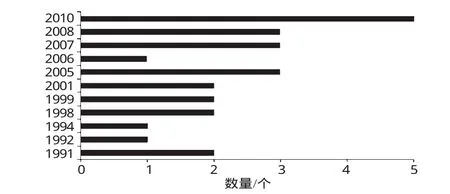
圖4 25個撤市藥品在1991-2010年的退市時間分布情況Fig 4 Delisting time distribution of 25kinds of withdrawal drugs during 1991-2010
由圖4可知,撤市藥品數量的增加發生在2005年及之后的時間里,相比1991-1999年有8個藥品撤市,2000-2004年中僅2001年有2個藥品撤市,在2005-2010年撤市藥品數量高達15個,是過去15年的1.5倍。
3.4 替代藥品對撤市藥品的影響
藥品撤市的另外一個原因即替代藥品對撤市藥品的影響。本文的替代藥品定義為使用藥品小分類,即藥品的解剖學、治療學及化學分類系統(ATC),確定藥品在治療效果上具有相似作用。本文所選取的替代藥品,需精確到ATC編碼下3位,例如,磷丙泊酚鈉的ATC編碼為NB5,意味著該藥品屬于N類(神經系統用藥)→N5(精神阻滯藥)→N5B(催眠藥、鎮靜藥)。為進一步探究替代藥品對撤市藥品的影響,將替代藥品分為銷售額優勢和銷售增長優勢替代藥品,前者即在同一治療類別中銷售額最大的藥品,后者是指在同一治療類別下全球銷售排名前20的藥品中增長速度最快的藥品。
在研究過程中,進一步通過IMS Health Inc數據庫查詢銷售額優勢替代藥品和銷售增長優勢替代藥品的注冊時間和在FDA或歐洲藥品審評署(EMEA)的注冊時間,共計4組時間,分別與撤市藥品的退市時間進行皮爾森相關分析。結果,撤市藥品的退市時間與銷售額優勢替代藥品、銷售增長優勢替代藥品的注冊時間均無明顯差異,即表明替代藥品注冊時間與撤市藥品的退市時間可理解為相同時間。
4 討論
4.1 治療類別對藥品撤市的影響
撤市藥品主要集中在消化道及新陳代謝類藥品、神經系統藥品、抗感染類藥品、心血管系統藥品。但是,由于審批通過的新藥治療類別也同樣集中在這4類藥品,表明治療類別對藥品撤市的影響并不明顯。
4.2 藥品的合作、并購、專利對撤市藥品的影響
現今的制藥企業通過各種途徑以確保藥品的競爭力,這些途徑包括藥品在研發過程中與其他廠商的合作,通過授權的方式將自身企業研發的藥品委托其他廠商進行銷售;也包括在研發過程中,對產品進行專利保護:很多產品在產品線初期已經注冊專利,或者有部分產品是在已經獲得專利的基礎之上進行劑型的修正,例如衛材制藥在2009年通過審批的藥品磷丙泊酚鈉注射液早在1998年即由美國堪薩斯州立大學申請并獲得專利。同時,制藥行業的并購趨勢在當今已成為行業中為擴充產品線、分擔風險的主要戰略。
對撤市藥品的分析發現,這些藥品所在企業選擇了通過授權的方式進行銷售,這種合作率高達69.2%;同時,撤市藥品中84.6%的藥品在研發過程中已經獲得了專利。盡管如此,這些藥品仍然難以逃脫撤市的命運。專利及合作經營已經不再是保護產品在市場保持穩定的保護傘。同時,含有撤市藥品的企業更不容易被并購,證明并購前在企業的評估中,對產品的審核比較準確。
4.3 監管制度對藥品撤市的影響
21世紀初,新藥安全成為美國參、眾兩議院及公眾關注的焦點,其導火索是默克公司新一代關節鎮痛藥Vioxx的撤市。然而更加關鍵的是,Vioxx的治療風險不是由FDA通過現有新藥上市后安全監控機制獲得,而是由默克公司自己發現主動撤市的,而FDA在這個過程中未起到任何作用。
2005年美國政府通過Grassley-Dodd提案,提出建立獨立于FDA的藥物安全辦公室,給FDA更大的權利,加大臨床監督力度,要求藥品生產者上市后進行安全監測等措施。在Grassley-Dodd提案通過的同一時間,藥品撤市的數量開始有所增加,自2005年開始到目前為止,已經達到了1991-2004年間總數的1.5倍。因此,近年來的藥品撤市現象與這一提案的通過密切相關,表明嚴格的藥品安全監管體制對藥品的質量、安全要求也更高。
4.4 替代藥品對藥品撤市的影響
由之前替代藥品注冊時間與撤市藥品退市時間的皮爾森相關分析可見,這2個時間具有較強的相關性。換句話說,在替代藥品出現時間附近,撤市藥品即面臨退市。替代藥品不僅在臨床用途和治療效果上接近或者超過撤市藥品,且副作用小。因此,在替代效果良好的情況下,原有副作用較大的藥品即被強制撤市。同時,替代藥品由于其不可替代性,可以完成良好的銷售業績,故在同一治療領域中遙遙領先。
[1] Thomson Reuters CMR International.Global Pharmaceutical R&D Productivity declining[EB/OL].http://cmr.thomsonreuters.com/.2011-05-28.
[2] 石永進.從Exubera看輝瑞制藥的研發現狀[J].世界臨床藥物,2008,29(3):184.
Analysis of the 26Kinds of Withdrawal Drug during 1991-2010
FENG Liu,CAO Chen,YU Yuan-yuan,HU Yuan-jia,WANG Yi-tao(State Key Lab of Quality Control for TCM/Institute for Chinese Medicine Science,The University of Macau,Macau,China)
OBJECTIVE:To analyze withdrawal drugs,and to provide reference for the stability guarantee of product in the market by pharmaceutical manufacturers.METHODS:26kinds of withdrawal drugs announced in 1991-2010by IMS Health Inc.and USA FDA were analyzed from therapeutic classification,cooperation,M&A and patent situation during the R&D process,number of different time,withdrawal time and marketed time of substitutes.RESULTS&CONCLUSIONS:Drugs withdrawal is hardly affected by therapeutic areas,and patent and co-operation can no longer guarantee the stability of market.Main reasons for drugs withdrawal are strict supervision system,substitutes with low side effect and high efficiency.
Withdrawal drug;Supervision;Drug substitution;Analysis of reasons
R95
C
1001-0408(2012)33-3158-02
DOI10.6039/j.issn.1001-0408.2012.33.35
*碩士研究生。研究方向:醫藥管理。電話:00853-83974685。E-mail:fengliu0918@gmail.com
#通訊作者:教授。研究方向:醫藥管理、法規和醫藥經濟研究。電話:00853-83974691。E-mail:ytwang@umac.mo
2011-09-13
2011-11-26)

