細胞自噬的研究進展
孫雅婧,郭青龍
中國藥科大學生理教研室,南京 210009
細胞自噬(autophagy)是指細胞內受損、變性或衰老的蛋白質和細胞器被運輸到溶酶體,溶酶體對其消化降解,以胞質內自噬體的出現為標志的細胞自我消化過程,以雙層膜結構包裹部分胞質和細胞器的自噬體為判斷指標。早在1962年,自噬現象的奠基人Ashford和Porten在人的肝細胞中用電子顯微鏡觀察到了自噬現象。隨著分子生物技術的發展,人們對自噬的形態特點和分子機制了解逐步深入。近年來對自噬的研究十分廣泛,自噬是在體內普遍存在的過程,其在清除代謝廢物進而回收能量為細胞正常運轉提供能量的過程中發揮重要作用,因而對自噬的研究尤為重要。
1 細胞自噬的研究現狀
1.1 自噬的過程
自噬的過程分為四個階段(見圖1)。
第一階段:自噬誘導信號被細胞接受后,類“脂質體”碗狀結構即在胞漿某處形成小的膜結構,在電鏡下觀察到其不斷擴張、呈非球形、扁平狀雙層膜的碗狀結構,稱為自噬前體(phagophore),這種結構的電鏡觀察結果是指示自噬發生的金標準之一。
第二階段:不斷延伸的自噬前體,將胞漿中的若干成分(包括細胞器)收口包入,成為密閉的球狀自噬體(autophagosome)。自噬體的電鏡觀察結果是指示自噬發生的金標準之一。自噬體的特征有兩個:雙層膜,內含諸如線粒體、內質網碎片等胞漿成分。
第三階段:自噬體形成后,可能與細胞內吞的吞噬泡(phagocytic vacuole)、吞飲泡(pinosome)和內體(endosome)融合(此階段為非必需步驟)。
第四階段:自噬體與溶酶體(lysosome)發生融合,形成自噬溶酶體(autolysosome)。期間溶酶體酶降解自噬體的內膜,使兩者的內容物合為一體,自噬體中的包含物被降解,將產物諸如氨基酸、脂肪酸之類輸送到胞漿中,重新利用供能,殘渣則被排出細胞外或滯留于胞漿[1]。
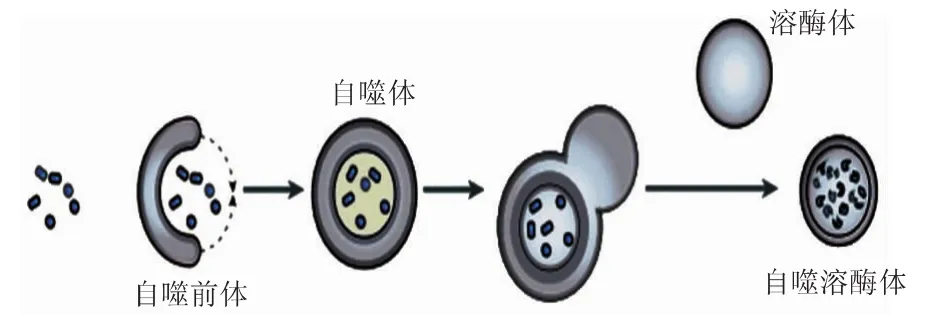
圖1 自噬的基本過程
1.2 自噬的分類
根據細胞內底物運送到溶酶體腔方式的不同,哺乳動物細胞自噬分為3種主要方式:巨自噬(macroautophagy)、微自噬(microautophagy)和分子伴侶介導自噬(chaperone-mediated autophagy,簡稱CMA)。巨自噬是最主要的自噬形式,在巨自噬中由內質網來源的膜包繞待降解物,形成自噬體后與溶酶體融合并降解其內容物;然而在微自噬中,溶酶體膜直接內陷包裹長壽命蛋白等,并在溶酶體內降解,沒有形成自噬小體的過程;分子伴侶介導自噬則為胞漿內蛋白結合到分子伴侶后轉運到溶酶體腔中,被溶酶體酶消化。CMA的底物是可溶蛋白分子,因此CMA降解途徑在清除蛋白質時有選擇性,而前兩者無明顯的選擇性[3]。
2 自噬與凋亡
在多細胞生物體內,維持自身的穩態和內環境的平衡,是保持復雜生物體系正常運轉的重要條件。正常的細胞體系當中,有細胞的生長增殖必然伴隨著細胞的衰老和死亡,細胞死亡包括3種類型:壞死、凋亡和自噬性細胞死亡。活體內局部組織、細胞的死亡稱為壞死(necrosis);壞死組織細胞的代謝停止,功能喪失;壞死的形態變化可由損傷細胞內的水解酶降解作用引起,也可由游走的白細胞釋放水解酶作用引起,以細胞核的改變為形態學標志。凋亡,即Ⅰ型程序性細胞死亡的特征,主要有依賴一系列蛋白水解酶即胱冬肽酶(caspase)參與,染色體濃聚、細胞皺縮、DNA降解和凋亡小體形成等,其細胞的殘余部分最終被巨噬細胞清除。自噬性細胞死亡,即Ⅱ型程序性細胞死亡,以自噬體的出現為特征,不依賴于一系列蛋白水解酶即胱冬肽酶的參與,自噬體和其內的成分最終通過自身溶酶體系統被清除[4]。因此,自噬和凋亡無論在生化代謝途徑,還是形態學方面都有顯著區別,但研究證實,兩者在功能上存在聯系:在誘導細胞死亡的過程中,細胞凋亡和自噬保持著動態平衡,即自噬可能為凋亡所需,自噬通常先于凋亡,進而啟動凋亡;自噬亦可能抑制凋亡作用,可保護細胞免于發生凋亡和壞死;自噬還可能向凋亡轉化,共同促進細胞死亡。
大量證據還表明,自噬可能延遲凋亡的發生,抑制自噬作用可能誘發凋亡現象,同時抑制凋亡作用,也可能導致自噬現象的發生[5-6]。
3 自噬與腫瘤
自噬現象在腫瘤發生發展的過程中發揮著“雙刃劍”的作用。自噬對于腫瘤的具體影響不可一概而論,不能簡單將其劃分為“有益的”和“有害的”,據研究表明,自噬對于腫瘤的影響是分階段和有針對性的。
3.1 自噬對腫瘤的抑制作用
正常的多細胞生物體中,進行正常的能量代謝和生物活動同時,還會產生一些不必要的老化細胞器或蛋白及代謝物,自噬在清除代謝廢物進而回收能量,為細胞正常運轉提供能量的過程中發揮著重要作用。如果自噬作用受影響,細胞一些正常代謝活動不能正常進行,生物體自發性腫瘤的發生幾率便可能增多。研究發現,腫瘤發生與自噬缺陷有關:如自噬相關基因BECN為雜合子的小鼠發生自發性惡性腫瘤的風險增高;乳腺癌、卵巢癌和前列腺癌以及白血病患者中,Beclin-1等位基因缺失的比例高于健康人[7-9]。在部分膠質瘤患者當中,Beclin-1蛋白 (BECN編碼蛋白)和微管相關蛋白質輕鏈3(microtubule-associated protein 1 light chain 3,MAP-LC3)的表達均降低[10]。
其他與自噬相關基因的變化情況也有研究涉及。例如,在自然殺傷性白血病中的自噬相關基因5(autophagy-related gene5,Atg5), 在胃癌和結直腸癌中的紫外線抵抗相關腫瘤抑制基因(UV radiation resistance-associated gene,UVRAG),人胰管癌中的腫瘤抑制基因Bax作用子 (Bax-interacting factor-1,Bif-1)[11-13]。總之,基礎性的自噬對于癌癥發生的早期階段起著積極的對抗作用。
3.2 自噬對腫瘤的促進作用
當腫瘤已經發生,在腫瘤細胞中出現由于嚴重代謝壓力造成的自噬時,腫瘤細胞的數量會不斷增加。自噬為生活環境惡劣的腫瘤細胞提供了有效的供養途徑,使腫瘤細胞能夠在低氧和低養分的微環境、尤其是缺乏血液供氧和供養分的環境下繼續生存,使得腫瘤能夠抵抗外界壓力進行發生侵襲和轉移[14]。細胞與胞外基質或者毗鄰細胞脫離接觸而誘發的特殊細胞程序性死亡稱之為 “失巢凋亡(anoikis)”,而腫瘤細胞能夠克服這種失巢凋亡,在血管缺失的情況下繼續存活,而自噬作用是其作用機制之一[15]。多項體內和體外研究表明,在脫離細胞外基質、缺氧、缺養分的情況下,凋亡缺陷的腫瘤細胞表現出驚人的逆境生存能力,這種強大的生存能力與自噬機制密切相關。自噬為腫瘤細胞提供庇護,通過多種途徑抑制自噬可能將提高腫瘤對放療、化療、免疫治療的敏感性[16-18]。
4 自噬在抗癌藥物介導的細胞死亡中發揮重要的作用
鑒于自噬在腫瘤中特殊的作用和地位,研究其在腫瘤發生發展中的分子調控至關重要。在正常細胞中,雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR) 作為磷脂酰肌醇 3-激酶(phosphatidylinositol 3-kinase,PI3K)的下游分子,在自噬中起著最初的調節作用。在生長因子的作用下,活化的PI3K/AKT/mTOR軸抑制自噬并刺激細胞的增殖。相反,在饑餓狀況下PI3K通路被抑制,自噬被激活,細胞內的各種能量代謝過程受到影響,代謝處于短暫快速供能以維持細胞基本存活需要。腫瘤細胞中的自噬調節機理類似,但是過程和方式更為復雜:在腫瘤細胞中的PI3K異常激活,PI3K/AKT/mTOR途徑和其他細胞信號傳導級聯之間的相互作用失衡,從而引起了細胞內多種異常狀況的發生[19]。基于這種信號轉導的異常,自噬在抗癌藥物介導的細胞死亡中發揮著重要的作用,主要有以下兩個方面:
4.1 自噬與凋亡的動態平衡
Hanahan和Weinberg將自噬和壞死與凋亡并稱為細胞死亡的幾種方式[20],但自噬和凋亡的相互關系未有定論。另有研究指出,自噬和凋亡可能受共同的上游信號調控,可能被同一個關鍵分子調節,Beclin-1是其中一個關鍵分子[21]。因而對于化療藥物所誘導的自噬和凋亡的研究相對具有針對性,但是在不同的藥物作用于不同的細胞株當中,所誘導的自噬現象發揮的作用也不盡相同:抗凋亡、促生長,甚至導致細胞死亡。
化療藥物誘導自噬的機制研究未有定論,化療藥物如DNA損傷劑、微管干擾分子和激酶抑制劑也因其種類不同誘導自噬的機制也有所不同。比較公認的通路是P53的活化在轉錄水平上增加了調節自噬通路的相關蛋白,如腺苷單磷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)、凋亡相關蛋白激酶1(death-associated protein kinase 1,DAPK1)、結節性硬化蛋白 2(tuberous sclerosis protein 2,TSC2)、unc-51 樣激酶 (unc-51-like kinase 1/2,ULK 1/2)和 SESN 基因編碼蛋白 1/2(sestrin 1/2)的表達[22]。
自噬與凋亡共同參與各種抗癌化療方式誘導的細胞死亡,在某一些實例中完整的自噬機制是細胞死亡的必需步驟。在不同的細胞株,諸如肝癌細胞[23]、宮頸癌細胞[24]、甲狀腺腫瘤細胞[25]等給予不同的化療藥物后,自噬可能扮演了促進細胞死亡的作用。上述研究證明,凋亡缺失的細胞中自噬性死亡成為細胞死亡的主要途徑。
體內外實驗的結果均證實,腫瘤組織的缺氧環境影響著抗癌藥物的作用效果[26]。出現這種抵抗的原因可能是對凋亡的抑制,從而引起了缺氧誘導因子(hypoxia inducible factor-1,HIF-1)轉錄水平活化。隨著越來越多的研究涉及自噬參與化療藥物引起細胞死亡,更多研究聚焦于抗癌藥物引起的自噬中缺氧情況的變化。腫瘤組織中的持續缺氧可能擾亂凋亡和自噬兩者間在細胞死亡中的平衡狀態,進而引起一系列的變化[27]。
4.2 自噬的細胞保護作用
自噬作用能使腫瘤細胞在惡劣的微環境中得以生存,并使腫瘤細胞對化療藥物產生耐藥作用。在某些給予抗腫瘤藥的腫瘤細胞中檢測到了自噬現象的大量發生[28]。在那些細胞中給予自噬抑制劑可更能有效地提高抗癌藥物的治療效果,具體機制研究尚無定論。
自噬抑制可減少腫瘤細胞對抗癌藥物的抵抗機制,可能源于細胞死亡中的一個關鍵分子開關。瀕死細胞釋放損害關聯模式分子(damage-associated molecular pattern molecules,DAMPs),其中一種稱為高遷移率族蛋白1(high mobility group box 1 protein,HMGB1)。這種蛋白通過晚期糖化終產物受體 (receptor for advanced glycation endproducts,RAGEs),作用于其他分子誘導自噬和耐藥。此作用途徑目前僅發現于白血病細胞[29],其他腫瘤細胞尚未有相關研究。
5 自噬現象的臨床意義
隨著自噬現象研究的深入,自噬漸漸成為一個新的癌癥治療靶點。如前所述,半數研究表明,自噬是抗癌治療中有效殺傷腫瘤細胞所必需的。研究者期望設計出新的藥物誘導腫瘤細胞的自我吞噬,甚至寄希望于自噬可以清除腫瘤細胞。某些以通過誘導自噬達到影響腫瘤細胞作用的藥物將要作進一步的臨床試驗[30]。
化療藥物使用后,腫瘤細胞中自噬現象的大量產生預示著一種細胞的自我保護反應,以自噬體的形成與融合為靶點的治療藥物為腫瘤化療提供了一條新思路和新途徑[31]。因而誘導腫瘤細胞發生自噬的藥物,在腫瘤的預防和治療初期階段有著廣闊的前景和極其重要的意義。
[1]Mizushima N.Autophagy:process and function[J].Genes Dev,2007,21(22):2861-73.
[2]Levine B.Cell biology:autophagy and cancer[J].Nature,2007,446(7137):745-7.
[3]Yoshimori T.Autophagy:a regulated bulk degradation process inside cells[J].Biochem Biophys Res Commun,2004,313(2):453-8.
[4]Lockshin RA,ZakeriZ.Apoptosis,autophagy,and more[J].Int J Biochem Cell Biol,2004,36(12):2405-19.
[5]Maiuri MC,Zalckvar E,Kimchi A,et al.Self-eating and self-killing:crosstalk between autophagy and apoptosis[J].Nat Rev Mol Cell Biol,2007,8(9):741-52.
[6]Platini F,Perez-Tomas R,Ambrosio S,et al.Understanding autophagy in cell death control[J].Curr Pharm Des,2010,16(1):101-13.
[7]Qu X,Yu J,Bhagat G,et al.Promotion of tumorigenesis by heterozygous disruption of the beclin 1 autophagy gene[J].J Clin Invest,2003,112(12):1809-20.
[8]Yue Z,Jin S,Yang C,et al.Beclin 1,an autophagy gene essential for early embryonic development,is a haploinsufficient tumor suppressor[J].Proc Natl Acad Sci USA,2003,100(25):15077-82.
[9]Liang XH,Jackson S,Seaman M,et al.Induction of autophagy and inhibition of tumorigenesis by beclin 1[J].Nature,1999,402(6762):672-6.
[10]Huang X,Bai HM,Chen L,et al.Reduced expression of LC3B-II and Beclin 1 in glioblastoma multiforme indicates a down-regulated autophagic capacity that relates to the progression of astrocytic tumors[J].J Clin Neurosci,2010,17(12):1515-9.
[11]Iqbal J,Kucuk C,Deleeuw RJ,et al.Genomic analyses revealglobalfunctionalalterationsthatpromote tumor growth and novel tumor suppressor genes in natural killer-cell malignancies[J].Leukemia,2009,23(6):1139-51.
[12]Liang C,Feng P,Ku B,et al.Autophagic and tumour suppressor activity of a novel Beclin1-binding protein UVRAG[J].Nat Cell Biol,2006,8(7):688-99.
[13]Coppola D,Khalil F,Eschrich SA,et al.Down-regulation of Bax-interacting factor-1 in colorectal adenocarcinoma[J].Cancer,2008,113(10):2665-70.
[14]Kenific CM,Thorburn A,Debnath J.Autophagy and metastasis:another double-edged sword[J].Curr Opin Cell Biol,2010,22(2):241-5.
[15]Horbinski C,Mojesky C,Kyprianou N.Live free or die:tales of homeless (cells)in cancer[J].Am J Pathol,2010,177(3):1044-52.
[16]Degenhardt K,Mathew R,Beaudoin B,et al.Autophagy promotestumorcellsurvivaland restricts necrosis,inflammation,and tumorigenesis[J].Cancer Cell,2006,10(1):51-64.
[17]Kuma A,Hatano M,Matsui M,et al.The role of autophagy during the early neonatal starvation period[J].Nature,2004,432(7020):1032-6.
[18]Pavlides S,Tsirigos A,Migneco G,et al.The autophagic tumor stroma model of cancer:role of oxidative stress and ketone production in fueling tumor cell metabolism[J].Cell Cycle,2010,9(17):3485-505.
[19]Chen N,Karantza-Wadsworth V.Role and regulation of autophagy in cancer[J].Biochim Biophys Acta,2009,1793(9):1516-23.
[20]Hanahan D,Weinberg RA.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646-74.
[21]Kang R,Zeh HJ,Lotze MT,et al.The Beclin 1 network regulates autophagy and apoptosis[J].Cell Death Differ,2011,18(4):571-80.
[22]Feng Z.p53 Regulation of the IGF-1/AKT/mTOR pathways and the endosomal compartment[J].Cold Spring Harb Perspect Biol,2010,2(2):a001057.
[23]Cosse JP,Rommelaere G,Ninane N,et al.BNIP3 protects HepG2 cells against etoposide-induced cell death underhypoxia by an autophagy-independent pathway[J].Biochem Pharmacol,2010,80(8):1160-9.
[24]Lee SB,Tong SY,Kim JJ,et al.Caspase-independent autophagic cytotoxicity in etoposide-treated CaSki cervical carcinoma cells[J].DNA Cell Biol,2007,26(10):713-20.
[25]Lin CI,Whang EE,Donner DB,et al.Autophagy induction with RAD001 enhances chemosensitivity and radiosensitivity through Met inhibition in papillary thyroid cancer[J].Mol Cancer Res,2010,8(9):1217-26.
[26]Rohwer N,Cramer T.Hypoxia-mediated drug resistance:novel insights on the functional interaction of HIFs and cell death pathways[J].Drug Resist Updat,2011,14(3):191-201.
[27]Piret JP,Mottet D,Raes M,et al.Is HIF-1alpha a pro-or an anti-apoptotic protein?[J].Biochem Pharmacol,2002,64(5-6):889-92.
[28]Kondo Y,Kanzawa T,Sawaya R,et al.The role of autophagy in cancerdevelopmentand response to therapy[J].Nat Rev Cancer,2005,5(9):726-34.
[29]Liu L,Yang M,Kang R,et al.DAMP-mediated autophagy contributes to drug resistance[J].Autophagy,2011,7(1):112-4.
[30]Levy JM,Thorburn A.Targetingautophagy during cancer therapy to improve clinical outcomes[J].Pharmacol Ther,2011,131(1):130-41.
[31]Chen S,Rehman SK,Zhang W,et al.Autophagy is a therapeutic targetin anticancerdrug resistance[J].Biochim Biophys Acta,2010,1806(2):220-9.

