苦參堿對宮頸癌Hela細胞凋亡相關蛋白表達的影響*
西電集團醫院婦產科 (西安710077)
王 麗 蘇寶山▲ 吳 靜▲
近年來體內外大量研究表明,苦參堿(Matrine,Mat)的抗腫瘤作用全面而廣泛,但對這些作用機制的研究較少,至今仍不清楚。目前普遍認為,腫瘤的發生是機體組織過度增生與凋亡不足,增生與凋亡失衡的結果。Bcl-2、COX-2、Fas、Fas L蛋白均是細胞凋亡通路中發揮重要作用的分子,與腫瘤發生、發展關系密切,對它們的研究,能更深入的了解腫瘤發生的病因學,并指導腫瘤的臨床治療。研究表明,宮頸癌組織中COX-2、Bcl-2和Fas L均呈高表達,Fas表達下降,腫瘤細胞處于無限增殖狀態,發生浸潤、轉移[1,2]。本實驗前期已通過MTT法及流式細胞儀(FCM)檢測證實Mat有抑制宮頸癌Hela細胞的增殖,誘導其凋亡作用,在此基礎上,進一步用免疫細胞化學法檢測 Mat作用宮頸癌 Hela細胞72h后,Hela細胞中Bcl-2、COX-2、Fas、Fas L蛋白的表達水平,初步探討 Mat抑制宮頸癌Hela細胞的增殖,誘導其凋亡可能的作用機制,為Mat應用于臨床腫瘤治療提供理論依據。
材料和方法
1 材 料
1.1 人宮頸癌Hela細胞株:由西安交通大學醫學院癌癥研究所惠贈。
1.2 主要試劑:Mat純度為98%,購自陜西昂盛生物醫藥科技有限公司;RPMI-1640培養基為美國GIBCO產品;小牛血清(BCS)杭州四季青生物工程材料研究所;SP試劑盒為武漢博士德生物技術公司。鼠抗人Bcl-2單克隆抗體、鼠抗人COX-2單克隆抗體、鼠抗人Fas單克隆抗體、鼠抗人Fas L單克隆抗體均購自美國Santa Cr uz公司產品,北京中山生物技術有限公司分裝。
1.3 主要儀器和設備:CO2培養箱(SHEL-LAB型,美國),超凈工作臺,6孔細胞培養板(美國Costar公司)。
2 方 法
2.1 細胞培養:將宮頸癌Hela細胞用含10%小牛血清(BCS),青霉素100 U/ml,鏈霉素100μg/ml的RPMI 1640培養基,置于37℃、含5%CO2飽和濕度培養箱孵育傳代培養。
2.2 實驗方法:將無菌蓋玻片(22 mm×22 mm)鋪在6孔細胞培養板里,取對數生長期的Hela細胞1×106個/孔接種于已置蓋玻片的6孔細胞培養板內,置37℃5%CO2飽度濕度孵箱內培養24h。細胞貼壁后棄去原液,加Mat溶液終濃度分別為1.0 mg/ml,1.5 mg/ml,2.0 mg/ml,對照只加 Hela細胞和培養液,共同培養72h。每個濃度組設3個復孔。取出有貼壁細胞的蓋玻片,PBS液漂洗3遍,加入預先4℃保存的冷丙酮固定5 min,風干后貼于載玻片上,免疫細胞化學檢測(SP法),檢測 Mat作用后Bcl-2、COX-2、Fas和Fas L蛋白表達水平,按試劑盒說明書操作。結果判定:以PBS代替一抗作陰性對照,Fas、Fas L染色陽性為在細胞膜上出現棕黃色顆粒 ,胞質內也有染色,COX-2染色陽性為在細胞質中出現棕黃色顆粒,Bcl-2染色陽性為在細胞質或核膜中出現棕黃色顆粒。每片均隨機選取4個高倍視野(400倍),每視野計數100個細胞,算出陽性細胞所占比例。綜合考慮爬片中陽性細胞占所觀察同類細胞數的百分比和陽性細胞著色強度兩項指標,半定量分析判定結果。根據染色強度評分標準:標本無色為0分;淡黃色為1分;棕黃色為2分,棕黑色為3分。根據陽性細胞在觀察細胞中所占比例評分,評分標準為:陽性細胞數 ≤10%為1分;11%~50%為2分;51%~75%為3分;大于75%為4分。兩類分數乘積0~3分為(-);4~5分為(+ );6~7分為(++);8分以上為(+++ )。每組細胞片檢測后以+~+++均為陽性。
2.3 統計學分析 實驗數據使用SPSS10.0 for Windows統計學軟件進行分析。兩組間率的比較用χ2檢驗,以P<0.05為差異具有統計學意義。
結 果
實驗數據經統計學分析,結果顯示,對照組中Hela細胞中Fas蛋白表達較低(+),陽性表達率為16.7%,Fas L蛋白呈高表達(+++),表達率為81.0%。1.0、1.5、2.0 mg/ml的Mat分別作用于Hela細胞72h后Fas蛋白表達明顯逐漸增加,隨著Mat作用劑量增加,Hela細胞內Fas的表達水平增加,陽性率分別為54.2%66.7%和83.3% 與對照組相比,均差異有統計學意義﹙P<0.05﹚,見表1(圖1、圖2)。1.0、1.5、2.0 mg/ml的Mat分別作用于Hela細胞72h后Fas L蛋白表達逐漸減弱,隨著Mat作用劑量增加,Hela細胞內Fas L的表達水平下降,陽性率分別為41.7%、37.5%和29.2%,與對照組相比,均差異有顯著意義﹙P<0.05﹚,見表2(圖3、圖4)。
對照組Hela細胞胞漿呈棕黃色,Bcl-2蛋白呈高表達(+++),陽性表達率為91.7%;1.0、1.5、2.0 mg/ml的Mat作用于Hela細胞72h后Bcl-2蛋白表達逐漸下降,隨著Mat作用劑量增加,Hela細胞內Bcl-2蛋白的表達水平下降,陽性率分別為58.3%、50.0%和33.3%,與對照組相比,均差異有統計學意義﹙P<0.05﹚,見表3(圖5、圖6)。
COX-2在對照組正常培養的Hela細胞胞漿呈深棕色,COX-2蛋白呈高表達(+++),陽性表達率為95.0%;1.0、1.5、2.0 mg/ml的Mat作用于Hela細胞72h后COX-2蛋白表達逐漸下降,隨著Mat作用劑量增加,Hela細胞內COX-2蛋白的表達水平下降,陽性率分別為59.1%、45.5%和27.3%,與對照組相比,均差異有統計學意義﹙P<0.05﹚,見表4(圖7)。
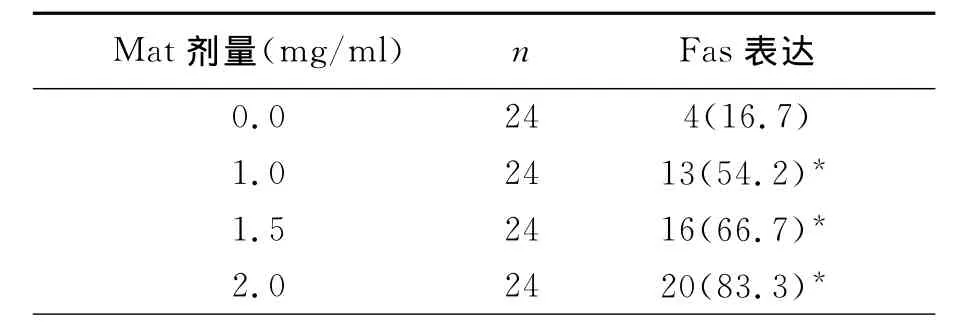
表1 Mat對Hela細胞中Fas蛋白表達的影響(%)
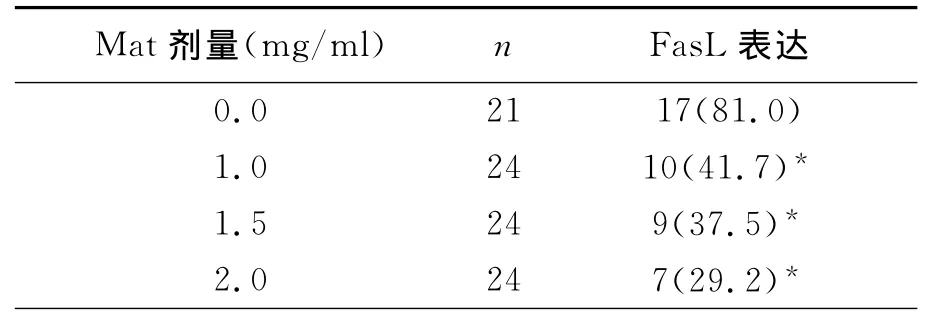
表2 Mat對Hela細胞中Fas L蛋白表達的影響(%)

表3 Mat對Hela細胞中Bcl-2蛋白表達的影響(%)
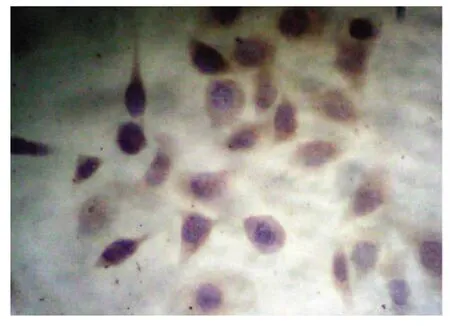
圖1 Fas蛋白在對照組中低表達(DAB×400)
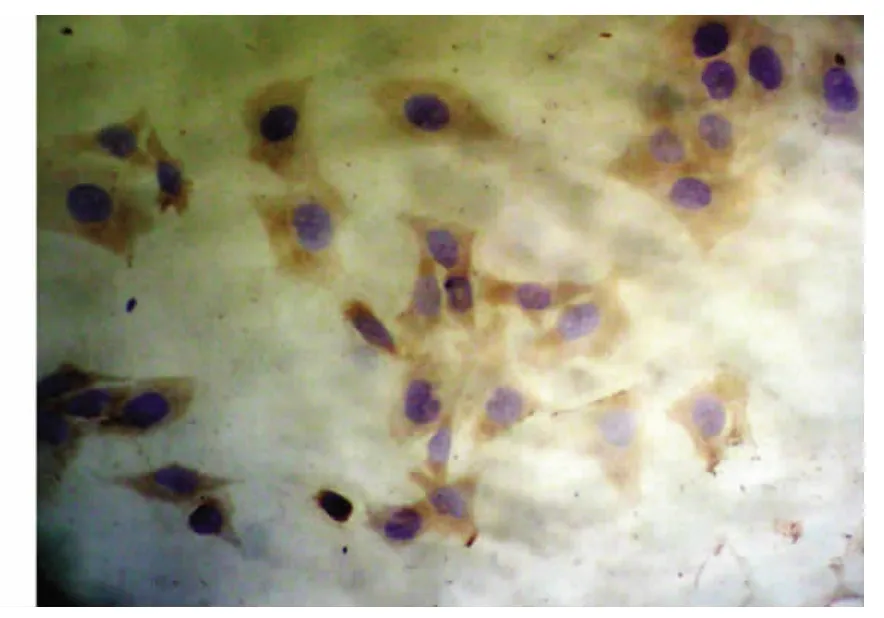
圖2 Fas蛋白在苦參堿處理組中高表達(DAB×400)
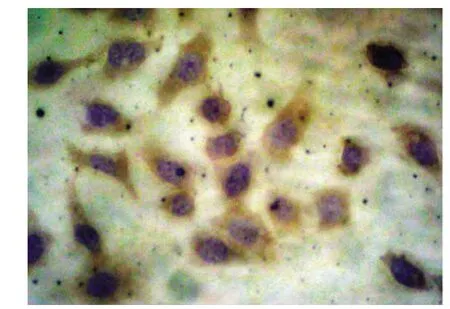
圖3 Fas L蛋白在對照組中高表達(DAB×400)
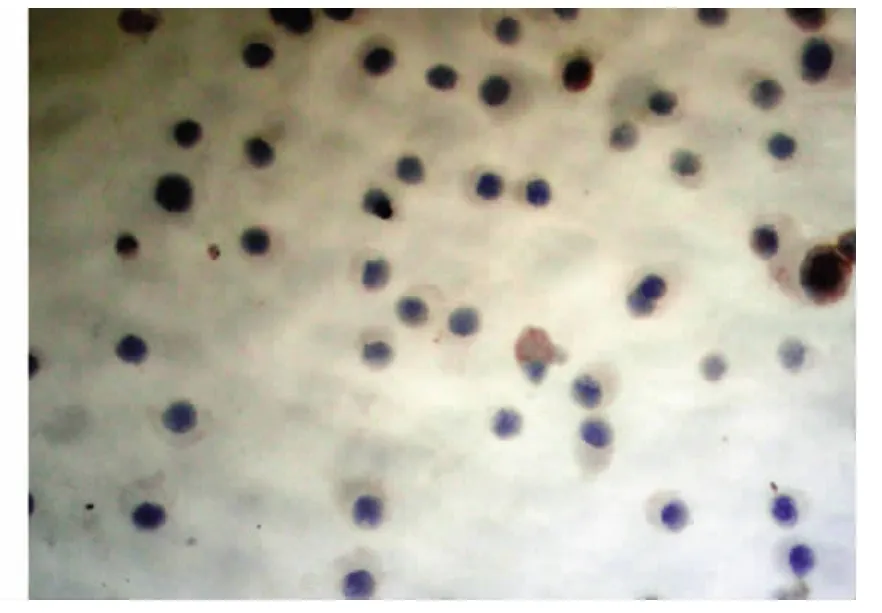
圖4 Fas L蛋白在苦參堿處理組中低表達(DAB×400)
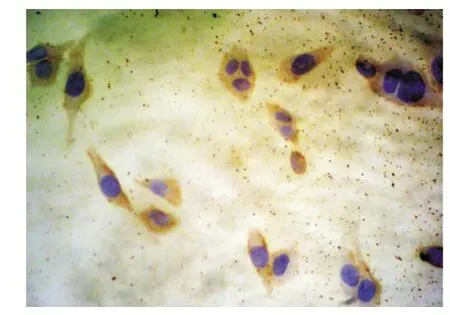
圖5 Bcl-2蛋白在對照組中高表達(DAB×400)
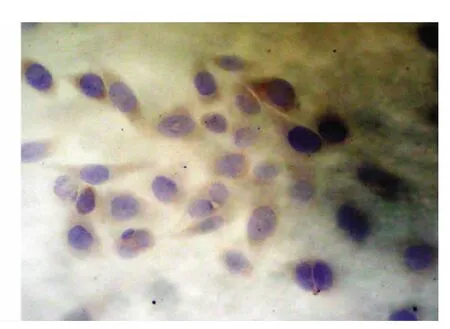
圖6 Bcl-2蛋白在苦參堿處理組中低表達(DAB×400)
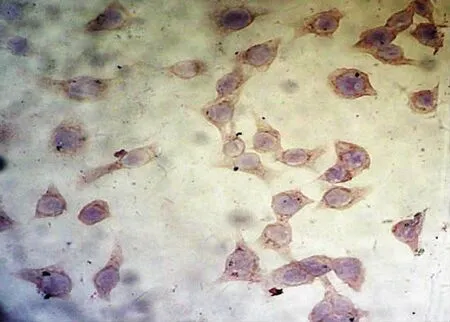
圖7 COX-2蛋白在苦參堿處理組中低表達(DAB×400)
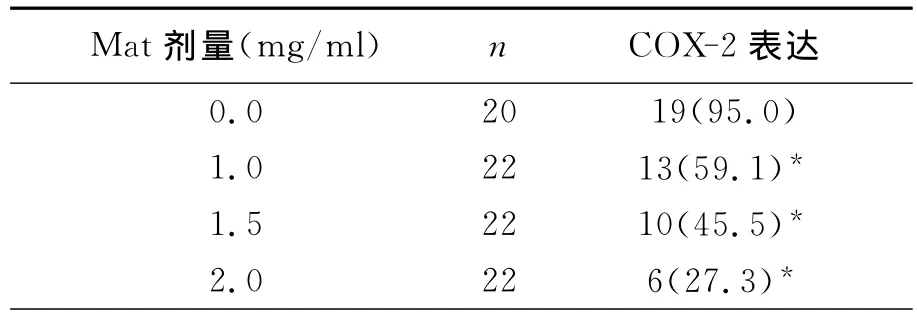
表4 Mat對Hela細胞中COX-2蛋白表達的影響(%)
討 論
細胞凋亡是英國愛丁堡大學Kerr[3]等人于1972年提出的,凋亡是由多基因控制的細胞自主性程序化死亡過程,是機體對異常細胞、衰老細胞或潛在異常增生細胞的一種清除手段。研究表明,細胞凋亡通路較多,主要有三條通路[4],就是死亡受體通路、線粒體通路和內質網通路,三條通路密切關聯,均激活不同的Caspase執行細胞凋亡作用。Caspase可降解細胞內結構蛋白、調節蛋白、DNA修復酶等多種蛋白執行凋亡過程。通過調控細胞信號轉導系統誘導細胞凋亡來治療腫瘤已經成為腫瘤學領域研究熱點之一。Fas/Fas L介導的細胞凋亡就是通過經典的死亡受體通路。研究認為,腫瘤細胞表達Fas L與腫瘤的免疫逃逸有關。已知T淋巴細胞、B淋巴細胞及自然殺傷細胞表面均有Fas表達,特別是活化的T淋巴細胞Fas表達水平更高,當表達Fas的免疫細胞與表達Fas L的腫瘤細胞結合后,激活Fas/Fas L信號傳遞途徑,引起免疫細胞的凋亡,使得腫瘤細胞逃避免疫殺傷。近年研究發現,多數惡性腫瘤細胞表面,如宮頸癌、卵巢癌、子宮內膜癌等細胞表面均有Fas L表達,誘導表達Fas的淋巴細胞、自然殺傷細胞凋亡,使腫瘤細胞逃避機體的免疫監視,腫瘤細胞對宿主免疫系統有主動攻擊作用;而腫瘤細胞Fas表達越高,與自身的Fas L結合,啟動細胞凋亡信號轉導系統,引起細胞凋亡[5]。
Bcl-2即B細胞淋巴瘤/白血病-2,屬于Bcl-2家族成員,定位于18q21.3號染色體,基因全長230kb。Bcl-2家族成員在細胞凋亡的線粒體途徑中起重要調控作用。Bcl-2可與Bcl-2家族的Bcl-X1、Bcl-Xs、Bax、Bcl-2、Bad和Mc1-1形成同源或異源的蛋白二聚體形式,二聚體間以網絡的形式相互作用,而特定的蛋白二聚體則可作為在細胞死亡信號通路上的分子開關,調控細胞的凋亡[6]。研究發現,早期宮頸癌中,致癌因子引起Bcl-2的過度表達,抑制了細胞凋亡,促使腫瘤的生長;在晚期宮頸癌中,由于多個癌基因和抑癌基因的影響,Bcl-2的表達下降,因此細胞內Bcl-2基因的過度表達可能是宮頸癌的早期事件。
COX是花生四烯酸合成前列腺素(PGs)的關鍵酶,有兩種異構體,其中COX-2是一個重要原癌基因,在正常組織中不表達,可被多種因素如細胞因子、內毒素、致癌因子誘導,通過抑制細胞凋亡、促進細胞增殖、促進腫瘤細胞惡變及轉移、尤其促進新生血管形成,影響癌的發生和發展[7]。研究發現敲除COX-2基因可顯著減少腸道腫瘤和皮膚乳頭狀瘤的發生[8]。研究顯示,在宮頸癌中COX-2表達顯著增高[9]。近年來,針對COX-2為靶點的抗腫瘤治療研究也越來越多。選擇性COX-2抑制劑在腫瘤防治中有廣闊前景。
Mat是從豆科槐屬植物苦豆子中提取的單一生物堿,化學分子成為作為抗癌中藥,大量研究已經證實,Mat有誘導腫瘤細胞凋亡的作用[11]。檢測凋亡可通過多種方法,除了細胞形態學觀察、流式細胞儀、原位末端標記法測凋亡率外,還可用免疫組織化學法檢測凋亡相關蛋白的表達。本實驗用免疫細胞化學(SP)法檢測了Mat作用宮頸癌Hela細胞72h后凋亡相關蛋白的表達,結果發現抑制凋亡蛋白Bcl-2、COX-2及Fas L表達下降,促凋亡蛋白Fas表達增加,說明Mat下調Bcl-2、COX-2及Fas L表達,增加Fas的表達,可能是其誘導宮頸癌細胞凋亡的機制之一,為靶向治療宮頸癌提供了新的思路,至于具體詳細的機制還有待研究。
[1]張 璇,陳 莉,曉 宵,等.COX-2和NET-1基因蛋白在宮頸癌中表達的意義[J].腫瘤防治研究,2006,33(4):252-255.
[2]朱 青,韓蘇夏,李明眾,等.放療前后宮頸癌細胞凋亡及Fas、P53及bcl-2的表達[J].現代腫瘤醫學,2006,14(6):730-732.
[3]Kerr JFR,Wyllie AH,Cunie AR.Apoptosis basic biological pheno menon with wide ranging i mplications in tissue kinetics[J].Br J Cancer,26:239-257.
[4]Nakagawa T,Zhu H,Morishi ma N,etal.Caspase-12 mediates endoplas mic-reticulu m-specific apoptosis and cytotoxicity by amyloid-beta[J].Nature,2000,403(6765):98-103.
[5]Kase H,Aoki Y,Tanaka K.Fas ligand expression in cervical adenocarcino ma:relevance to ly mph node metastasis and tu mor progression[J].Gynecol Oncol,2003,90(1):70-74.
[6]Tho madaki H,corilas A.Bcl-2 fa mily of apoptosis-related genes:f unction And clinical i mplications in cancer[J].Crit Rev Clin Lab Sci,2006,43(1):1-67.
[7]吳 永,王和勇,張培德,等.環氧合酶-2在腫瘤浸潤合轉移中德作用和治療研究[J].現代生物醫學進展,2008,8(8):1580-1583.
[8]Rigas B,Kashfi K.Cancer prevention:A new era beyond COX-2[J].J Phar macol Exp Ther,2005,314:1-8.
[9]Ferrandina G,Ranelletti F O,Legge F,etal.Prognostic role of the radio bet ween cyclooxygenase-2 in tu mor and stro ma co mpart ments in cervical cancer[J].Clin Cancer Res,2004,10(9):3117.
[10]蘇麗梅,戴貴東,聶黎紅,等.苦參堿對豚鼠離體膽囊平滑肌條收縮功能的影響[J].陜西中醫,2010,31(7):916-918.
[11]司維柯,尚桃元,康格非.苦參堿對人肝癌細胞 Hep G2的細胞形態影響和相關增殖因素的變化[J].第三軍醫大學學報,2000,22(6):553-556.

