缺氧對巨噬細胞HMGB1釋放的影響及其機制
李 蕾,韓菲菲,王發龍,劉 潔,陳國千*
(1.南京醫科大學附屬無錫人民醫院 醫學檢驗科,江蘇 無錫214023;2.南京醫科大學附屬無錫人民醫院 呼吸科)
氧是人體各種細胞維持正常代謝活動所必需的。免疫細胞在人體免疫應答過程中發揮重要作用,且常處于病理性或生理性缺氧環境中。在諸多病理情況下,如感染、炎癥、創傷、休克、腫瘤、器官移植等,常發生缺氧[1]。缺氧可以明顯影響免疫細胞的多種生物學功能,如基因表達、炎癥反應、細胞分化、凋亡、能量代謝等。缺氧能誘導免疫細胞炎癥介質如白細胞介素(IL)、腫瘤壞死因子(TNF)等炎癥介質的釋放。高遷移率族蛋白B1(HMGB1)為近年發現的一種重要晚期炎癥介質,與膿毒癥、關節炎、急性胰腺炎、肺炎、腫瘤、缺血再灌注損傷、燙傷等發病機制關系密切[2]。許多研究顯示,巨噬細胞受脂多糖、TNF、生物活性脂等誘導后,胞內HMGB1可主動分泌到細胞外[3,4],但缺氧是否誘導巨噬細胞釋放HMGB1尚未見研究報道。
1 材料與方法
1.1 材料
巨噬細胞株RAW264.7購自中國科學院細胞庫,缺氧培養箱為長沙華曦電子科技有限公司生產的YCP-50S三氣培養箱,使用99.99%N2。RPMI-1640、OPTI-MEMⅠ培養液為Gibco公司產品,胎牛血清為杭州四季青公司產品,N-乙酰半胱氨酸(NAC)、臺盼藍為Sigma公司產品,兔抗 HMGB1多克隆抗體為Gene Tex公司產品,熒光素FITC標記羊抗兔IgG為北京博奧森公司產品,RNAiso Plus、Prime Script RT Master Mix、Prime Ex Taq為Takara公司產品。
1.2 細胞培養實驗
巨噬細胞株RAW264.7使用RPMI-1640培養液(含10%胎牛血清、100U/ml青霉素、100μg/ml鏈霉 素、2mmol/L 谷氨 酰 胺)在37℃、5%CO2、95%空氣培養箱中進行常規培養,細胞貼壁覆蓋80%-90%時,換用無血清OPTI-MEM I培養液并洗滌2次,隨后進行細胞實驗。對照組繼續置于37℃、5%CO2、95%空氣培養箱中培養,缺氧組置于三氣培養箱中培養,培養氣體設置為5%CO2、1%O2、94%N2。細胞培養液收集后離心取上清液檢測HMGB1含量。各組實驗均重復6次。通過臺盼藍細胞染色顯示,巨噬細胞株RAW264.7經缺氧培養24h或100mmol/L NAC作用后細胞存活率無明顯改變。
1.3 HMGB1濃度測定
細胞培養上清液中HMGB1濃度采用酶聯免疫吸附試驗(ELISA)檢測。HMGB1ELISA試劑盒為日本Shino-Test公司產品,按產品使用說明書進行分析定量。
1.4 HMGB1mRNA表達檢測
采用實時熒光定量PCR法檢測。按Trizol說明書提取細胞總RNA,紫外分光光度計測定其濃度和純度。根據Prime Script RT Master Mix試劑盒說明書進行逆轉錄反應,反應總體系10μl,反應條件37℃15min,85℃5sec,cDNA產物置-20℃保存。HMGB1、GAPDH引物和探針由Takara公司合成,見表1。PCR循環參數為95℃預變性30sec,95℃變性5sec,56℃退火15sec,72℃延伸20sec,循環40次。以HMGB1和GAPDH的Ct值之差(△Ct)作為HMGB1mRNA相對表達水平的指標。
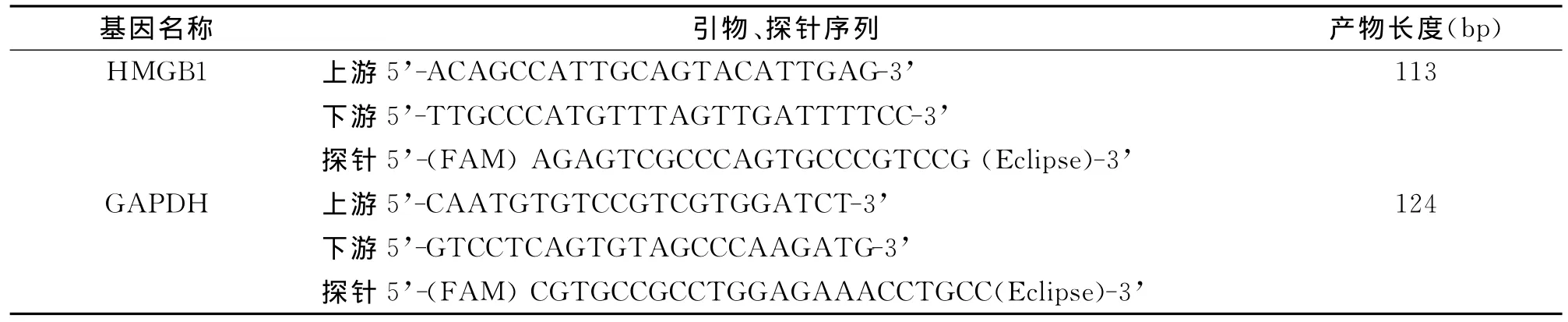
表1 HMGB1、GAPDH的引物及探針序列
1.5 HMGB1細胞免疫熒光染色
培養巨噬細胞以4%甲醛固定10min,0.3%Triton X-100(pH 7.4)處理15min,10%牛血清白蛋白室溫封閉1h,然后分別與兔抗HMGB1多克隆抗體和FITC標記羊抗兔IgG37℃孵育1h,加甘油緩沖液、封片,以熒光顯微鏡觀察。
1.6 統計學分析
使用SPSS 18.0統計軟件包,兩組間比較采用雙側t檢驗分析,多組間比較采用單因素方差分析,P<0.05為差異有統計學意義。
2 結果
2.1 缺氧對巨噬細胞HMGB1釋放的影響
巨噬細胞株RAW264.7經缺氧(1%O2)培養12h、24h后,培養上清液中HMGB1含量明顯升高(P<0.01),分別為對照組的4.0和5.4倍,見表2。
表2 缺氧對RAW264.7巨噬細胞培養上清液中HMGB1含量的影響(μg/L,±s)

表2 缺氧對RAW264.7巨噬細胞培養上清液中HMGB1含量的影響(μg/L,±s)
注:與對照組比較,*P<0.01;各組各時間點n=62.
細胞培養時間6h 12h 24h對照組組別1.34±0.47 2.66±0.50 4.27±1.16缺氧組 1.90±0.51 10.75±1.99* 23.15±3.79*
2.2 缺氧對巨噬細胞HMGB1mRNA表達的影響
巨噬細胞株RAW264.7經缺氧(1%O2)培養6 h、12h和24h后,細胞HMGB1mRNA表達水平逐漸增強(P<0.01),且均明顯高于各自對照組(P<0.05或P<0.01),見表3。
表3 缺氧對RAW264.7巨噬細胞HMGB1mRNA表達的影響(△Ct,±s)

表3 缺氧對RAW264.7巨噬細胞HMGB1mRNA表達的影響(△Ct,±s)
注:與對照組比較,*P<0.05,**P<0.01;各組各時間點n=6
6h 12h 24h對照組組別5.92±0.35 5.79±0.41 6.02±0.30缺氧組 5.34±0.47* 4.20±0.28** 2.91±0.18**
2.3 缺氧對巨噬細胞HMGB1核漿轉移的影響
HMGB1細胞免疫熒光染色顯示,對照組(普通培養)HMGB1主要定位于細胞核,而缺氧培養12h后,細胞核HMGBl特異性染色明顯變淡,胞漿染色加深,見圖1。
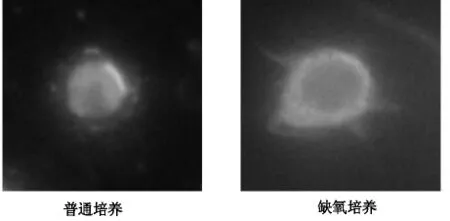
圖1 RAW264.7巨噬細胞HMGB1免疫熒光染色
2.4 NAC對缺氧誘導巨噬細胞HMGB1釋放的抑制作用
10mmol/L和100mmol/L的NAC對巨噬細胞株RAW264.7缺氧培養24h后培養上清液中的HMGB1含量顯示明顯抑制作用(P<0.01),且100 mmol/L NAC的抑制作用明顯強于10mmol/L NAC(P<0.05),呈劑量依賴性,但0.1mmol/L和1mmol/L NAC的抑制作用不明顯(P>0.05),見圖2。

圖2 NAC對RAW264.7巨噬細胞缺氧釋放HMGB1的影響
3 討論
高遷移率族蛋白(HMG)為一類核內非組蛋白,因其在聚丙烯酰胺凝膠電泳中遷移速度快而得名。HMG包括 HMGA、HMGB、HMGN 3個家族,而HMGB家族有3個成員即 HMGB1、HMGB2、HMGB3。HMGB1在哺乳動物中高度保守,其氨基酸序列同源性在人和嚙齒類動物間高達99%。HMGB1由215個氨基酸組成,相對分子質量為30×103。HMGB1最初被認為是染色質的結構成分,功能局限在核內,主要參與穩定核小體的結構、調節基因轉錄、參與DNA修復、DNA重組及調控類固醇激素等生命活動。1999年,Wang等[3]發現HMGB1可以釋放到胞外并介導炎癥反應,為內毒素血癥和膿毒癥的重要炎癥介質。
HMGB1可以在細胞因子如IL-1、TNF-α、干擾素-γ(IFN-γ)、脂多糖及生物活性脂等因素刺激下,由單核細胞、巨噬細胞、樹突狀細胞、內皮細胞等主動分泌;也可由壞死細胞或受損細胞被動釋放。諸多研究[2]表明,炎癥介質HMGB1參與許多疾病的病理過程,如膿毒癥、關節炎、肺炎、腫瘤、缺血再灌注損傷、燙傷等。
缺氧可以明顯影響免疫細胞的多種生物學功能如炎癥反應等。研究[5]顯示,缺氧可誘導免疫細胞釋放TNF-α、IL-1等多種細胞因子或生物活性介質,參與炎癥反應。Acosta-Iborra等[6]報道,小鼠腹腔巨噬細胞在缺氧條件下培養可以產生高水平的IFN-γ、IL-12mRNA 及其蛋白表達,而抗炎性細胞因子IL-10mRNA水平保持不變;Thobe 等[7]報道,缺氧可致枯否(Kupffer)細胞IL-6和單核細胞趨化蛋白-1的生成釋放增加,其IL-6增加機制與通過Src介導的p38MAPK活化有關。近年有個別報道[8,9]顯示,缺氧(1%O2)可誘導肝細胞釋放HMGB1,且為非死亡被動釋放,呈時間依賴性,24h達到高峰;分離的新生心細胞在缺氧(1.5%O2)培養下合成和釋放HMGB1增加,12h達到高峰,而在常氧(21%O2)下培養至24h,HMGB1表達仍無明顯的變化。缺氧對巨噬細胞HMGB1釋放的誘導作用尚未見研究報道。本實驗以缺氧作為刺激因素,研究其對巨噬細胞HMGB1釋放的影響。臺盼藍染色法檢測顯示缺氧24h以內對細胞生存率無明顯影響,各組細胞存活率均在95%以上,因而排除了細胞壞死發生的HMGBl被動釋放。本研究發現,巨噬細胞株RAW264.7經缺氧誘導12h后培養上清液HMGB1蛋白水平明顯升高,24h后釋放達到高峰,細胞免疫熒光染色觀察發現HMGBl出現核漿轉移。因蛋白質的表達受多級水平的調控,如轉錄水平、翻譯水平調控等,所以我們同時測定了HMGB1mRNA的表達水平,結果顯示,缺氧6h時HMGB1mRNA表達已顯示增強,表明缺氧誘導HMGB1分泌增加與轉錄水平調控有關。
有研究顯示,將細胞置于缺氧環境中數小時后,通過二氯熒光黃雙乙酸鈉(DCFH-DA)熒光標記法測定的細胞內活性氧自由基(ROS)含量增加[10]。NAC作為一種巰基供給體,具有清除自由基、抗氧化劑等作用,本研究使用NAC進行細胞干預實驗,結果顯示10、100mmol/L的NAC對缺氧誘導巨噬細胞HMGB1釋放具有明顯的抑制作用,與Tsung等[8]使用肝細胞的研究結果基本一致,提示缺氧誘導細胞HMGB1釋放可能與胞內ROS產生有關。缺氧誘導HMGB1釋放是否涉及其它氧依賴相關信號通路等還有待進一步研究。
[1]Eltzschig HK,Carmeliet P.Hypoxia and inflammation[J].N Engl J Med,2011,364(7):656.
[2]Sims GP,Rowe DC,Rietdijk ST,et al.HMGB1and RAGE in inflammation and cancer[J].Annu Rev Immunol,2010,28:367.
[3]Wang H,Bloom O,Zhang M,et al.HMG-1as a late mediator of endotoxin lethality in mice[J].Science,1999,285(5425):248.
[4]Chen G,Li J,Ochani M,et al.Bacterial endotoxin stimulates macrophages to release HMGB1partly through CD14-and TNF-dependent mechanisms[J].J Leukoc Biol,2004,76(5):994.
[5]Dziurla R,Gaber T,Fangradt M,et al.Effects of hypoxia and/or lack of glucose on cellular energy metabolism and cytokine pro-duction in stimulated human CD4+ T lymphocytes[J].Immunol Lett,2010,131(1):97.
[6]Acosta-Iborra B,Elorza A,Olazabal IM,et al.Macrophage oxygen sensing modulates antigen presentation and phagocytic functions involving IFN-gamma production through the HIF-1alpha transcription factor[J].J Immunol,2009,182(5):3155.
[7]Thobe BM,Frink M,Choudhry MA,et al.Src family kinases regulate p38MAPK-mediated IL-6production in Kupffer cells following hypoxia[J].Am J Physiol Cell Physiol,2006,291(3):C476.
[8]Tsung A,Klune JR,Zhang X,et al.HMGB1release induced by liver ischemia involves Toll-like receptor 4dependent reactive oxygen species production and calcium-mediated signaling[J].J Exp Med,2007,204(12):2913.
[9]Andrassy M,Volz HC,Igwe JC,et al.High-mobility group box-1 in ischemia-reperfusion injury of the heart[J].Circulation,2008,117(25):3216.
[10]Kietzmann T,G?rlach A.Reactive oxygen species in the control of hypoxia-inducible factor-mediated gene expression[J].Semin Cell Dev Biol,2005,16(4-5):474.

