PC12細胞轉化為神經元樣細胞的培養、鑒定及氧糖剝奪模型的制備
何金婷,莽 靖,郭洪亮,梅春麗,胥桂華,陳 罕,徐忠信
(吉林大學中日聯誼醫院 神經內科,吉林 長春130033)
本實驗采用PC12細胞是由大鼠腎上腺嗜鉻細胞瘤分離并建立起的細胞系,其在體外經NGF刺激誘導后可向交感神經元分化,最終導致PC12細胞在生理、生化方面具有神經元樣的功能,同時應用體外氧糖剝奪(oxygen-glucose deprivation,OGD)來模擬體內腦缺血過程,為探討缺血缺氧狀態下對神經元的活力、凋亡、信號通路機制的研究定物質基礎。
1 材料和方法
1.1 實驗細胞
大鼠PC12細胞株購自北京金紫晶生物醫藥技術有限公司(中國醫學科學院腫瘤細胞庫)。鼠神經生長因子(NGF)(Sigma公司,美國)。
1.2 實驗方法
1.2.1 PC12細胞的培養、傳代 將細胞懸液加入含有DMEM完全培養基,培養液2-3天更換一次。當細胞匯集至80%時進行傳代接種。
1.2.2 鼠神經生長因子(NGF)誘導PC12細胞轉化為神經元樣細胞PC12細胞培養1-2天,觀察細胞貼壁后,用含NGF終濃度為50ng/ml的培養液進行培養。
1.2.3 PC12細胞轉化為神經元的鑒定 免疫細胞化學染色鑒定PC-12細胞分別在NGF培養液中培養24h后,用NSE免疫細胞化學染色進行鑒定,顯微鏡下觀察,以在細胞膜和胞漿內出現棕黃色顆粒者判定為陽性,每張爬片隨機選取3個100×視野,計數,取均值,計算陽性細胞百分比,其中突起的長度超過胞體直徑2倍者計為陽性,每次至少計數3個孔取平均值。
1.2.4 PC-12細胞 OGD 模型的建立 PC12細胞培養48h后,用缺氧缺糖DMEM培養液洗滌細胞3次,用該液體孵育細胞,將培養板快速放入已造成缺氧環境的缺氧罐中,夾閉進氣口和出氣口;將缺氧罐放入37℃孵箱內開始計時,根據3、6、9、12、16、24 h將細胞隨機分為6組進行評價。
1.2.5 PC-12細胞氧糖剝奪模型評價 MTT法細胞存活率檢測 在OGD不同時間組及對照組每孔加入10μl MTT溶液,后4h,每孔加入100μl二甲基亞砜,在酶聯免疫檢測儀OD490nm處測量各孔的吸光值并計算細胞存活率。AO/EB熒光雙染檢測細胞凋亡 細胞爬片后,將PC-12細胞依據不同的時間點行OGD處理后,取出細胞爬片,固定,滴加AO/EB混合液10-15μl,應用熒光顯微鏡下記錄攝片。
1.3 統計學分析
結果以±s表示,應用SPSS13.0軟件進行方差分析。
2 結果
2.1 PC12細胞的培養
初次復蘇PC12細胞在培養基中呈懸浮狀態,胞體圓形,處于游離期細胞貼壁能力較差,易聚集成團,呈半懸浮狀態;培養24h后細胞開始貼壁生長并分裂增殖,吸附期PC12細胞在培養基中多呈橢圓或多角形,傾向于聚集成團簇狀;培養約72h后,細胞進入對數生長期,此時細胞快速生長和分裂,細胞折光性強,數目明顯增多。
2.2 NGF誘導PC12細胞轉化為神經元樣細胞的培養
PC12細胞轉化神經元樣細胞隨培養時間延長,細胞數量無明顯增加,細胞長出突觸增粗增長,貼壁牢固;培養7d后基本無法消化傳代;培養10d后細胞進入衰退期。
形態學觀察 培養24h可見細胞長出較短、較細的突觸;48h突觸數量及長度增加;72h突觸長度可達胞體的4-5倍,交織成網狀,呈典型的神經元形態,占總數96%以上。
NSE免疫熒光細胞化學染色結果 藍色激發光下可見散在分布、呈星形并帶有較長突起的綠色熒光區域,與背景對比明顯;紫色激發光下,可見復染細胞核呈藍色熒光;圖像融合后證實綠色熒光區域為PC12細胞轉化的神經元樣細胞,NSE免疫熒光染色呈強陽性表達。
2.3 PC-12細胞氧糖剝奪(OGD)模型建立與評價
2.3.1 氧糖剝奪不同時間MTT法細胞存活率檢測
OGD3h細胞存活率較對照組略有降低,但無顯著差異,隨OGD時間延長,細胞存活率逐漸下降,OGD12h后下降更為明顯,OGD24h細胞存活率降至9.08%,與對照組和OGD3h組比較差異顯著(P<0.05),見表1。

表1 OGD不同時間PC12細胞存活率MTT檢測
2.3.2 AO/EB熒光雙染檢測細胞凋亡 正常對照組細胞核呈綠色熒光,見極少量的橙紅色熒光,核呈較規整橢圓形,染色質分布均勻,未見明顯凋亡細胞;OGD3h、6h橙紅色熒光細胞數量較對照組略有所增加;隨OGD時程延長,橙紅色熒光細胞數量進一步增加,可見少數核形態不規則凋亡細胞;OGD16h橙紅色熒光死亡細胞數量明顯增多,綠色熒光細胞數量稀少;OGD 24h細胞多數死亡,可見核碎裂、固縮呈橙紅色熒光,見表2。
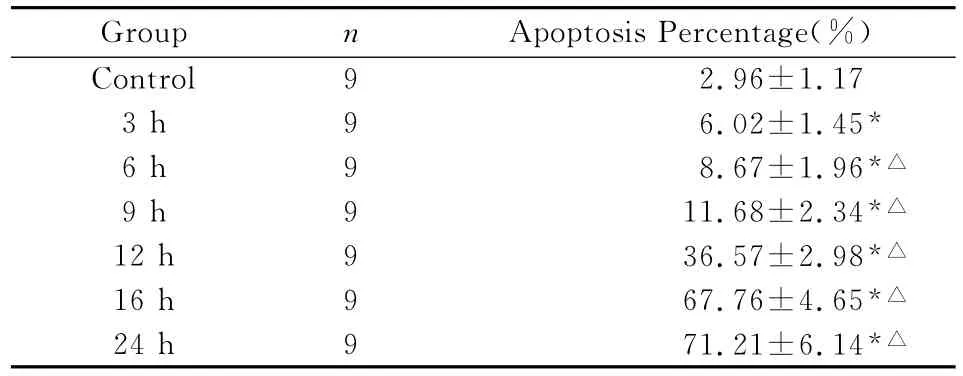
表2 OGD不同時間AO/EB雙染細胞凋亡率檢測
3 討論
在缺血性腦損傷研究中,由于體內環境較為復雜,而在相對單一的體外培養系統因可以對研究條件和研究對象進行人為控制,并可避免體內復雜環境的影響。因神經元是不可再生細胞,神經元原代培養難度較大,最終可用于實驗的數量、純度均受到一定限制。本研究于體外培養PC12細胞,應用NGF刺激誘導其向神經元分化,用于神經元氧糖剝奪模型建立。結果顯示PC12細胞經NGF刺激轉化的神經元樣細胞具有典型的神經元形態,細胞不再增殖分裂,具有神經元特性[1]。經特異性烯醇化酶(Neurospecific enolase,NSE)免疫細胞化學染色后,見NSE陽性神經元胞漿及突觸呈綠色熒光,核呈藍色熒光證實為神經元樣細胞,為后續實驗奠定了基礎。
腦缺血模型報道較多[2,3],為研究機體內的急性缺血性腦損傷機制,常通過建立體外神經細胞的OGD模型,來模擬機體缺血性腦損傷過程[4-6]。在體外建立可模擬機體急性缺血性腦損傷的神經元OGD模型,本研究在建立PC12細胞轉化神經元OGD模型的基礎上,在 OGD3、6、9、12、16、24h應用MTT法對細胞存活率進行了檢測,結果顯示隨OGD時間的延長,細胞存活率逐漸由97.23%下降至9.08%(P<0.05),提示模型建立成功,但 MTT法是以最終溶液OD值間接計算存活率,難以反應細胞凋亡情況。因此,實驗同時應用細胞爬片法應用AO/EB雙染對細胞原位凋亡進行了檢測。實驗結果顯示,在OGD12h之前,雖細胞凋亡率逐漸升高,但變化并不明顯;OGD12h細胞凋亡率迅速升高至較高水平,說明細胞自身有對抗缺血缺氧的能力,但不能維持較長時間,這也印證在大腦皮層細胞在急性缺血時存在缺血半暗帶,在當能量儲備和無氧酵解能力已趨耗竭時,細胞也將逐漸趨向凋亡和死亡。兩組實驗結果相結合說明本實驗采用的氧糖剝奪方法可明顯造成神經細胞損傷,成功模擬體內腦缺血過程,為研究神經細胞缺血損傷提供有效、簡單、實用、可靠的方法和手段。
[1]Greene LA,Tischler AS.Establishment of a noradrenergic clonal line of rat adrenal pheochromocytoma cells which respond to nerve growth factor[J].Proc Natl Acad Sci USA,1976,73 (7):2424.
[2]158.Glazier SS,O′Rourke DM,Graham DI,et al.Induction of ischemic tolerance following brief focal ischemia in rat brain[J].J Cereb Blood Flow Metab,1994,14:545.
[3]161.Sugawara T,Noshita N,Lewen A,et al.Neuronal expression of the DNA repair protein KU 70after ischemia preconditioning corresponds to tolerance toglobal cerebral ischemia[J].Stroke,2001,32(10):2388.
[4]Jones PA,May GR,McLuckie JA,et al.Apoptosis is not an invariable component of in vitro models of cortical cerebral ischaemia.Cell Res.2004;14(3):241-50.PMID:15225418.
[5]Kaushal V,Schlichter LC.Mechanisms of microglia-mediated neurotoxicity in a new model of the stroke penumbra[J].J Neurosci,2008,28(9):2221.
[6]Dugan LL,Kim-Han JS.Astrocyte mitochondria in in vitro models of ischemia[J].J Bioenerg Biomembr,2004,36(4):317.

