中國抗癌協會乳腺癌診治指南與規范(2011版)(選登)
十 乳腺癌全身治療指南
1 乳腺癌術后輔助全身治療臨床指南
1.1 乳腺癌術后輔助全身治療的選擇
乳腺癌術后復發風險的分組見表1,該表可供全面評估患者手術以后的復發風險的高低,是制定全身輔助治療方案的重要依據。乳腺癌術后全身輔助治療的選擇見表2。ER(+)、Her-2(-)患者化療和內分泌治療的選擇見表3。
1.2 乳腺癌術后輔助化療的臨床指南
1.2.1 適應證
⑴腫瘤>2 cm。
⑵淋巴結陽性。
⑶激素受體陰性。
⑷Her-2陽性。
⑸組織學分級為3級。
輔助化療方案的制定應綜合考慮腫瘤的臨床病理學特征、患者方面的因素和患者的意愿以及化療可能的獲益和由之帶來的毒性等。行免疫組化檢測時,應該常規包括ER、PR、Her-2和Ki67。
1.2.2 禁忌證⑴妊娠期:妊娠早、中期患者,應慎重選擇化療。⑵年老體弱且伴有嚴重內臟器質性病變患者。
1.2.3 治療前談話
⑴輔助化療的目的是降低腫瘤復發率,提高總生存率。
⑵化療的不良反應。
⑶>70歲的患者接受化療可能會有獲益,但應慎重權衡化療帶來的利弊。
1.2.4 治療前準備
⑴首次化療前應充分評估患者的臟器功能,檢測方法包括血常規、肝腎功能、心電圖等。以后每次化療前應常規檢測血常規和肝腎功能;使用心臟毒性藥物前應常規做心電圖和(或)左室射血分數(left ventricular ejectionfraction,LVEF)測定;其他檢查應根據患者的具體情況和所使用的化療方案等決定。⑵育齡婦女應作妊娠試驗陰性并囑避孕。⑶簽署化療知情同意書。
1.2.5 輔助化療方案與注意事項(化療詳細方案參見附錄Ⅵ、Ⅶ)
⑴選擇聯合化療方案,常用的有:①以蒽環類為主的方案,如CAF、A (E)C、FE100C方案(C:環磷酰胺,A:多柔比星,E:表柔比星,F:氟尿嘧啶)。雖然吡柔比星(THP)在歐美少有大組的循證醫學資料,但在我國日常臨床實踐中,用同等劑量的吡柔比星代替普通多柔比星也是可行的。THP推薦劑量40~50 mg/m2。②蒽環類與紫杉類聯合方案,例如TAC (T:多西他賽)。③蒽環類與紫杉類序貫方案,例如AC→T/P (P:紫杉醇)或FEC→T。④不含蒽環類的聯合化療方案,適用于老年、低風險、蒽環類禁忌或不能耐受的患者,常用的有TC方案及CMF方案(C:環磷酰胺,M:甲氨蝶呤,F:氟尿嘧啶)。
⑵若無特殊情況,一般不建議減少化療的周期數。
⑶在門診病歷和住院病史中須給出藥物的每平方米體表面積的劑量強度。一般推薦首次給藥劑量不得低于推薦劑量的85%,后續給藥劑量應根據患者的具體情況和初始治療后的不良反應,可以1次下調20%~25%。每個輔助化療方案僅允許劑量下調2次。
⑷輔助化療一般不與內分泌治療或放療同時進行,化療結束后再開始內分泌治療,放療與內分泌治療可先后或同時進行。
⑸化療時應注意化療藥物的給藥順序,輸注時間和劑量強度,嚴格按照藥品說明和配伍禁忌使用。
⑹蒽環類藥物有心臟毒性,使用時須評估LVEF,至少每3個月1次。如果患者使用蒽環類藥物期間發生有臨床癥狀的心臟毒性、或無癥狀但LVEF<45%亦或較基線下降幅度超過15%,應先停藥并充分評估患者的心臟功能,后續治療應慎重。
1.3 乳腺癌術后輔助內分泌治療臨床指南
1.3.1 適應證
激素受體ER和(或)PgR陽性的乳腺癌患者。
1.3.2 治療前談話
⑴輔助內分泌治療的目的是降低腫瘤復發率,提高總生存率。
⑵內分泌治療的不良反應。
1.3.3 內分泌治療與其他輔助治療的次序
輔助內分泌治療與化療同時應用可能會降低療效。一般在化療之后使用,但可以和放射治療以及曲妥珠單抗治療同時應用。
1.3.4 絕經前患者輔助內分泌治療方案與注意事項(絕經標準詳見附錄Ⅷ)
⑴一般情況下,首選他莫昔芬20 mg/d×5年。治療期間注意避孕,并每半年至1年行1 次婦科檢查,通過B超了解子宮內膜厚度。
雖然托瑞米芬在歐美少有大組的絕經前乳腺癌循證醫學資料, 但在我國日常臨床實踐中,用托瑞米芬代替他莫昔芬也是可行的。
⑵卵巢去勢推薦用于下列絕經前患者:①高度風險且化療后未導致閉經的患者,可同時與他莫昔芬聯合應用。卵巢去勢后也可以與第三代芳香化酶抑制劑聯合應用,但目前尚無充分證據顯示其優于卵巢去勢與他莫昔芬的聯合;②不愿意接受輔助化療的中度風險患者,可同時與他莫昔芬聯合應用;③對他莫昔芬有禁忌者。
⑶卵巢去勢有手術切除卵巢、卵巢放射及藥物去勢(GnRHa),若采用藥物性卵巢去勢,目前推薦的治療時間是2~3年。
1.3.5 絕經后患者輔助內分泌治療的方案及注意事項
⑴第三代芳香化酶抑制劑可以向所有絕經后的ER和(或)PR陽性患者推薦,尤其是具備以下因素的患者:①高度復發風險患者;②對他莫昔芬有禁忌的患者;或使用他莫昔芬出現中、重度不良反應的患者;③在用他莫昔芬20 mg/d×5年后的高度風險患者。
⑵芳香化酶抑制劑可以從一開始就應用5年(來曲唑、阿那曲唑或依西美坦),或者在他莫昔芬治療2~3年后再轉用2~3年(依西美坦或阿那曲唑),亦或在他莫昔芬用滿5年之后的高度風險患者再繼續應用5年(來曲唑) 。一旦使用1種第三代芳香化酶抑制劑,如果無特殊原因,不推薦換用其他第三代芳香化酶抑制劑。
⑶可選用他莫昔芬。他莫昔芬20 mg/d×5年,是有效而經濟的治療方案。治療期間應每半至1年行1次婦科檢查,通過B超了解子宮內膜厚度。
⑷也可選用他莫昔芬以外的其他雌激素受體調節劑,如托瑞米芬。
⑸絕經前患者內分泌治療過程中,因月經狀態改變可能引起治療調整。
⑹芳香化酶抑制劑和LHRH類似物可導致骨密度下降或骨質疏松,因此在使用這些藥物前常規推薦骨密度檢測,以后在藥物使用過程中,每6個月監測1次骨密度。并進行T-評分(T-Score),T-Score為<-2.5,開始使用雙膦酸鹽治療;T-Score為-2.5~-1.0,給予維生素D和鈣片治療,并考慮使用雙膦酸鹽;T-Score為>-1.0,不推薦使用雙膦酸鹽。
1.4 乳腺癌術后輔助曲妥珠單抗治療臨床指南
1.4.1 適應證
原發腫瘤>1.0 cm Her-2基因過表達時,推薦使用曲妥珠單抗;原發腫瘤在>0.5 cm但<1.0cm時,可考慮使用。
⑴Her-2/neu基因過表達是指免疫組化法3+,或熒光原位雜交法(FISH)陽性,或者色素原位雜交法(CISH)陽性。
⑵經免疫組化檢測Her-2為(++)的患者應進一步作FlSH或CISH明確是否有基因擴增。
1.4.2 相對禁忌證
⑴治療前LVEF < 50%。
⑵同期正在進行蒽環類藥物化療。
1.4.3 治療前談話
⑴目前正在進行中的臨床研究初步結果顯示:對于Her-2/neu基因過表達的乳腺癌患者采用1年曲妥珠單抗輔助治療可以降低乳腺癌的復發率。
⑵曲妥珠單抗是一種生物靶向制劑,經10年以上的臨床應用證實其不良反應少,但其中較嚴重的不良反應是當其與蒽環類藥物聯合應用會增加充血性心力衰竭的機會。
⑶曲妥珠單抗高昂的價格,Her-2/neu狀態確認的重要性及其檢測費用。
1.4.4 治療前準備
⑴精確的Her-2/neu檢測。建議將浸潤性乳腺癌組織的石蠟標本(蠟塊或白片)送往國內有條件的病理科進行復查。
⑵心功能檢查(心臟超聲或同位素掃描,以前者應用更為普遍)。
⑶簽署治療知情同意書。
1.4.5 治療方案和注意事項
⑴曲妥珠單抗6 mg/kg (首次劑量8 mg/kg)每3周方案,或2 mg/kg(首次劑量4 mg/kg)每周方案。目前暫推薦的治療時間為1年,可與化療同時使用或化療后序貫使用。
⑵首次治療后觀察4~8 h。
⑶與蒽環類藥物同期應用須慎重,但可以前后階段序貫應用。與非蒽環類化療、內分泌治療或放療都可同期應用(具體方案見附錄Ⅵ、Ⅶ)。
⑷每3個月監測1次LVEF。治療中若出現LVEF低于50%或低于治療前≥16%,應暫停治療,并跟蹤監測LVEF結果,直至恢復到50%以上方可繼續用藥。若不恢復、或繼續惡化或出現心衰癥狀則應當終止曲妥珠單抗治療。
2 乳腺癌新輔助化療臨床指南
2.1 新輔助化療的適宜人群
2.1.1 一般適合臨床Ⅱ、Ⅲ期的乳腺癌患者
Ⅰ期患者行術前化療的意義尚不肯定。Ⅳ期患者化療為姑息解救治療手段,而非新輔助治療適應證。
2.1.2 對隱匿性乳腺癌行新輔助化療的可行性
對隱匿性乳腺癌行新輔助化療是可行的。其中隱匿性乳腺癌定義為以窩淋巴結轉移為首發癥狀,而乳房未能檢出原發灶的乳腺癌在排除其他部位原發腫瘤后,盡管臨床體檢和現有的影像學檢查均不能發現乳房腫塊,甚至術后病理也未查及乳腺內的原發病灶,但還是可以診斷這是一類特殊類型乳腺癌。
2.2 新輔助化療的禁忌證
⑴未經組織病理學確診的乳腺癌:推薦得到ER、PR、Her-2/neu及Ki67等免疫組化指標,不推薦將細胞學作為病理診斷標準。
⑵妊娠早期女性。妊娠中期女性患者,應慎重選擇化療。
⑶年老體弱且伴有嚴重心、肺等器質性病變,預期無法耐受化療者。
2.3 新輔助化療前的談話
⑴新輔助化療的定義:新輔助化療是指在手術或手術加放療的局部治療前,以全身化療為乳腺癌的第一步治療,后再行局部治療。基于目前循證醫學的證據,新輔助化療的療效和輔助化療的療效是一樣的,但可以使部分不能保乳的患者獲得保乳的機會,部分不可手術的患者獲得手術的機會。但是一部分患者(< 5%)在新輔助化療的過程中可能出現進展,甚至喪失手術的機會。
⑵新輔助化療的意義:①新輔助化療是局部晚期乳腺癌或炎性乳腺癌的規范療法,可以使腫瘤降期以利于手術,或變不可手術為可手術。②若能達到病理完全緩解,則預示能提高遠期生存率。③對于腫瘤較大且有保乳意愿的患者可以提高保乳率。
⑶部分乳腺癌對新輔助化療初始治療方案不敏感。若2個周期化療后腫瘤無變化或反而增大時,需要更換化療方案或采用其他療法。
⑷接受有效的新輔助化療之后,即便臨床上腫瘤完全消失,也必須接受既定的后續治療,包括手術治療,并根據手術后病理結果決定進一步輔助治療的方案。
2.4 新輔助化療的實施2.4.1 治療前準備
⑴病灶基線體檢:精確測量乳腺原發灶和腋窩淋巴結的最長徑(多個腫塊時取其最長徑之和)。
⑵基線影像學評估:乳房超聲、乳腺X線下腫瘤的最長徑(有條件者可進行MRI評估)。
⑶血常規、肝腎功能、心電圖、胸片、肝臟超聲檢查。局部晚期乳腺癌或炎性乳腺癌患者還需加做全身骨掃描、胸部CT。心臟病者行必要的心功能檢查(如心超測LVEF)。
⑷治療前必須對乳腺原發灶行空芯針活檢,明確組織學診斷及免疫組化檢查(隱匿性乳腺癌除外)。
⑸腫大的區域淋巴結是否為乳腺癌轉移,必須穿刺得到病理證實。如果陽性,不必作前哨淋巴結活檢;如果陰性,可在新輔助化療前行前哨淋巴結活檢。
⑹育齡婦女應妊娠試驗陰性或囑避孕。
⑺告知化療的不良反應,簽署化療知情同意書。
2.4.2 宜選擇含蒽環類和紫杉類的聯合化療方案(附錄Ⅵ、Ⅶ)及注意事項
⑴以蒽環類為主的化療方案,如CAF、FAC、AC、CEF和FEC方案(C:環磷酰胺;A:多柔比星,或用同等劑量的吡柔比星;E:表柔比星;F:氟尿嘧啶)。
⑵蒽環類與紫杉類聯合方案,如A(E)T、TAC(T:多西他賽)。
⑶蒽環類與紫杉類序貫方案,如AC→P或AC→T(P:紫杉醇)。
⑷其他含蒽環類的化療方案,如NE(N:長春瑞濱)。
注意事項:
⑴輔助治療方案應同時包括紫杉類和蒽環類藥物,Her-2陽性者應同時應用抗 Her-2的藥物。
⑵絕經后激素受體強陽性的患者可考慮使用單用內分泌治療,如果使用這樣的治療,應持續5~8個月或至最佳療效。
⑶在門診病歷和住院病史中須給出藥物的每平方米體表面積的劑量強度。一般推薦首次給藥劑量不得低于推薦劑量的85%,后續給藥劑量應根據患者的具體情況和初始治療后的不良反應,可以1次下調20%~25%。
⑷每個新輔助化療方案僅允許劑量下調2次。
2.4.3 療效評估以及化療的療程
⑴建議在化療第1個周期的最后1天,亦即計劃第2個周期化療之前,進行細致的體檢,初步了解化療的治療反應,如果明確腫瘤增大,要考慮早期進展的可能。
⑵一般情況下,建議在化療第2個周期末,即計劃第3個周期之前全面評估療效。新輔助化療前后的檢查手段應該一致,評價結果按照RECTST標準或WHO標準分為CR、PR、SD和PD。
⑶無效的患者建議更改化療方案重新進入評價程序,或改變總體治療計劃,改用手術、放療或者其他全身治療措施。
⑷對CR或PR的患者的處理有爭議。一般可以根據個體情況而有以下選擇:①直接手術;②繼續2~4 個周期的相同方案(總計4~6個周期)化療后,再次評估化療的效果及手術;③若采用AC→T或P方案,則再繼續2個周期的AC,然后更換為4個周期的T或P方案化療后,再次評估化療的效果及手術。
2.5 乳腺癌經新輔助化療降期后的處理
2.5.1 手術分類
手術可根據個體情況選擇根治術、改良根治術、保留乳房手術。
2.5.2 術后病理檢查
⑴病理完全緩解(pCR)的定義有兩種:①一般是指乳腺原發灶中找不到惡性腫瘤的組織學證據,或僅存原位癌成份;②嚴格意義上的pCR是指乳腺原發灶和轉移的區域淋巴結均達到病理完全緩解。
⑵pCR的確定應當由病理醫生完成,但臨床醫生有責任協助病理醫生找到原病灶部位,經過多點取材檢查后,才能確定pCR。
⑶殘存腫瘤的組織學分型、分級、ER、PgR及Her-2等免疫組化結果可供參考。應當根據新輔助化療前取材得到的病理報告,再安排術后治療,如術前ER陰性而術后ER陽性者仍應視為ER陽性的乳腺癌,反之亦然。
2.5.3 術后輔助治療
⑴術后輔助化療:目前尚有爭議。一般可以根據術前化療的周期數、療效以及術后病理檢查結果而再繼續選擇相同化療方案、或更換新的化療方案以及不輔助化療,鑒于目前尚無足夠證據,故無法統一。一般新輔助化療加輔助化療的總周期數為6~8個周期。
⑵術后輔助放療:目前尚有爭議。一種意見認為,無論化療反應如何都應當根據化療前的腫瘤臨床分期,來決定是否需要輔助放療以及輔助放療的范圍,另一種意見則認為應當根據術后的病理分期來決定。本指南傾向按照化療前臨床分期予以處理。
⑶輔助內分泌治療、輔助分子靶向治療:參見乳腺癌術后輔助全身治療臨床指南。新輔助加輔助曲妥珠單抗的總治療時間為1年。
3 晚期乳腺癌解救性全身治療臨床指南
晚期乳腺癌包括復發和轉移性乳腺癌,是不可治愈的疾病。治療的主要目的是緩解癥狀、提高生活質量和延長患者生存期。應盡可能在決定治療方案前對復發或轉移部位進行活檢,尤其是孤立性病灶,以明確診斷和重新評估腫瘤的ER、PR和Her-2狀態。
3.1 晚期乳腺癌內分泌治療指南
3.1.1 適應證
⑴ER和(或)PR陽性的復發或轉移性乳腺癌。
⑵轉移灶僅局限于骨或軟組織。
⑶癥狀的內臟轉移。
⑷復發距手術時間較長,一般>2年。
⑸原則上內分泌治療適合于激素受體陽性的患者,但是如果是受體不明或受體為陰性的患者,只要其臨床病程發展緩慢,也可以試用內分泌治療。
3.1.2 治療前談話
⑴復發或Ⅳ期乳腺癌的全身治療主要以延長生存期、提高生活質量為目的,而非治愈性。因此,應優先選擇毒性盡可能小的治療方案。只要情況允許,毒性較小的內分泌治療優于細胞毒治療。
⑵內分泌治療的不良反應。
3.1.3 內分泌藥物
⑴絕經后患者的內分泌治療包括:芳香化酶抑制劑包括非甾體類(阿那曲唑和來曲唑)和甾體類(依西美坦)、作用于雌激素受體的藥物(他莫昔芬和氟維司群)、孕酮類藥物(甲地孕酮)、雄激素(氟甲睪酮)、大劑量雌激素(乙炔基雌二醇)。
⑵絕經前患者的內分泌治療包括:他莫昔芬、LHRH類似物(戈舍瑞林和luprolide)、外科手術去勢、孕酮類藥物(甲地孕酮)、雄激素(氟甲睪酮)和大劑量雌激素(乙炔基雌二醇)。
3.1.4 內分泌一線治療的選擇和注意事項
⑴沒有接受過抗雌激素治療或距既往的抗雌激素治療1年以上的絕經后復發患者,他莫昔芬和芳香化酶抑制劑都是合理的選擇。
⑵他莫昔芬輔助治療失敗的絕經后患者可選芳香化酶抑制劑或氟維司群。
⑶既往接受過抗雌激素治療并且距抗雌激素治療1年內復發轉移的絕經后患者,芳香化酶抑制劑是首選的一線治療。
⑷未接受抗雌激素治療的絕經前患者,可選擇治療為他莫昔芬,卵巢去勢,或卵巢去勢加他莫昔芬或芳香化酶抑制劑。
3.1.5 內分泌解救治療的選擇及注意事項
⑴盡量不重復使用輔助治療或一線治療用過的藥物。
⑵他莫昔芬治療失敗的絕經后患者可選芳香化酶抑制劑或氟維司群。
⑶一類芳香化酶抑制劑治療失敗患者可選另外一類芳香化酶抑制劑、氟維司群或孕激素(醋酸甲地孕酮/甲羥孕酮)。
⑷ER陽性的絕經前患者可采取卵巢手術切除或其他有效的卵巢功能抑制治療,隨后遵循絕經后婦女內分泌治療指南。
⑸二線內分泌治療之后的內分泌治療有效選擇,尚缺乏高水平的證據供參考。
3.2 晚期乳腺癌化療的臨床指南
3.2.1 適應證(具備以下1個因素即可考慮首選化療)
⑴激素受體陰性。
⑵有癥狀的內臟轉移。
⑶素受體陽性但對內分泌治療耐藥的患者。
⑷年齡<35歲。
3.2.2 治療前談話
⑴化療的目的是改善生活質量,延長生存期。⑵化療的不良反應。
3.2.3 治療前準備
⑴首次化療前應檢測血常規、肝腎功能、心電圖。以后每次化療前后應常規檢測血常規,使用蒽環類藥物者還須檢查心電圖或LVEF。心臟或肝腎功能異常者需監測血常規、心電圖、LVEF或肝腎功能。
⑵育齡婦女應妊娠試驗陰性并囑避孕。⑶簽署化療知情同意書。
3.2.4 化療方案和注意事項(具體方案見附件Ⅵ、Ⅶ)
⑴推薦的首選化療方案包括單藥序貫化療或聯合化療。與單藥化療相比,聯合化療通常有更好的客觀緩解率和疾病至進展時間,然而聯合化療的毒性較大且生存獲益很小。此外,序貫使用單藥能降低患者需要減小劑量的可能性。需要使腫瘤迅速縮小或癥狀迅速緩解的患者選擇聯合化療,耐受性和生活質量作為優先考慮因素的患者選擇單藥序貫化療。
⑵一線單藥包括:蒽環類,如多柔比星、表柔比星、聚乙二醇化脂質體多柔比星;紫杉類,如紫杉醇、多西他賽、白蛋白結合紫杉醇;抗代謝藥,如卡培他濱和吉西他濱;以及非紫杉類微管形成抑制劑,如長春瑞濱。
⑶一線聯合化療方案包括:環磷酰胺、多柔比星和氟尿嘧啶(FAC/CAF);氟尿嘧啶、表柔比星和環磷酰胺(FEC);多柔比星、環磷酰胺(AC);表柔比星、環磷酰胺(EC);多柔比星聯合多西他賽或紫杉醇(AT);環磷酰胺、氨甲喋呤和氟尿嘧啶(CMF);多西他賽聯合卡培他濱;吉西他濱聯合紫杉醇。
⑷其他有效的單藥還包括環磷酰胺、順鉑、口服依托泊苷、長春花堿、米托蒽醌和氟尿嘧啶持續靜脈給藥方案。
⑸標準的藥物治療為應用一個治療方案直至疾病進展換藥,但由于缺乏總生存期方面的差異,應該采用長期化療還是短期化療后停藥或維持治療需權衡療效、藥物不良反應和患者生活質量。
⑹蒽環類藥物有心臟毒性,使用時須評估LVEF,至少每3個月1次。如果患者使用蒽環類藥物期間發生有臨床癥狀的心臟毒性、或無癥狀但LVEF<45%或較基線下降>15%,首先停藥,充分評估患者的心臟功能,后續治療應該慎重。盡管早期有臨床試驗提示同時使用右丙亞胺和蒽環類藥物可能會降低化療的客觀有效率,但是薈萃分析顯示右丙亞胺會引起較重的粒細胞減少,但是并未降低化療的療效,且可降低約70%的心力衰竭發生率。
3.3 Her-2陽性的晚期乳腺癌治療的臨床指南
3.3.1 適應證
Her-2/neu陽性的復發或轉移性乳腺癌。
⑴Her-2/neu陽性是指免疫組化檢測為(+++),或熒光原位雜交法(FISH)或者色素原位雜交法(CISH)顯示Her-2基因擴增。
⑵免疫組化檢測Her-2為(++)的患者,應該進一步行FISH或CISH檢測明確是否有基因擴增。
3.3.2 相對禁忌證
⑴治療前LVEF<50%。
⑵同時進行蒽環類化療。
⑶治療過程中,LVEF較基線下降≥15%。
3.3.3 治療前談話
⑴在常規化療的基礎上加用曲妥珠單抗不但可以提高客觀有效率和中位PFS,而且可延長患者的總生存期。
⑵曲妥珠單抗是一種生物靶向制劑,經10年以上的臨床應用總體安全性良好,但有可能影響心臟射血功能和增加充血性心力衰竭的機會。
⑶曲妥珠單抗價格貴,Her-2/neu狀態確認的重要性及其檢測費用。
3.3.4 治療前準備
⑴準確的Her-2/neu檢測。有條件盡量行轉移灶的再次活檢,以證實轉移灶的 Her-2狀態是否有轉變。并可將原手術組織的標本和轉移灶標本(蠟塊或白片)送往國內有條件的病理科進行復查。
⑵心功能檢查(心臟超聲或同位素掃描,以前者應用更為普遍)。
⑶簽署治療知情同意書。
3.3.5 一線治療方案的選擇和注意事項
⑴曲妥珠單抗可聯合的化療藥物和方案有紫杉醇聯合或不聯合卡鉑、多西他賽、長春瑞濱和卡培他濱。
⑵Her-2和激素受體同時陽性的晚期乳腺癌患者中,對病情發展較慢或不適合化療的患者,可以選擇曲妥珠單抗聯合內分泌治療。
⑶使用期間,每3個月檢查1次LVEF。
3.3.6 二線治療方案的選擇和注意事項
⑴在含曲妥珠單抗方案治療后發生疾病進展的Her-2陽性轉移乳腺癌患者中,后續治療應繼續阻滯Her-2通路。
⑵可保留曲妥珠單抗,而更換其他化療藥物,如卡培他濱。
⑶也可換用拉帕替尼與其他化療藥物,如卡培他濱。
⑷也可停細胞毒藥物,而使用兩種靶向治療藥物的聯合,如拉帕替尼聯合曲妥珠單抗。
4 終末期乳腺癌姑息性治療臨床指南
4.1 適應證
⑴有難以控制的腫瘤相關癥狀,如疼痛、厭食和惡液質、惡心嘔吐等。
⑵腫瘤相關的生理和心理問題,如體能狀況下降(ECOG≥3分或KPS<50分)、精神錯亂、譫妄、脊神經壓迫、惡液質、肝腎功能衰竭及嚴重的伴發疾病等。
⑶無有效治療手段的進展期疾病。⑷預期生命<3個月。
4.2 治療前談話
⑴使患者及家屬了解疾病的狀況和理解后續治療的性質。
⑵了解患者及家屬對姑息性治療的需求和做出相應的具體的姑息性措施。
4.3 腫瘤相關癥狀的控制和注意事項
4.3.1 疼痛
⑴腫瘤晚期疼痛的處理應遵循三階梯止痛原則。具體原則:①應盡量口服給藥;②按時給藥;③按階梯給藥,按照疼痛的程度和性質選用不同階梯的止痛藥物,先用非麻醉性鎮痛劑,在常規非麻醉性鎮痛劑無效時,可應用可待因等弱阿片類藥物,疼痛仍不能控制者可使用強阿片類藥物,如嗎啡、芬太尼等;④用藥劑量個體化,并注意具體細節。
⑵注意藥物的不良反應,如便秘、頭痛等,平衡止痛療效與不良反應。
⑶可應用一些輔助用藥增加止痛效果,減少不良反應。如安定類藥物、抗抑郁藥物、抗痙攣藥物等加強止痛療效,胃黏膜保護劑、胃腸動力藥物和通便緩瀉藥等,可使腫瘤患者避免過早出現鎮痛藥的不良反應。
⑷針對性治療,如骨轉移患者推薦應用雙膦酸鹽和局部放療等較積極的治療手段。
⑸增加醫生與患者之間的溝通,了解患者疼痛的具體細節并予以指導和幫助,有助于控制疼痛。有證據顯示,以電話為基礎的由接受過培訓且有資質的護士組成的患者管理系統能夠顯著緩解患者的癌癥相關的情緒低落和癌癥疼痛。
4.3.2 厭食和惡液質
⑴晚期癌癥患者都可能發生厭食和惡液質,影響患者生活質量。
⑵癌癥患者惡液質的主要癥狀有:厭食、消瘦、貧血、蛋白質的丟失以及代謝失常等。
⑶可用甲地孕酮、甲羥孕酮或類固醇類藥物來治療厭食和惡液質,癥狀好轉后停用。
⑷對終末期的患者過度行營養支持治療有可能會帶來更多的痛苦,甚至可能會縮短患者的壽命。終末期患者的水化和營養措施應主要為口干的護理和終末期患者的家屬的護理知識普及。
4.3.3 惡心和嘔吐
⑴明確嘔吐原因,有治療相關性嘔吐(如化療、放療等)、疾病相關性(如腦轉移、胃腸道梗阻等)。
⑵針對原因進行治療,如放療和化療前預防性給予止吐藥物、腦轉移者給予脫水、胃腸道梗阻者給予胃腸減壓等處理。
⑶非特異性的惡心嘔吐給予多巴胺受體拮抗劑或苯二氮卓類藥物,尤其適用于焦慮所致的惡心嘔吐。
⑷頑固性惡心嘔吐可持續靜脈給藥或皮下給藥,如可進行多巴胺受體拮抗劑的劑量滴定至最大獲益和耐受水平。若惡心仍持續存在,可考慮加用5-羥色胺受體拮抗劑和(或)抗膽堿能藥物和(或)抗組胺藥物,糖皮質激素,持續止吐藥物滴注,安定類藥物甚至大麻類藥物。針灸和鎮靜劑也可考慮。
⑸注意劇烈嘔吐有可能引起上消化道出血,另須注意電解質平衡。
4.3.4 惡性胸水
⑴對全身治療抗拒的腫瘤引起的惡性胸水,會引起患者呼吸困難,局部對癥治療可以緩解癥狀。
⑵在胸腔穿刺后,可以直接抽胸水后拔除穿刺管,也可以行胸腔閉式引流術。前者可以明確胸水的性質和暫時緩解癥狀,但快速大量放液可導致低血壓、低蛋白血癥、引起虛脫、縱隔擺動和肝性昏迷等,另外多次放液易引起腔內繼發感染。胸腔閉式引流術,可置管數日或數周,注入細胞毒藥物或硬化劑,療效較好。
⑶局部胸腔內用藥可選用順鉑、多柔比星、博來霉素等化療藥物,也可選用萬特普安、短小棒狀桿菌、白介素-2、干擾素及卡介苗等生物反應調節劑。一般認為局部用藥的主要機理是以化學性粘連作用為主。
⑷大多數藥物胸腔注射的常見不良反應有胸痛、發熱,偶有低血壓。這些不良反應一般不嚴重,對癥處理可以控制。
4.3.5 乏力
⑴腫瘤相關的乏力(CRF)很常見,臨床上漏診和漏治現象非常普遍。腫瘤本身和腫瘤治療均可引起CRF,其具體機制尚不明確,是身體對抗過度負荷及其造成的組織損傷的一種反應,與疼痛有協同作用。
⑵CRF往往與其他臨床表現共同存在,其臨床常見癥候群為乏力、疼痛、苦惱和睡眠障礙等。大多數接受化療的患者和終末期患者均存在睡眠障礙,發生率約是正常人群的3倍,常見的表現為失眠綜合征和入睡困難。
⑶CRF需與心情壓抑相區別,前者隨治療時間的延長而增加,后者隨治療時間的延長而減輕。
⑷CRF評估會受到患者或醫務工作者等人為因素影響,以前評估時很少采用客觀指標,現在建議加用客觀指標,如6 min步行法(the 6-minute walk)。
⑸CRF的治療可分為兩個方面:①找不到病因,主要以非藥物治療治療。非藥物治療主要包括保存體力,合理使用體力以及養成良好的睡眠習慣等。瑜伽可以改善睡眠和生活質量、減輕乏力。②找到病因,對因治療:乏力可由其他藥物所致,如倍他樂克引起心率減慢而導致乏力,引起嗜睡的藥物導致乏力。伴隨的其他疾病也可以引起乏力,如心衰和甲狀腺功能低下。
十一 乳腺癌患者康復治療共識
1 康復治療的定義
康復包括生理功能的恢復、心理狀態的調整以及社會活動能力的恢復。乳腺癌的康復治療就是在乳腺癌正規治療同時或結束后,幫助患者恢復機體生理功能、調整心理狀態,并且能夠回歸社會,重建被疾病破壞了的生活。
2 康復治療的內容
2.1 患側上肢功能的鍛煉
2.1.1 術后上肢功能鍛煉
功能鍛煉對于恢復患者肩關節功能和消除水腫至關重要,但必須嚴格遵守循序漸進的順序,不可隨意提前,以免影響傷口的愈合。
循序漸進方法:術后1~2 d,練習握拳、伸指、屈腕;
術后3~4 d,前臂伸屈運動;
術后5~7 d,患側的手摸對側肩、同側耳(可用健肢托患肢);
術后8~10 d,練習肩關節抬高、伸直、屈曲至90°;術后10 d后,肩關節進行爬墻及器械鍛煉。
⑴功能鍛煉的達標要求是:2周內患肢上臂能伸直、抬高繞過頭頂摸到對側的耳。達標后仍需繼續進行功能鍛煉。
⑵術后7 d內限制肩關節外展。
⑶嚴重皮瓣壞死者,術后2周內避免大幅度運動。
⑷皮下積液或術后1周引流液超過50 mL時應減少練習次數及肩關節活動幅度(限制外展)。
⑸植皮及行背闊肌皮瓣乳房重建術后要推遲肩關節運動。
2.1.2 預防或減輕上肢水腫
一般認定患側上肢周徑比對側上肢周徑長<3 cm為輕度水腫,3~5 cm為中度,>5 cm 為重度水腫。
⑴預防感染:保持患側皮膚清潔;不在患肢手臂進行有創性的操作,例如抽血、輸液等;洗滌時戴寬松手套,避免長時間接觸有刺激性的洗滌液;避免蚊蟲叮咬;衣著、佩戴首飾或手表時一定要寬松。
⑵避免高溫環境:避免燙傷;患側手臂不要熱敷,沐浴時水溫不要過高;避免強光照射和高溫環境。
⑶避免負重:避免提、拉、推過重的物品;避免從事重體力勞動或較劇烈的體育活動。
⑷其他:盡快恢復手臂功能;乘坐飛機時戴彈力袖套。
⑸淋巴水腫的自我護理方法:①輕度或中度淋巴水腫:抬高手臂;沿淋巴走向自下而上向心性按摩;做手臂功能恢復訓練;戴彈力袖套。②重度淋巴水腫:戴彈力袖套;物理治療。如手臂出現變紅或異常硬等癥狀,亦或水腫嚴重時應考慮有感染發生,應抗感染及對癥處理。
2.2 營養和運動
乳腺癌疾病本身的進展或治療期間的不良反應均有可能會導致患者營養不良,而飲食過剩造成超重,也是乳腺癌患者康復期所面臨的問題之一。癌癥患者同時也是第二原發癌癥、心血管疾病、糖尿病、骨質疏松癥的高危人群,合理的營養、健康的生活方式在乳腺癌患者康復期顯得尤為重要。
2.2.1 飲食營養
目前為止尚沒有證據證明某一類食品的飲食與乳腺癌的復發或轉移相關。
⑴可選用易消化、高蛋白、高維生素、低脂肪的食物。
⑵需要禁忌的食物有:①胎盤及其制品;②未知成分的保健品。
2.2.2 運動
康復期應選擇一項適合自己并能終生堅持的有氧運動。可向患者推薦的運動有快走、騎車、游泳、打太極拳以及有氧舞蹈等。
均衡飲食及有氧運動可增強人體免疫系統、有效減輕精神壓力、改善睡眠、緩解由癌癥及對其治療而引起的疲勞癥狀,增加人體對疾病的抵抗能力。
2.2.3 建立健康的生活方式
⑴保持正常的體重;
⑵堅持日常鍛煉;
⑶減少酒精的攝入,不要抽煙;
⑷慎用保健品。
2.3 心理狀態的調整
2.3.1 不良情緒的心理干預
乳腺癌患者的不良情緒主要集中在自尊、身體影響、焦慮和抑郁。
醫護人員需要了解患者的心理變化特點及心理狀態調整的過程,以提供必要的心理干預。醫護人員可以在認知、決策、應對技能等方面提升患者的自我控制能力,指導患者合理地運用暗示、宣泄等應對技巧,以增加對于困境的忍耐力。避免給予患者過多的同情與憐憫,向患者強調保持常態的重要性,幫助患者盡快擺脫患者角色,積極面對生活。
⑴提供充分信息,幫助患者理性接受患病事實。醫護人員可參與患者的認知矯正,幫助她們進行適當的反思,減少錯誤的想法,減輕患者的恐懼。
⑵幫助患者尋找積極的生存目的,建立生活的信心。醫護人員必須及時且正確地評估患者當前的期望,包括患者與其家屬之間的依賴關系。幫助患者意識到自身的價值,對家庭其他成員的重要性,以增加其與疾病抗爭的信心。
⑶激發患者的承擔意識,協助其有效地控制自我。實施以患者為中心的醫療護理模式,幫助患者充分發揮她們的決策權,激發她們的自我承擔意識。
2.4 性康復指導
⑴了解乳腺癌及其治療對性生活可能產生影響的全部信息。需要告訴她們的是導致女性產生性欲的性激素是雌激素。女性約一半的雌激素是由位于腎臟上方的腎上腺產生的,而卵巢產生另一半的雌激素。女性只需要很少量的雌激素就能維持性欲所需要的正常水平。
⑵無論將采用何種治療手段,經愛撫獲得愉悅的能力不會改變。
⑶試著享受其他感覺性愉悅的方式,伴侶間應該互相幫助,通過觸摸和愛撫來達到性高潮。
⑷與伴侶進行關于性問題的交流。沉默是性健康最大的敵人,如果永遠不敢開口咨詢,那么將永遠不會解脫。
相關建議:
⑴改善與伴侶有關性生活方面的溝通;
⑵嘗試感性的按摩;
⑶讀一本性知識的好書,增加對性的知識和技巧;
⑷增加性幻想;
⑸與伴侶分享自己的性幻想;
⑹鼓勵伴侶在性活動中更積極主動;
⑺告訴伴侶以自己喜歡的方法來進行。
2.5 生育指導
雖然目前沒有證據顯示生育會影響乳腺癌患者的預后,但在選擇是否生育,以及何時生育時必須充分考慮患者疾病復發的風險和治療對后代的影響,與患者也要有充分的溝通。
⑴乳腺原位癌患者在結束了手術和放療之后即可考慮生育。
⑵淋巴結陰性的乳腺浸潤性癌患者在手術2年后可考慮生育
⑶淋巴結陽性的乳腺浸潤性癌患者在手術5年后可考慮生育。
⑷需要輔助內分泌治療的患者,在受孕前3個月停止內分泌治療(例如諾雷得、三苯氧胺或其他SERMs),直至生育后哺乳結束,再繼續內分泌治療。
2.6 術后隨訪指導
⑴早期乳腺癌患者在術后應定期隨訪,以了解患者的生存狀況,以及患者對輔助治療的依從性和不良反應等。
⑵隨訪時間:術后(或結束輔助化療后)第1~2年每3個月1次,第3~4年每4~6個月1次,第5年開始每年1~2次。
⑶隨訪檢查內容:觸診體檢、肝臟超聲、血生化和血常規。
⑷其他特殊檢查:乳房X線(每年1次),婦科檢查(三苯氧胺治療中每年1次),骨密度(芳香化酶抑制劑治療中)。
⑸骨掃描、CT或MRI等可用于有癥狀的患者,但不推薦無癥狀患者常規應用。
2.7 提供綜合社會支持,促進社會活動能力的恢復
醫護人員可以根據患者的需要,積極調動環境因素與社會資源,給患者提供幫助、鼓勵和支持,最大限度地恢復患者的社會功能。2000年,澳大利亞頒布了第一個關于對乳腺癌患者支持性照護的循證指南,稱為“心理社會的臨床實踐指南:為乳腺癌患者提供信息、咨詢和支持”。指南中特別建議所有的女性都應該得到治療小組的情感支持和社會支持,也應該得到同輩支持小組的信息和支持。從這一點可以看出,在乳腺癌患者的社會支持網絡中,應涵蓋專業支持,家庭支持和同輩支持。
綜合社會支持的內容:
⑴專業支持:以提供醫學信息和心理支持為主,可以開設康復課程、專業講座,設立康復熱線、康復值班室、康復網站,出版康復相關的書籍等。
⑵家庭支持:以鼓勵家屬參與患者的診治和康復過程為主,可以開設家屬信息咨詢窗口,為家屬提供交流平臺等。
⑶同輩支持:以康復病友志愿者的參與為主,可以采用病房探視或新病友座談會的形式,建議在醫護人員的專業指導和監督下進行。
十二 乳房重建與整形臨床指南
1 乳房重建的目的
女性因各種原因,特別是接受乳房惡性腫瘤手術治療后,可能造成乳房的缺失或乳房外形的毀損。乳房重建可以幫助乳腺癌患者重塑身體外形,使兩側乳房基本對稱,能夠使患者在穿上衣著后,自信地恢復正常的社會和生活角色。
2 乳房重建的指征
乳房重建適合于因各種原因準備或已經接受乳房切除的女性,或因為保乳手術導致乳房明顯變形的患者。
3 乳房重建的類型
根據重建的時間,乳房重建可以分為即刻重建和延期重建兩大類。乳房重建可以在全乳切除的同時,在一次麻醉過程中完成,稱為即刻重建;也可以在全乳切除術后的數月或數年后進行,稱為延期重建,這一重建的時間往往取決于患者。乳房重建的時機選擇取決于很多因素,只有充分考慮了兩種重建手術的優缺點,以及患者自身的諸多因素,才能確定最佳的時間。
根據重建的材料,乳房重建可以分為自體組織(皮瓣)重建、植入物重建以及聯合兩種材料(如背闊肌聯合植入物)的重建。
4 乳房重建的原則與注意事項
⑴乳腺癌手術后的乳房重建應該由一支專業的多學科團隊完成,在術前對患者進行充分評估,評估內容包括腫瘤治療策略、體型、個體及家屬的要求、合并的疾病及有無吸煙史,從而確定手術的安全切緣、乳房重建的最佳時機和方法、手術與輔助治療的順序安排。
⑵保留皮膚的全乳切除可以使接受即刻乳房重建后的乳房的美容效果得到極大的改善,證據顯示,與傳統的全乳切除手術比較,保留皮膚的全乳切除不會增加局部和區域的腫瘤復發風險。對于乳腺癌患者而言,保留乳頭乳暈復合體的全乳切除手術也受到關注,一些報道顯示,乳頭乳暈復合體受腫瘤累及的比例雖然較低,短期隨訪中仍有少部分病例發生局部復發,但是目前仍缺乏長期的隨訪數據;同時,保留乳頭乳暈復合體后,乳頭感覺、乳房外形自我滿意度等生活質量數據缺乏好的研究報告,這一術式應審慎開展,尚有待前瞻性臨床研究證實其安全性。
⑶保乳手術過程中,通常采用腫塊廣泛切除或更大范圍的區段/象限切除術,足夠安全的切緣距離意味著切除較大范圍的正常乳腺組織,有可能導致乳房局部腺體缺失,術后或放療后出現乳房變形、乳頭乳暈復合體移位等乳房外觀的不滿意。在不影響腫瘤局部治療效果的前提下,術前由腫瘤外科醫生或整形外科醫生對乳房的缺損進行評估,并做好相應準備,術中采用腫瘤整形手術技術,在缺損部位進行局部的充填,根據腫瘤部位、乳房大小和乳房下垂情況設計相應的切口。這一術式可以通過一次麻醉和手術過程完成,能在一定程度上改善乳房的形態與外觀。和常規保乳手術相同,也需要在原術腔放置4~6枚惰性金屬夾以備術后放療時作為瘤床的標記。
⑷乳房重建的方法包括植入物、自體組織以及聯合上述兩種材料。植入物可以在乳房重建手術時,在胸大肌下方直接放置永久假體;或者先行放置組織擴張器,再擇期更換為永久假體。植入物可以使用鹽水囊假體、硅膠假體或含有硅膠外殼的鹽水囊混合型假體。自體組織重建可以選擇多種帶蒂或游離皮瓣,轉移至胸壁進行乳房塑型;最為常用的自體組織皮瓣包括:擴大背闊肌肌皮瓣、帶蒂橫型腹直肌肌皮瓣(TRAM)、游離橫型腹直肌肌皮瓣(F-TRAM)、保留肌束的游離TRAM(MS FTRAM)、腹壁下血管穿支皮瓣(DIEP)、臀上動脈穿支皮瓣(SGAP)等。游離皮瓣乳房重建涉及顯微外科技術,以及游離皮瓣的術后監測團隊的建立。
⑸乳房重建和整形手術中尚需要考慮到其他的手術方式,包括乳頭乳暈重建,對側乳房的縮乳成型、乳房提升、隆乳,目的是達到雙側乳房的對稱效果;一般而言,這些手術往往分期實施,并應該在術前和患者充分溝通。
5 術后放療與乳房重建的關系
明確需要接受術后輔助放療的患者,首先考慮采用自體皮瓣的延期重建;放療可能對重建乳房的外形造成不利影響;有經驗的團隊可考慮即刻重建后再給予放療。當考慮進行組織擴張和植入物即刻重建時,建議先放置組織擴張器,在放療開始前或結束后更換為永久性假體。曾經接受放療的患者如果采用植入物重建,常發生較嚴重的包囊攣縮、移位、重建乳房美觀度差和植入物暴露,因此,放療后的延期乳房重建,不宜使用組織擴張器和植入物的重建方法。
十三 乳腺導管原位(內)癌治療指南
乳腺導管原位癌(ductal carcinoma in situ,DCIS),亦稱為導管內癌,屬于乳腺浸潤性癌的前驅病變,是一類非全身性的導管內局部病變。乳腺癌病理組織學分類中按細胞核形態將DCIS分為低、中、高三個級別,不同級別的DCIS可能具有不同的遺傳學起源和發生背景。DCIS具有進展為浸潤性癌的趨勢。極少數患者在確診為DCIS時伴腋淋巴結轉移。有些腋淋巴結轉移的患者也可能是由于腫瘤原發灶取材不當、未發現浸潤性成分造成的,這種情況下的DCIS與本指南所提的DCIS有著本質區別。部分DCIS患者存在DCIS伴微浸潤(AJCC分期將DCIS微浸潤定義為癌細胞突破基底膜并侵犯鄰近組織,但病灶最大徑不超過0.1 cm,分期為 T1mic)。對于DCIS伴微浸潤的患者,目前國際上缺乏治療共識,本指南不作特別規定,以個體化治療策略為主。
DCIS的診斷,必須要以病理充分取材為前提,在排除潛在的浸潤成分以后,方可確診。空心針活檢、局部切除活檢,以及對病灶的不充分取材,都不是確診DCIS的依據。
1 治療原則
乳腺DCIS的治療目的是降低局部復發率。以局部治療為主,治療方式包括局部病灶廣泛切除聯合或不聯合全乳放療,以及全乳房切除術。必要時輔以內分泌治療(如他莫昔芬),主要目的是降低局部復發,及預防同側和對側再發。對DCIS患者,沒有證據提示化療能帶來生存獲益;也沒有證據顯示Her-2陽性(針對導管內癌成分)患者能夠從曲妥珠單抗治療中獲益。
2 局部廣泛切除聯合全乳腺放療
2.1 適應人群,禁忌證,術前準備,手術過程,術后病理檢查
請參見“浸潤性乳腺癌保乳治療臨床指南”相關章節。
對于腋窩淋巴結的處理,請參見“前哨淋巴結活檢”相關章節。
2.2 全乳放療
⑴全乳放療在術后乳腺切口愈合后就可以開始,推薦在術后8周內開始。
⑵放射治療的基本技術以及劑量請參見“浸潤性乳腺癌保乳治療臨床指南”相關章節。和浸潤性癌原則相似,仍推薦全乳照射后瘤床加量,尤其在對絕經前患者的治療中。
2.3 輔助內分泌治療
⑴適應證:ER/PR陽性的乳腺導管內癌(注意:若單純以預防對側第二原發乳腺癌為目的,激素受體陰性患者也可接受他莫昔芬預防用藥)。
⑵目的:降低同側復發和對側第二原發乳腺癌。
⑶劑量:放療結束后建議采用他莫昔芬20 mg/d(10 mg每日2次),連續服用5年,治療期間應每半年至一年行1次婦科檢查。對于老年(>65歲)、伴有心血管疾病的患者,應充分權衡他莫昔芬帶來的獲益與心血管事件間的利弊。
3 其他治療選擇
3.1 全乳房切除術
⑴適應證:所有不適合或拒絕接受保留乳房治療的患者。
⑵方法:單純乳房切除術、保留乳頭乳暈的全乳房切除術(病灶位于乳頭乳暈的不適用)、保留皮瓣的全乳房切除術。
⑶注意事項:皮下乳房切除術難以100%地切除乳腺腺體組織,因此全乳房切除術并不能完全避免局部復發。
⑷術后不需要聯合放療。
3.2 單純局部切除術
目前僅推薦用于個別年齡>70歲,或伴有嚴重內科疾病,或因其他原因無法接受全乳房切除術和全乳放療,或Van Nays預后指數提示低危的患者。術后仍建議對ER/PR陽性、無他莫昔芬禁忌證的患者采用他莫昔芬治療5年。
4 乳腺DCIS治療方式選擇的參考——VanNuys預后指數
國外某些學者采用Van Nuys預后指數(簡稱VNPI)作為一個客觀的指標以協助臨床醫生對DCIS治療方式進行決策。VNPI對DCIS按腫瘤大小、患者年齡、手術切緣、腫瘤細胞核分級4個方面綜合考慮,每一方面評分由1分(最佳)至3分(最差),4個方面總分由最低的4分(最佳)至最高的12分(最差)。VNPI 10~12分者建議行全乳切除術,VNPI 4~6分者可行單純局部切除術,而VNPI 7~9分者則建議行局部廣泛切除聯合全乳放療。VNPI的具體評分方法詳見附錄Ⅸ。
注:目前對于VNPI的臨床應用價值仍有爭議,在此僅供臨床醫師參考。
十四 Her-2陽性乳腺癌臨床診療
專家共識
腫瘤分子靶向治療,是利用腫瘤細胞表達而正常細胞很少或不表達的特定基因或基因的表達產物作為治療靶點,最大程度殺死腫瘤細胞而對正常細胞殺傷較小的治療模式。人類表皮生長因子受體2(Her-2)是乳腺癌明確的預后指標和藥物治療效果的預測指標。作為第一個靶向Her-2的人源化單克隆抗體,曲妥珠單抗的問世改變了Her-2陽性乳腺癌患者的預后,影響了乳腺癌的診治模式,是乳腺癌藥物治療的重要突破。2007年拉帕替尼作為晚期乳腺癌二線治療藥物也在歐美批準上市,盡管目前在中國尚未上市,但其臨床試驗也正在中國部分醫院進行。為了更好地推廣規范的Her-2檢測,準確評估患者預后,更大地發揮抗Her-2的靶向治療藥物使用的療效,減少治療盲目性,使更多患者獲益,中國抗癌協會乳腺癌專業委員會專家組成員,根據現有國內外研究結果討論后達成以下共識。
1 標準Her-2檢測和結果判定
⑴Her-2是乳腺癌重要的預后指標,同時也是靶向抗Her-2藥物的預測指標。
⑵靶向抗Her-2藥物治療適應證是Her-2陽性乳腺癌。
⑶Her-2陽性的定義,可以是標準免疫組化(IHC)+++,或原位熒光雜交法(FISH)陽性。
⑷如果患者免疫組化檢測顯示Her-2(+++),可以直接判斷為Her-2陽性; 如果免疫組化檢測Her-2(++),應該再進行FISH檢測以明確。如果標準實驗室免疫組化檢測結果 Her-2 (+)或 Her-2 (-) ,則判斷為Her-2陰性。
⑸Her-2陽性判斷也可以通過FISH檢測。在合格實驗室進行的FISH檢測,比值>2.2則可判斷為Her-2陽性;<1.8則為Her-2陰性患者;如果所得結果為1.8~2.2的臨界值,則應該結合免疫組化結果判斷。
⑹如果患者病情發展不符合Her-2陰性患者特點,臨床認為有可能是Her-2陽性,或者復發轉移患者治療過程中為了爭取治療機會,建議進行Her-2的重新檢測,可以用原發腫瘤標本,但更提倡復發病灶再活檢,方法可以用IHC或FISH。
2 Her-2陽性復發轉移乳腺癌治療原則
2.1 治療原則
⑴Her-2陽性晚期復發轉移乳腺癌,首選治療應該是含曲妥珠單抗為基礎的治療,根據患者激素受體狀況、既往(新)輔助治療用藥情況,選擇治療方案,使患者最大受益。
⑵曲妥珠單抗單藥治療Her-2陽性轉移性乳腺癌有一定療效,但更多臨床研究顯示,曲妥珠單抗與化療藥物聯合效果更好。Slamon等發表在新英格蘭醫學雜志(NEJM)的曲妥珠單抗聯合紫杉醇,Marty等發表在臨床腫瘤學雜志(JCO)的曲妥珠單抗聯合多西紫杉醇的兩項關鍵Ⅲ期臨床研究結果,奠定了曲妥珠單抗聯合紫杉類藥物作為Her-2陽性晚期乳腺癌一線治療的地位。所以蒽環類化療失敗的Her-2 陽性乳腺癌,曲妥珠單抗聯合紫杉醇或多西紫杉醇,可以作為首選的一線方案。
⑶紫杉類治療失敗的Her-2陽性乳腺癌,曲妥珠單抗可以聯合長春瑞濱、鉑類、卡培他濱、吉西他濱等其他化療藥物。
⑷研究結果顯示,曲妥珠單抗聯合阿那曲唑一線治療Her-2同時ER/PR陽性晚期乳癌,無進展生存期、臨床獲益率和至疾病進展時間均顯著優于阿那曲唑單藥。所以Her-2與激素受體陽性的絕經后轉移性乳腺癌患者,可以采用曲妥珠單抗聯合芳香化酶抑制劑治療。
2.2 曲妥珠單抗治療疾病進展后治療策略
⑴繼續使用曲妥珠單抗,更換其他化療藥物:傳統細胞毒藥物治療,出現疾病進展意味著需要更換治療方案。但曲妥珠單抗由于其不同的作用機制,患者曾經治療有效而其后出現疾病進展時并不一定需要停藥。臨床前研究顯示,持續應用曲妥珠單抗抑制Her-2表達有助于控制乳腺癌細胞生長,而停止曲妥珠單抗,腫瘤生長加快。Hermine研究顯示,一線使用曲妥珠單抗疾病進展后,繼續使用曲妥珠單抗比停止使用曲妥珠單抗治療療效更好。GBG26/BIG03-05隨機臨床試驗中,曲妥珠單抗治療疾病進展轉移性Her-2陽性乳腺癌,隨機分為單用卡培他濱和卡培他濱聯合曲妥珠單抗,結果顯示疾病進展后繼續使用曲妥珠單抗的治療仍能取得更長的無疾病進展時間。因此,Her-2陽性乳腺癌曲妥珠單抗聯合化療治療出現疾病進展后,可保留曲妥珠單抗繼續使用,而換用其他聯合化療方案。
⑵拉帕替尼聯合卡培他濱:臨床研究證明,曲妥珠單抗治療失敗的乳腺癌,拉帕替尼聯合卡培他濱比單用卡培他濱的至疾病進展時間延長,所以曲妥珠單抗方案治療后疾病進展Her-2陽性患者也可以選擇拉帕替尼聯合卡培他濱。
⑶還可以考慮曲妥珠單抗聯合拉帕替尼的非細胞毒藥物的方案。
3 Her-2陽性乳腺癌曲妥珠單抗輔助治療原則
臨床研究結果表明,曲妥珠單抗用于Her-2陽性早期乳腺癌術后輔助治療,可明顯降低復發和死亡。因此美國綜合癌癥網(NCCN)和中國cNCCN乳腺癌臨床實踐指南都將曲妥珠單抗輔助治療寫入其中。
3.1 Her-2 陽性乳腺癌曲妥珠單抗輔助治療用藥推薦
⑴AC-TH:多柔比星(或表柔比星)聯合環磷酰胺,1/21 d×4個周期,然后紫杉醇或多西紫杉醇4個周期,同時曲妥珠單抗周療2 mg/kg(首劑 4 mg/kg),或3周1次6 mg/kg(首劑8 mg/kg),共1年。
⑵不適合蒽環藥物的患者可以用TCH:多西紫杉醇75 mg/m2,卡鉑 AUC6,每21 d為1個周期,共6個周期,同時曲妥珠單抗周療, 化療結束后曲妥珠單抗6 mg/kg,3周1次,至1年。
⑶標準化療后單用曲妥珠單抗治療1年,曲妥珠單抗6 mg/kg(首劑 8 mg/kg),每3周方案,治療時間為1年。
⑷HERA研究4年隨訪結果顯示,對于術后初始未接受曲妥珠單抗治療的Her-2陽性乳腺癌,延遲使用曲妥珠單抗輔助治療也可以獲益,因此輔助化療已經結束, 但仍處于無病狀態的患者可以使用1年曲妥珠單抗。
目前認為,Her-2陽性乳腺癌曲妥珠單抗輔助治療,合適的用藥周期為 1年,因為Finher最新隨訪結果并沒有證明短程的9周曲妥珠單抗治療能改善預后,所以目前并不推薦曲妥珠單抗輔助治療9周方案,同樣至今也無證據表明2年輔助治療的效果更好。
3.2 曲妥珠單抗在輔助治療中的心臟毒性
曲妥珠單抗聯合化療藥物可能增加心肌損害,嚴重者會發生心力衰竭。盡管NSABPB-31、N9831和HERA三項試驗中心臟毒性事件數不高并且可以恢復,但臨床研究入選的病例是化療后經過心臟功能安全篩選的。臨床實踐中建議在對既往史、體格檢查、心電圖、超聲心動圖LVEF基線評估后再開始應用曲妥珠單抗,使用期間應該每3個月監測心功能。若患者有無癥狀性心功能不全,監測頻率應更高(如每6~8周1次),出現下列情況時,應停止曲妥珠單抗治療至少4周,并每4周檢測1次LVEF:
⑴LVEF較治療前絕對數值下降≥16%。
⑵LVEF低于該檢測中心正常范圍并且LVEF較治療前絕對數值下降≥10%。
⑶4~8周內LVEF回升至正常范圍或LVEF較治療前絕對數值下降≤15%,可恢復使用曲妥珠單抗。
⑷LVEF持續下降(>8周),或者3次以上因心肌病而停止曲妥珠單抗治療,應永久停止使用曲妥珠單抗。
4 Her-2陽性乳腺癌的含曲妥珠單抗新輔助治療
臨床試驗研究證明,術前新輔助治療獲得病理學完全緩解(pCR)患者無病生存(DFS)和總生存(OS)均優于同樣治療未達到pCR的患者。Her-2 陽性患者新輔助治療,曲妥珠單抗聯合化療與單用化療相比能夠顯著提高pCR率。Buzdar新輔助治療試驗中,曲妥珠單抗聯合紫杉醇序貫CEF化療的pCR率高達65.2%,顯著高于單純化療組的26.3%(P=0.016)。NOAH研究結果顯示,Her-2陽性局部晚期乳腺癌,曲妥珠單抗聯合AT/T/CMF方案能顯著提高pCR率(43% vs 23%,P=0.002)。但現有新輔助治療數據相對不足,臨床考慮方案應該慎重,而設計臨床研究方案更要謹慎考慮科學性和倫理學原則。要注意短期的曲妥珠單抗聯合化療使用,可能獲得更高的pCR, 但并不一定獲得更長的無病生存,更難以確定OS的改善,所以不能代替后續長期的輔助治療。
因此術前新輔助治療用過曲妥珠單抗的患者,術后輔助推薦曲妥珠單抗,治療總療程 1年。Her-2陽性乳腺癌患者如果術前新輔助治療未用過曲妥珠單抗,術后輔助治療推薦曲妥珠單抗。
現代乳腺癌診斷和分類,應該是在標準的傳統病理組織學基礎上,添加更好的免疫組化診斷和更新的分子病理診斷。乳腺癌的科學合理綜合治療,有賴于病理科、影像科室和臨床有關學科合作,在國內外治療指南和臨床診療專家共識的基礎上規范預后指標和預測指標的檢測,合理治療、提高患者生活質量與生存率。
十五 乳腺癌局部和區域淋巴結復發診治指南
1 局部和區域復發的定義
局部復發是指早期乳腺癌乳房保留治療后同側乳腺內,或可手術乳腺癌乳房切除術后同側胸壁再次出現腫瘤;區域復發是指患側的淋巴引流區,包括腋窩、鎖骨上/下及內乳淋巴結區域出現腫瘤。孤立性復發是指在發現局部區域復發時,通過常規檢查未發現合并其他部位的轉移。
2 診斷
完整全面地檢查以明確復發時有無合并遠處轉移。
細針穿刺雖然可以提供復發的依據,但仍需要獲得復發灶的組織診斷,并確定復發病變的生物學標志物(ER、PR和Her-2)狀態。
影像學(包括功能影像)診斷,需要覆蓋完整的胸壁和區域淋巴結。如果復發患者既往曾接受術后放療,則診斷復發時的影像學檢查還需要增加對有無放射性肺損傷的評估。如接受過術后放療的患者出現臂叢神經癥狀或上肢水腫,且臨床無明顯淋巴結腫大,推薦行增強MRI或PET-CT掃描,有助于鑒別復發和放射性纖維化。18-FDG PET-CT對于復發患者評估復發的完整范圍、有無遠處轉移,以及術后改變與放射性損傷之間的鑒別都有優于傳統影像的優勢。
3 治療原則
無論乳房保留治療后復發還是乳房切除術后復發,均需要多學科評估和治療,以最大程度優化治療原則,目的在于一方面有效地控制局部疾病,另一方面盡可能地減少或延遲再次復發或遠處轉移的發生。
3.1 保乳術后同側乳房復發
⑴單灶復發或可手術的復發患者,補救性乳房切除是最主要的局部治療手段,可以獲得60%~70%的5年局部控制率和約85%的總生存率。同時如果首次手術時未行腋窩淋巴結清掃,乳房切除術的同時可行I/II組腋窩淋巴結清掃。若以往曾經行腋窩淋巴結清掃,經臨床或影像學檢查發現淋巴結侵犯證據時可行腋窩手術探查或補充清掃。
⑵若復發范圍廣泛或累及皮膚,甚至呈現炎性乳腺癌表現,則需先行全身治療后再考慮局部手術和(或)放療。
⑶補救性乳房切除術后一般不考慮胸壁放療,但如腋窩淋巴結有轉移而既往未行區域淋巴結照射的患者需補充鎖骨上/下淋巴結的照射。
3.2 乳房切除術后復發
與保乳術后孤立乳房內復發患者相比,乳房切除術后胸壁和區域淋巴結復發的患者預后較差。同時首發胸壁復發患者,后續鎖骨上淋巴結復發率較高。而首發區域淋巴結復發的患者,后續胸壁復發率也可高達30%。所以在既往沒有接受過術后放療的患者,在首次復發行放療時,需包括易再次復發的高危區域。
3.3 胸壁復發
胸壁結節可切除者,推薦局部廣泛切除。但是單純手術切除的后續再次復發率可達60%~75%,放射治療可以顯著降低再次復發率,是局部區域性復發患者綜合治療的主要手段之一。首次復發患者局部小野照射會帶來高達50%以上的再次復發率,且小野照射后再次復發中有2/3位于原射野以外,所以在既往沒有接受過術后放療的患者中照射靶區需要覆蓋患側全胸壁,并需要對鎖骨上/下淋巴引流區進行預防性照射。彌漫性復發患者,需要先行全身治療,根據局部病變的退縮情況并排除遠處轉移后,再行胸壁和區域淋巴結的放療。
對于以往曾經行術后放療的患者,再次照射的價值尚未證實,若復發病變不能手術或切除不完全,在充分考慮術后放療與復發的時間間隔,放療后正常組織改變的程度、局部-區域復發的風險,并且平衡了再照射的風險和益處之后,可針對復發病變局部再照射。
3.4 孤立的腋窩淋巴結復發
手術切除為主要的治療手段,若以往未行腋窩淋巴結清掃,則需要補充清掃。而腋清掃后復發患者如可手術,則對復發灶行補充切除。在既往無術后放療的患者補充腋清掃后,需對鎖骨上/下淋巴引流區和胸壁行預防性照射。對于復發病變無法完全切除的患者,照射范圍還需包括腋窩。
3.5 鎖骨上淋巴結復發
如既往未行放療,放療靶區需包括鎖骨上/下淋巴引流區和胸壁;如既往有乳房和胸壁照射史,可單獨給予鎖骨上/下淋巴引流區的放療,照射野需與原射野銜接。
3.6 內乳淋巴結復發
同鎖骨上淋巴結復發處理原則,如既往無胸壁照射史,放療范圍需要包括患側胸壁。但胸壁和其他區域淋巴結復發患者,在放療靶區的選擇上,原則上不需要對內乳區進行預防性照射。
3.7 放射治療技術
和二維治療相比,基于CT定位的三維治療計劃可以顯著提高靶區覆蓋程度,并合理評估正常組織照射體積和劑量,推薦在復發患者中盡可能采用。全胸壁和區域淋巴結照射劑量達到50 Gy/25 f或相應的生物等效劑量后對復發灶需要加量至60 Gy,對未切除的復發灶照射劑量需要達到60 Gy以上,但必須控制正常組織損傷。加熱配合局部放療可以在一定程度上改善局部控制率。
3.8 全身治療策略
全身治療在下列情況下需要考慮:激素受體陽性患者內分泌治療,具有可持續治療和降低再次復發率的價值;復發灶廣泛乃至放射治療難以覆蓋完整的靶區;同期放化療可以提高局部控制率;Her-2陽性患者可以聯合靶向治療。和其他復發轉移患者的治療原則一致,推薦局部-區域復發患者參加前瞻性臨床研究。
十六 乳腺癌骨轉移的臨床診療指南
1 概述
在晚期乳腺癌中,骨轉移的發生率為65%~75%,而首發癥狀為骨轉移者占27%~50%。骨痛、骨損傷、骨相關事件(SREs)及生活質量降低是乳腺癌骨轉移常見的并發癥。骨相關事件包括:骨痛加劇或出現新的骨痛、病理性骨折(椎體骨折、非椎體骨折)、椎體壓縮或變形、脊髓壓迫、骨放療(因骨痛或防治病理性骨折或脊髓壓迫)、骨轉移病灶進展(出現新發、多發骨轉移、原有骨轉移灶擴大)及高鈣血癥。
2 骨轉移的診斷方法
骨放射性核素掃描(ECT)是骨轉移初篩診斷方法。具有靈敏度高、早期發現、全身成像不易漏診的優點。但也存在特異度較低、不易區分成骨性還是溶骨性病變、也不能顯示骨破壞程度的缺點。骨ECT檢查推薦用于乳腺癌出現骨疼痛、骨折、堿性磷酸酶升高、高鈣血癥等可疑骨轉移的常規初篩診斷檢查;乳腺癌分期>T3N1M0患者的進一步行常規分期檢查。骨ECT檢查也可選擇性用于乳腺癌患者的常規分期檢查。
磁共振掃描(MRI)、或CT掃描、X線拍片是骨轉移的影像學確診檢查方法。對于骨ECT掃描異常的患者,應該針對可疑骨轉移灶部位進行MRI、CT、X線拍片檢查,以確認骨轉移診斷,并了解骨破壞的嚴重程度。
正電子發射計算機斷層顯像(PET-CT),可以直接反映腫瘤細胞對葡萄糖的攝入,已有臨床研究提示 FDG-PET具有與骨掃描相似的靈敏度,更高的特異度,對乳腺癌骨轉移治療后病情的跟蹤優于骨掃描,但是專家組認為目前PET-CT在骨轉移診斷的價值有待進一步研究,臨床并不作為常規推薦。
所以骨轉移的臨床診斷,ECT可以作為初篩檢查,X 線、CT、MRI 可以明確有無骨質破壞,PETCT的價值有待進一步研究,臨床上各種診斷方法應該合理應用,必要時需要通過骨活檢取得病理診斷。
對于確診骨轉移的乳腺癌患者,應進一步常規檢查:血常規、肌酐、血鈣等肝腎功能及血生化指標檢查;胸、腹、骨盆影像學檢查。
3 乳腺癌骨轉移的臨床表現
乳腺癌骨轉移多見為多發性溶骨性病變,有些患者在溶骨病變治療后的修復可以在影像學中表現為過度鈣化而被誤診為成骨性改變,對這部分患者應追溯其首診時的X片是否有溶骨性改變。 乳腺癌骨轉移的特點:伴有疼痛的骨轉移嚴重影響患者生活質量,但骨轉移本身一般不直接對生命構成威脅;有效的治療手段較多,不合并內臟轉移的患者生存期相對較長。
4 骨轉移的治療
4.1 治療目標
乳腺癌骨轉移綜合治療的主要目標:
①緩解疼痛,恢復功能,改善生活質量;②預防和治療骨相關事件;
③控制腫瘤進展,延長生存期。
4.2 治療方案
乳腺癌骨轉移,作為復發轉移性乳腺癌已經是全身性疾病,可以選擇的治療手段有:①化療、內分泌治療、分子靶向治療等;②雙膦酸鹽治療;③手術治療;④放射治療;⑤鎮痛和其他支持治療。應根據患者具體病情制定個體化綜合治療方案(圖1)。
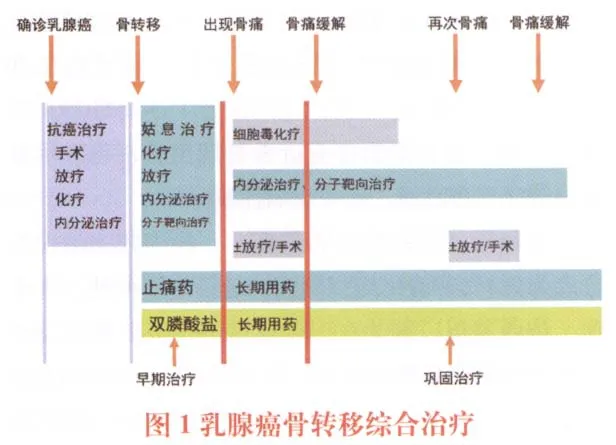
圖1 乳腺癌骨轉移綜合治療
4.3 治療原則
全身治療為主,其中化療、內分泌治療、分子靶向治療作為復發轉移性乳腺癌的基本藥物治療,雙膦酸鹽類可以預防和治療骨相關事件。合理的局部治療可以更好地控制骨轉移癥狀,其中手術是治療單發骨轉移病灶的積極手段,放射治療是有效的局部治療手段。
復發轉移性乳腺癌選擇治療方案,要考慮患者腫瘤組織的激素受體狀況(ER/PR)、Her-2情況、年齡、月經狀態以及疾病進展是否緩慢。原則上疾病進展緩慢的激素反應性乳腺癌患者可以首選內分泌治療,疾病進展迅速的復發轉移患者應首選化療,而Her-2過表達的患者可以考慮單用或聯合使用曲妥株單抗治療。
進展緩慢的復發轉移性乳腺癌的特點:
⑴復發和(或)復發轉移灶腫瘤組織ER陽性和(或)PR陽性;
⑵術后無病生存期較長的復發轉移患者(如術后2年后出現復發轉移);
⑶僅有軟組織和骨轉移,或無明顯癥狀的內臟轉移(如非彌散性的肺轉移和肝轉移,或腫瘤負荷不大且不危及生命的其他內臟轉移)。
激素反應性(hormone responsive)乳腺癌的概念,是基于患者可能從內分泌治療中獲益的角度來界定哪些患者適合內分泌治療,認為滿足下列條件中1條或數條的患者有可能從內分泌治療中獲益:
⑴原發灶和(或)復發轉移灶ER和(或) PR陽性。
⑵老年患者。
⑶術后無病間期較長。
⑷既往內分泌治療曾獲益。
基于乳腺癌骨轉移本身一般不直接構成生命威脅,且不合并內臟轉移的患者生存期相對較長,因此盡量避免不必要的強烈化療。而晚期乳腺癌患者,如治療后疾病長期保持穩定則應視為臨床獲益,因為持續穩定6個月以上的患者生存期與CR+PR相同。基于內分泌治療更適合長期用藥,可以盡量延長治療用藥時間,延長疾病控制時間。
絕經后復發轉移性乳腺癌,一線內分泌治療的首選為第3代芳香化酶抑制劑,包括阿那曲唑、來曲唑、依西美坦,因為在三苯氧胺治療失敗的復發轉移性乳腺癌的二線治療中,第3代芳香化酶抑制劑比甲地孕酮更有效。在復發轉移性乳腺癌的一線內分泌治療中,第三代的芳香化酶抑制劑明顯優于三苯氧胺。絕經前復發轉移性乳腺癌患者首選化療,適合或需要用芳香化酶抑制劑作為內分泌治療時,可以采取藥物性卵巢功能抑制聯合芳香化酶抑制劑(但尚缺乏臨床證據)。乳腺癌骨轉移患者,如ER和PR陰性、術后無病間隔期短、疾病進展迅速、合并內臟轉移、對內分泌治療無反應者應考慮化療。推薦用于轉移性乳腺癌化療的藥物包括:蒽環類、紫杉類、卡倍他濱、長春瑞濱、吉西他濱。可以選擇化療方案有:CMF、CAF、AC、AT、XT、GT方案。輔助治療僅用內分泌治療而未用化療的患者可以選擇CMF(CTX/MTX/5-FU)、CAF(CTX/ADM/5-FU)或AC(ADM/CTX)方案。輔助治療未用過蒽環類和紫杉類化療的患者首選AT方案(蒽環類聯合紫杉類),如CMF輔助化療失敗的患者;部分輔助治療用過蒽環類和(或)紫杉類化療,但臨床未判定為耐藥和治療失敗的患者也可使用AT方案。蒽環類輔助治療失敗的患者,可以選擇的方案有:XT(卡倍他濱聯合多西他賽)和GT(吉西他濱聯合紫杉醇)方案。紫杉類治療失敗的患者,目前尚無標準方案推薦,可以考慮的藥物有卡倍他濱、長春瑞濱、吉西他濱和鉑類,可以單藥或聯合化療。但單純骨轉移患者一般不采用聯合化療。
4.4 放射治療
放射治療是乳腺癌骨轉移姑息性治療的有效方法。骨疼痛是骨轉移的常見癥狀,也是影響患者生活質量及活動能力的主要原因。脊椎、股骨等負重部位骨轉移并發病理性骨折的危險性約30%,病理性骨折將顯著影響患者的生存質量和生存時間。放射治療用于乳腺癌骨轉移治療的主要作用:緩解骨疼痛、減少病理性骨折的危險。
放射治療方法包括體外照射與放射性核素治療2類。
體外照射是骨轉移姑息治療的常用有效方法。體外照射的主要適應證:有癥狀的骨轉移灶,用于緩解疼痛及恢復功能;選擇性用于負重部位骨轉移的預防性放療,如脊柱或股骨轉移。骨轉移放射治療的體外照射常用劑量及分割方法有3種方案:300 cGy/f,共10次;400 cGy/f,共5次;800 cGy/f,單次照射。3種方法照射的緩解骨疼痛的療效及耐受性無明顯差異。單次放療方案的治療費用顯著低于分次照射,但再放療及病理性骨折發生率高于分次放療。骨轉移單次照射技術尤其適于活動及搬動困難的晚期癌癥患者。
放射性核素治療對緩解全身廣泛性骨轉移疼痛有一定療效,但是有些核素治療后骨髓抑制發生率較高,而且恢復較緩慢,約需12周,可能會影響化療的實施。因此,放射性核素治療的臨床使用應充分考慮選擇合適的病例和恰當的時機。
放射治療緩解骨痛的有效率為59%~88%。值得注意的是放療緩解骨痛的顯效需要一定的時間,因此對于在放射治療明顯顯效前的患者及放射治療不能完全控制疼痛的患者,仍然需要根據患者的疼痛程度使用止痛藥以及必要的雙膦酸鹽治療,可以使用負荷劑量。
4.5 手術治療
骨轉移外科治療目的是提高患者生活質量,骨外科技術的進步能夠使癌癥骨轉移患者最大限度解決對神經的壓迫、減輕疼痛、恢復肢體功能,從而改善患者生活質量。應對骨轉移患者密切隨訪觀察、早期發現骨轉移灶、對具有潛在病理骨折的長骨是否需要手術作出恰當的判斷是提高患者生活質量的重要保證。
外科手術治療乳腺癌骨轉移的方法包括:骨損傷固定術、置換術和神經松解術。固定術治療可考慮選擇性用于病理性骨折或脊髓壓迫,預期生存時間>4周的乳腺癌骨轉移患者。預防性固定術治療可考慮選擇性用于股骨轉移灶直徑>2.5 cm,或股骨頸骨轉移,或骨皮質破壞>50%,預期生存時間>4周的乳腺癌骨轉移患者。
4.6 止痛藥治療
止痛藥是緩解乳腺癌骨轉移疼痛的主要方法。骨轉移疼痛的止痛藥治療應遵循WHO癌癥三階梯止痛指導原則:首選口服及無創給藥途徑;按階梯給藥;按時給藥;個體化給藥;注意具體細節。
止痛藥物包括非甾體類抗炎止痛藥、阿片類止痛藥、輔助用藥。
常用非甾體類抗炎藥包括:乙酰氨基酚、布洛芬、雙氯芬酸鈉、吲哚美辛、萘普生、塞來昔布、氯諾昔康等。
常用阿片類止痛藥包括:嗎啡緩釋片、芬太尼透皮貼劑、羥考酮控釋片、嗎啡即釋片、可待因、美沙酮等。哌替啶不宜用于癌痛治療。
輔助用藥包括三環類抗抑郁藥、抗驚厥類藥、神經弛緩劑和糖皮質激素等。
非甾體類抗炎藥是骨轉移疼痛藥物止痛治療的基礎用藥,當止痛效果不佳時,或出現中重度疼痛時,推薦合用阿片類止痛藥。選擇阿片緩釋劑按時用藥,有利于持續緩解骨疼痛。然而,骨轉移疼痛患者在持續慢性疼痛的同時,大約63%的骨轉移患者伴有突發性(爆發性)疼痛。對頻繁發作的突發性疼痛的患者,可以通過增加止痛藥的按時用藥劑量緩解疼痛。對少數患者則無法通過增加止痛藥按時用藥劑量控制疼痛,甚至因無法耐受藥物不良反應而不能增加按時用藥的劑量。控制突發性疼痛的主要方法是備用速效或短效止痛藥。控制突發性疼痛的短效止痛藥單次用藥劑量一般為日用劑量的5%~10%。對于難治的突發性疼痛患者,可考慮使用患者自控藥泵法給藥。發生神經病理性疼痛時,應根據病情選擇輔助用藥。例如出現灼痛、墜脹痛等表現時,可選擇合用阿米替林、去甲替林或多慮平等三環類抗抑郁劑;出現電擊樣疼痛或槍擊樣疼痛等表現時,可選擇合用加巴噴丁或卡馬西平等抗驚厥劑。止痛藥可與雙膦酸鹽類藥、放療等方法綜合治療。
5 乳腺癌骨轉移雙膦酸鹽臨床應用專家共識
5.1 雙膦酸鹽類藥物的共性和個性
5.1.1 作用原理
雙膦酸鹽是焦膦酸鹽分子的穩定類似物。破骨細胞聚集于礦化骨基質后,通過酶水解作用導致骨重吸收,而雙膦酸鹽可以抑制破骨細胞介導的骨重吸收作用。雙膦酸鹽可以抑制破骨細胞成熟,抑制成熟破骨細胞的功能,抑制破骨細胞在骨質吸收部位的聚集,抑制腫瘤細胞擴散、浸潤和黏附于骨基質。
5.1.2 適應證
①高鈣血癥;②骨痛;③治療和預防骨相關事件(SREs)。SREs對乳腺癌骨轉移患者的生活質量具有至關重要的影響,它包括病理性骨折、脊髓壓迫、為了緩解骨痛或預防和治療病理性骨折或脊髓壓迫而進行放療、骨骼手術、改變抗癌方案以治療骨痛、惡性腫瘤所至高鈣血癥。目前在乳腺癌骨轉移中使用雙膦酸鹽的主要目的正是降低SREs的發生率。
臨床研究證實雙膦酸鹽可以有效治療乳腺癌的骨轉移。正如英國國家臨床推薦治療方案
研究所(NICE)的建議,這類藥物目前正被廣泛用于治療晚期乳腺癌的骨并發癥。而隨后的臨床研究證明,雙膦酸鹽可以預防乳腺癌骨轉移患者發生SREs。所以乳腺癌骨轉移,如果預期的生存期≥3個月,且肌酐低于3.0 mg/dL,在治療病情所需的化療和激素治療的同時,應及時給予雙膦酸鹽治療。
5.1.3 臨床用藥及使用方法
雙膦酸鹽化學結構中與中心碳原子連接的側鏈不同,雙膦酸鹽類藥物的臨床活性和功效亦有所不同:
第一代雙膦酸鹽以氯膦酸二鈉為代表,這些藥物在30年前進入臨床使用。
用量和用法:氯膦酸二鈉目前有靜脈、口服2種制劑可供選擇,雙膦酸鹽口服制劑方便在家用藥,也方便和口服化療藥物和內分泌藥物聯合使用。臨床上也可以先采用靜脈滴注氯膦酸二鈉400 mg/d,連用 3 d,而后口服氯膦酸二鈉1 600 mg/d,共3~4周作為1個周期的用法。氯膦酸二鈉主要經腎臟清除,因此,在氯膦酸二鈉治療過程中一定要維持足夠的水份攝入。氯膦酸二鈉膠囊應整粒吞服。任何情況下不能將氯膦酸鹽與含有鈣或其他二價陽離子的牛奶、食物或藥物同服,因為它們會減少氯膦酸鹽的吸收。
第二代是含氮的雙膦酸鹽,包括帕米膦酸二鈉、阿侖膦酸鈉,這些藥物抑制骨吸收的體外活性作用要強于第一代藥物。
用量和用法:帕米膦酸鹽靜脈滴注,每次60~90 mg,輸注時間不少于2 h,每3~4周用藥1次。
第三代為具有雜環結構的含氮雙膦酸鹽唑來膦酸和不含環狀結構含氮的伊班膦酸,在作用強度和療效方面比第二代有了進一步提高。
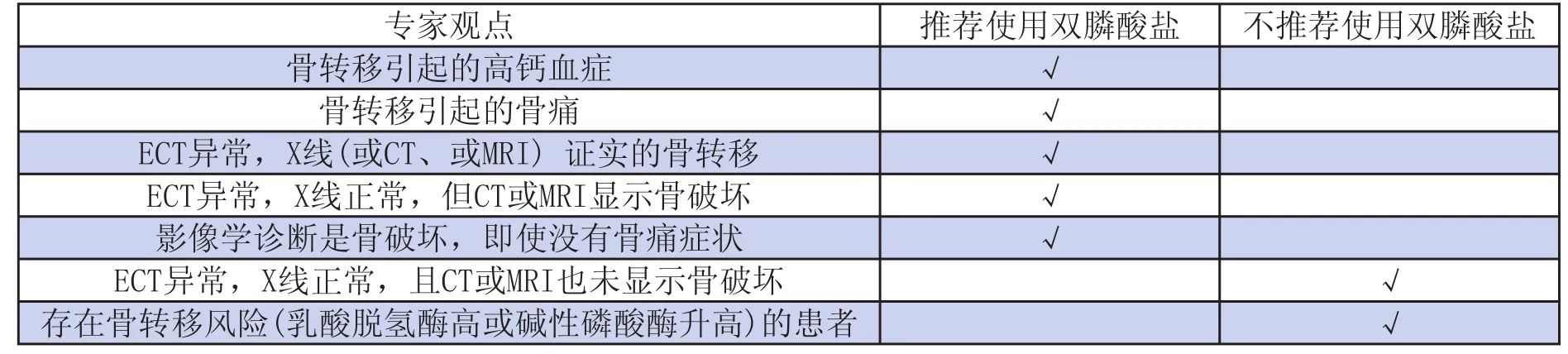
表4 雙膦酸鹽推薦使用情況
用量和用法:
唑來膦酸鹽4 mg iv >15 min,1/3~4周。伊班膦酸鹽6 mg iv >15 min,1/3~4周。
⑴伊班膦酸治療轉移性骨病:常規劑量:6 mg 每3~4周靜注1次,每次靜注不短于15 min,1/3~4周。
⑵伊班膦酸負荷劑量(loading dose):伊班膦酸負荷劑量可快速緩解伴有嚴重疼痛的轉移性骨痛患者,使用方法:6 mg/d, 連續3 d靜注,以后每3~4周常規使用6 mg/次。
伊班膦酸目前在國外有靜脈、口服2種制劑可供選擇,靜脈滴注6 mg伊班膦酸和口服50 mg伊班膦酸療效相當,而口服制劑可方便在家用藥,也方便和口服化療藥物和內分泌藥物聯合使用。
5.2 雙膦酸鹽的使用適應證和用藥時機
具體使用情況見表4。
5.3 雙膦酸鹽的使用方法及注意事項
⑴在使用雙膦酸鹽前,應該檢測患者血清電解質水平,重點關注血肌酐、血清鈣、磷酸鹽、鎂等指標。
⑵臨床研究表明第一代氯膦酸鹽、第二代帕米膦酸鹽和第三代唑來膦酸和伊班膦酸鹽,都有治療乳腺癌骨轉移的作用。都可以用于治療高鈣血癥、骨痛、預防和治療骨轉移相關事件。已有臨床研究結果顯示,第三代雙膦酸鹽唑來膦酸和伊班膦酸有療效更好、毒性更低和使用更方便的優點。
⑶選擇藥物治療應考慮患者的一般狀況和、疾病的總體情況及同時接受的治療。靜脈內使用唑來膦酸和伊班膦酸具有輸液時間更短的優勢。
⑷雙膦酸鹽可以與放療、化療、內分泌治療、止痛藥聯合使用。
⑸長期使用雙膦酸鹽應注意每天補充鈣500 mg和維生素D。
⑹在輕中度腎功能不全(肌酐清除率>30 mL/min)的患者中無需調整劑量,但嚴重腎功能不全(肌酐清除率≤30 mL/min)患者,應根據不同產品的說明書進行劑量調整減量或延長輸注時間。
⑺鑒于有文獻報道少數患者在長期使用雙膦酸鹽后有發生下頜骨壞死的風險,所以使用雙膦酸鹽前應注意進行口腔檢查,注意每日口腔清潔,服藥期間盡量避免包括拔牙等口腔手術。
5.4 用藥時間及停藥指征
5.4.1 用藥時間
研究證明,雙膦酸鹽用于乳腺癌出現骨相關事件的中位時間為6~18個月,所以用藥時間至少6個月。
5.4.2 停藥指征
⑴使用中監測到不良反應,且明確與雙膦酸鹽相關;
⑵治療過程中出現腫瘤惡化,出現其他臟器轉移并危及生命;
⑶臨床醫生認為需要時;
⑷但經過其他治療后骨痛緩解,不是停藥指征。
5.5 生化標志物
目前有部分生化指標可能幫助醫生了解患者對雙膦酸鹽的治療反應——但目前局限于科研領域,不建議臨床使用。
5.6 臨床資料和專家觀點
5.6.1 雙膦酸鹽預防骨轉移的作用
盡管已有研究提示,雙膦酸鹽可能有預防骨轉移的作用,并可能有潛在的預防內臟轉移的作用,但雙膦酸鹽預防骨轉移的臨床研究仍在進行中。所以但對于沒有骨轉移影像學證據的患者,以及出現骨外轉移但沒有骨轉移證據的患者,目前均不推薦使用雙膦酸鹽。
5.6.2 雙膦酸鹽作為乳腺癌術后輔助治療用藥
體外研究顯示,雙膦酸鹽藥物有抗腫瘤作用,但臨床研究還在進行中。盡管有小樣本研究證明,乳癌術后標準放療、化療、內分泌治療后,后續加用雙膦酸鹽治療可降低骨轉移甚至內臟轉移的風險,但是大規模研究尚未完成,因此目前不推薦雙膦酸鹽作為乳腺癌術后輔助治療用藥。
5.6.3 乳腺癌患者抗腫瘤治療引起的骨丟失
抗腫瘤治療引起的骨丟失 (cancer treatmentinduced bone loss,CTIBL)是應該引起重視的臨床問題,可以發生在老年患者、化療后、激素治療尤其是卵巢功能抑制和芳香化酶抑制劑治療后,根據ASCO骨健康指南,應該檢測骨密度(BMD),并根據結果考慮是否使用雙膦酸鹽藥物。ASCO指南建議所有年齡超過 65歲,或年齡在60~64歲,但有以下危險因素之一:骨質疏松家族史、體重<70 kg、曾發生過非創傷性骨折或其他危險因素的患者常規檢查BMD。ASCO指南同時建議絕經后婦女無論年齡只要正在接受AI治療,絕經前婦女正在接受可能導致早絕經的治療(化療,卵巢去勢)的患者都應該常規檢查BMD。BMD評分(T-Score)低于-2.5開始使用雙膦酸鹽;BMD評分在-2.5到-1.0之間患者考慮使用雙膦酸鹽;而BMD評分高于-1.0的患者則不建議使用雙膦酸鹽。雙膦酸鹽治療骨質疏松的用法和治療骨轉移的用法不一樣,可以每3~6個月使用1次,并且要根據治療后BMD評分的改變調整用藥。而乳腺癌患者由于其年齡和治療均有可能存在骨質疏松,醫生應常規對這些女性的骨骼健康進行評估,目前不推薦將雙膦酸鹽用于骨質疏松的預防。
5.6.4 發生SREs后是否換藥預防SREs再次發生的問題發生某些特殊SREs(高鈣、骨手術、放療)后,在臨床研究中會作為觀察終點停止使用雙膦酸鹽,但臨床實踐中不應該停用,而應該繼續用藥。但某一類雙膦酸鹽使用過程發生首次骨轉移加重的 SRE后,可以考慮換用另一類雙膦酸鹽。也有專家認為換藥是否獲益有待更多的臨床研究數據支持。

