釓布醇注射液的藥理作用和臨床評價
王春穎,司延斌,趙志剛
首都醫科大學附屬北京天壇醫院藥劑科,北京 100050
釓布醇注射液是用于中樞神經系統對比增強磁共振成像(CE-MRI)(包括腦、脊柱等)和對比增強磁共振血管造影(CE-MRA)的細胞外對比劑。釓布醇注射液是拜耳先靈醫藥所研發和生產的一種診斷用藥,其化學名稱為:10-(2,3-二羥基-1-羥甲基丙基)-1,4,7,10-四氮雜環十二烷-1,4,7-三乙酸,釓復合物。分子式:C18H31GdN4O9,相對分子質量為604.72,CAS登記號:138071-82-6。釓布醇注射液的釓濃度兩倍于常規MR對比劑,因其釓濃度的加倍,適用于大劑量對比劑使用時的手動注射[1,2]。其濃度可達到其它含釓對比劑的兩倍,能更清楚地顯示小病灶,尤其是轉移瘤病灶。
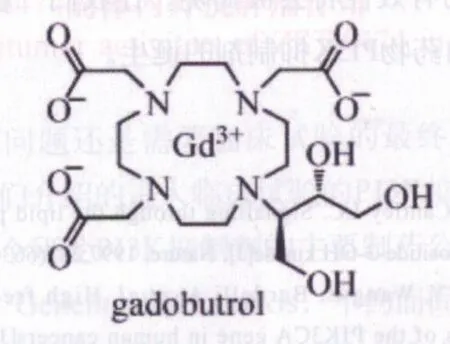
圖1 釓布醇的結構式Fig 1 Structural formula of Gadobutrol
1 藥理學
釓布醇注射液是一種用于磁共振成像(MRI)的順磁性對比劑,對比增強效應是由釓布醇調節的,釓布醇是由釓(Ⅲ價)和大環配基二羥基-羥甲基丙基-四氮雜環十二烷-三乙酸(布醇)構成。釓布醇是一種細胞外分布、非組織特異的、電中性的非離子型水溶性含釓對比劑,具有遲豫性高、穩定性好、粘滯性及滲透性較低等特點[1]。
1.1 腦 釓布醇可以自血腦屏障(BBB)破壞處進入細胞外液,縮短病灶的T1、T2,而正常腦組織不強化,從而增加兩者信號對比,顯示顱內病灶。釓布醇注射液常常用于原發性腫瘤、轉移性腫瘤或中樞系統感染導致的可疑的腦部病變的患者。可顯著增強無血腦屏障或血腦屏障受損的病灶[2]。
在大鼠模型中,針對釓布醇與釓噴酸葡胺(馬根維顯)和釓特醇(ProHance)的神經毒性進行了研究和比較。釓布醇和釓特醇是大環類和非離子型Gd螯合劑。在1mmol/kg體重的劑量水平下,只有釓特醇(3/10只動物)組出現了嚴重的不良事件,例如驚厥、正向反射喪失甚至死亡,而釓布醇僅導致中度不良反應,例如面部抽搐或頭部抽搐。釓布醇不能通過完整的血腦屏障,因此不會在健康腦組織或具有完整血腦屏障的病灶中蓄積。
1.2 心臟 在麻醉后的狗中,以2 mL/min的速度靜脈注射釓布醇,注射量分別為0.25和1.25 mmol/kg體重,進行靜脈注射心血管耐受性研究,以生理鹽水注射液作為對照藥物。研究期間,在小劑量組中,可出現一過性的血壓升高和心肌收縮力增加,并且比生理鹽水對照組高5%;而在大劑量組中,血壓和心肌收縮力比對照組高10%~15%。這些不良反應的生理性反應和臨床相關性極小,并且在15min內完全好轉[2]。
1.3 腎臟 在家兔中,以注射速度為10 mL/min,劑量為2 mmol/kg體重進行釓布醇靜脈注射,評估其對腎功能的影響。未發現蛋白排泄率增加,尿液中的酶活性未提示有與藥物相關的改變。腎臟組織學檢查未發現任何異常[3,4]。
1.4 對紅細胞的影響 關于紅細胞形態學改變的體外實驗是評估對比劑與細胞膜的相互作用的簡便的方法。將紅細胞與最大濃度大于70 mmol Gd/L的釓布醇共同孵育后,未發現紅細胞形態學發生相關的變化。
1.5 對凝血系統的影響 研究發現在任何劑量水平的釓布醇組中,出血時間與生理鹽水對照組相比沒有統計學意義。
2 毒理學
臨床前常規的安全藥理學試驗、重復劑量毒性試驗、遺傳毒性試驗和潛在接觸致敏性試驗結果沒有顯示出對人體的特殊危害。
在急性靜脈毒性的研究中,雌性和雄性小鼠(每組八只動物)在給予15 mmol/kg體重注射的試驗組中,未出現死亡,而在20 mmol/kg體重劑量組中,只有一只動物死亡。釓布醇注射液的LD為23 mmol/kg體重,95%置信區間為20~27 mmol/kg體重[4]。
在三種動物(大鼠、家兔和短尾猴)中進行的生育力或產前/產后毒性研究中,在有效劑量的范圍內無致畸效應。只有在大劑量給藥后,三種動物的流產率輕微增高。
通過Ames沙門桿菌實驗、大腸桿菌WP2、中國倉鼠細胞的HGPRT實驗、人類淋巴細胞實驗和小鼠微核試驗進行了誘變性研究。在這些研究中,未發現任何遺傳毒性或誘變性[5]。
3 藥動學
在1.5T設備上應用三種不同對比劑的2種不同劑量(0.05和0.1mmol/kg)對豬進行對比增強MRA的評價研究顯示,全劑量釓MRA影像質量高于半劑量的影像質量,測量信噪比(SNR)也顯著增高。釓布醇與Gd-d-BOPTA全劑量時增強特點相似,但半劑量時釓布醇表現更優。
靜脈注射后,釓布醇迅速分布到細胞外間隙,血漿蛋白結合率為3%,人體中,釓布醇的藥代動力學呈劑量依賴性,為一級動力學,劑量增加至0.4 mmol/kg體重釓布醇,經過一個早期分布相后,釓布醇的血漿濃度下降,平均終末半衰期為1.8h(1.3~2.1h),這與腎臟消除速率相當。
健康人的釓布醇腎臟清除率為1.1~1.7 mL/min·kg,與菊粉的腎臟清除率相當,顯示了釓布醇主要通過腎小球濾過作用排出,少于0.1%的劑量是通過糞便排出的,在血漿和尿液中未測得任何代謝產物。動物實驗表明,極少量的釓布醇注射液(少于應用劑量的0.01%)進入了乳汁。至今為止,尚未研究在人體中釓布醇注射液是否進入乳汁。故應用釓布醇注射液后,24 h以內建議禁止進行哺乳。
腎功能不全患者釓布醇排泄時間延長。在肌酐清除率小于80 mL/min但大于30 mL/min,其清除半衰期延長至9 h,而在肌酐清除率小于30 ml/min的患者中,清除半衰期延長至44 h。在接受透析的患者中,經過3次常規透析后,95%以上的給藥劑量被清除。
4 安全性評價
1.0 mmol/L釓布醇的日最高安全劑量達15 mL/Kg。劑量為0.1 mmol/kg時,不良反應發生率為2.4%。臨床試驗期間,不良反應發生率為8.5%。目前,尚無釓布醇在18歲以下人群中進行臨床試驗的報道。除臨床試驗外,還有來自300多個中心的6000多例患者數據信息顯示用于全身不同部位CE-MRI和CE-MRA具有良好的安全性。在臨床試驗和臨床常規中被證實可用做良好的給藥方案,具備在大劑量單次推注后具有良好耐受性。在健康志愿者的劑量增加研究中,即使劑量高達1.5 mmol/kg體重也被證實具有良好的耐受性[6]。釓布醇注射液的推薦劑量為0.3 mmol/kg體重,追加的安全范圍至少要高2~3倍。在肝功能受損、腎功能受損或過敏體質患者、或老年患者中,未觀察到相關差異。
釓布醇注射液不良反應少見,主要為:頭痛、頭暈、感覺異常、味覺障礙、惡心、血管舒張,注射部位疼痛、注射部位反應等。罕見不良反應有:嗅覺異常、呼吸困難、嘔吐、蕁麻疹、皮疹,過敏反應等。
過敏反應(如蕁麻疹、皮疹、血管舒張)曾偶爾被報告過,大多數是輕至中度的。這些反應大多發生在給予對比劑后半小時內。在罕見病例中,曾觀察到遲發的過敏反應(幾小時至幾天后)。建議對患者進行操作后觀察。如果存在下列情況,發生過敏反應的危險性會升高:既往對比劑過敏反應史,支氣管哮喘史,過敏性疾病史。與其它含釓螯合物的對比劑相同,對于癲癇閾值低的患者,需要特別小心。
5 適應證及用法用量
本藥品僅用于診斷。用于頭部和脊柱磁共振成像中的對比劑增強以及磁共振血管造影術中的對比劑增強。
成人在顱腦和脊髓磁共振成像中的推薦給藥劑量為0.1 mmol/kg體重,相當于0.1 mL/kg體重的1.0 M溶液。如果MRI增強掃描未見異常而臨床仍高度懷疑有病灶存在,或更精確的信息會影響患者的治療時,可在第一次給藥后的30min內再注射至多0.2 mmol/kg體重的釓布醇注射液,來提高診斷的準確率。兒童由于缺乏有效性和安全性的數據,因此不推薦對未滿18歲的患者使用釓布醇注射液。對老年患者的使用沒有特殊限制。
6 藥物的配伍禁忌
對比劑和靜脈用藥之間的相互作用可能導致沉淀形成,增加血管閉塞的風險。為了研究釓布醇與臨床常用藥物之間可能發生的相互作用,將對比劑和相應的藥物(上市制品)混合,并在2h內對混合物出現的沉淀或顏色改變進行檢查。
釓布醇與以下藥物不存在任何體外配伍禁忌:氨芐西林、琥珀酸氫化可的松、硫酸阿托品、利多卡因、西咪替丁、甲基潑尼松龍、地西泮、硝酸甘油、腎上腺素、苯吡丙胺、呋塞米、硫酸魚精蛋白、慶大霉素、茶堿、肝素、妥拉唑林。
7 禁忌證
對本品的組成成分過敏者禁用。對其它釓螯合物有過敏反應或可疑過敏反應史的患者也不應使用本品。
8 注意
單次給藥于人體的潛在風險未知。除非明確必需的情況下,釓布醇注射液不應該用于妊娠期婦女。
[1] Singh P.Azilsartan:a next-generation angiotensin 11 receptor blocker for the treatment of hypertension [J].Formulary,2010, 45(11):342-346,349.
[2] Tombach B., Heindel W. Value of 1.0- M gadolinium chelates: review of preclinical and clinical data on gadobutrol[J]. Eur Radiol,2002,12(6): 1550–1556.
[3] Balzer J,Loewe C,Davis K,et al.Safety of contrast-enhanced MR angiography employing gadobutrol 1.0 M as contrast material[J].Eur.Radiol,2003,13(9):2067-2074.
[4] Huppertz A., Rohrer M. Gadobutrol, a highly concentrated MR-imaging contrast agent: its physicochemical characteristics and the basis for its use in contrast-enhanced MR angiography and perfusion imaging[J].Eur Radiol, 2004,14 (5): 12–18.
[5] Vogler H., Platzek J., Schuhmann-Giampieri G., et al. Pre-clinical evaluation of gadobutrol: a new, neutral, extracellular contrast agent for magnetic resonance imaging[J]. Eur J Radiol,1995, 21(1):1-10.
[6] Staks T., Schuhmann-Giampieri G., Frenzel T., et al. Pharmacokinetics,dose proportionality, and tolerability of gadobutrol after single intravenous injection in healthy volunteers[J]. Invest Radiol,1994,29(7):709-715.

